Диаграмма Пурбе

В электрохимии и, в более общем плане, в химии растворов, диаграмма Пурбе , также известная как диаграмма потенциал/pH , диаграмма EH . –pH или диаграмма pE/pH , представляет собой график возможных термодинамически стабильных фаз ( т. е находящихся в химическом равновесии ). водной электрохимической системы. Границы (50 %/50 %) между преобладающими химическими веществами (водными ионами в растворе или твердыми фазами) представлены линиями. Таким образом, диаграмму Пурбе можно читать так же, как стандартную фазовую диаграмму с другим набором осей. Подобно фазовым диаграммам, они не учитывают скорость реакции или кинетические эффекты. Помимо потенциала и pH, равновесные концентрации также зависят, например, от температуры, давления и концентрации. Диаграммы Пурбе обычно даются при комнатной температуре, атмосферном давлении и молярной концентрации 10 −6 и изменение любого из этих параметров приведет к другой диаграмме.
Диаграммы названы в честь Марселя Пурбе (1904–1998), российского происхождения бельгийского химика , который их изобрел.
Мы
[ редактировать ]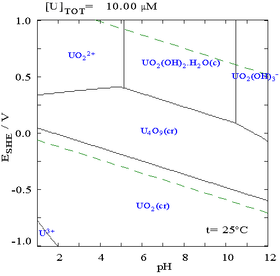
Диаграммы Пурбе также известны как диаграммы E H -pH из-за обозначения двух осей.
Диаграмма
[ редактировать ]Вертикальная ось обозначена E H для потенциала напряжения относительно стандартного водородного электрода (SHE), рассчитанного по уравнению Нернста . «H» означает водород, хотя могут использоваться и другие стандарты, и они предназначены только для комнатной температуры.
Для обратимой окислительно-восстановительной реакции, описываемой следующим химическим равновесием :
- а А + б В ⇌ в С + d D
С соответствующей константой равновесия K :
Уравнение Нернста:
иногда формулируется как:
или, проще говоря, выражаясь численно как:
где:
- вольт — тепловое напряжение или «наклон Нернста» при стандартной температуре.
- λ = ln(10) ≈ 2,30, так что вольт.
Горизонтальная ось отмечена pH для функции −log H. + активность ионов.
Линии на диаграмме Пурбе показывают условия равновесия, то есть условия равенства активностей для видов по обе стороны от этой линии. Вместо этого можно сказать, что по обе стороны линии преобладает одна форма вида. [3]
Чтобы нарисовать положение линий уравнения Нернста, необходимо определить активность химических веществ, находящихся в равновесии. Обычно активность частиц приближают к концентрации (для растворимых веществ) или парциальному давлению (для газов). Одни и те же значения следует использовать для всех видов, присутствующих в системе. [3]
Для растворимых веществ линии часто проводятся для концентраций 1 М или 10 М. −6 М. Иногда для других концентраций проводят дополнительные линии.
Если диаграмма представляет собой равновесие между растворенными веществами и газом, давление обычно устанавливается равным P. 0 = 1 атм = 101 325 Па — минимальное давление, необходимое для выделения газа из водного раствора при стандартных условиях. [3]
Кроме того, изменение температуры и концентрации сольватированных ионов в растворе будет смещать линии равновесия в соответствии с уравнением Нернста.
Диаграммы также не учитывают кинетические эффекты, а это означает, что виды, показанные как нестабильные, на практике могут не реагировать в сколько-нибудь существенной степени.
Упрощенная диаграмма Пурбе указывает на области «иммунитета», «коррозии» и «пассивности» вместо стабильных видов. Таким образом, они дают представление о стабильности конкретного металла в конкретной среде. Иммунитет означает, что металл не подвергается воздействию, тогда как коррозия показывает, что произойдет общее воздействие. Пассивация происходит, когда металл образует на своей поверхности устойчивое покрытие из оксида или другой соли. Лучшим примером является относительная стабильность алюминия из-за слоя оксида алюминия, образующегося на его поверхности при воздействии воздуха.
Применимые химические системы
[ редактировать ]
Хотя такие диаграммы можно нарисовать для любой химической системы, важно отметить, что добавление агента, связывающего металл ( лиганда ), часто приводит к изменению диаграммы. Например, карбонат ( CO 2− 3 ) оказывает большое влияние на диаграмму урана. (См. диаграммы справа). Присутствие следовых количеств определенных веществ, таких как ионы хлорида, также может сильно повлиять на стабильность определенных веществ, разрушая пассивирующие слои.
Ограничения
[ редактировать ]Несмотря на то, что диаграммы Пурбе полезны для оценки потенциала коррозии металла, они имеют, однако, некоторые важные ограничения: [4] : 111
- Всегда предполагается равновесие, хотя на практике оно может отличаться.
- Диаграмма не дает информации о фактических скоростях коррозии.
- Не распространяется на сплавы. [а]
- Не указывает, является ли пассивация (в виде оксидов или гидроксидов) защитной или нет. Возможна диффузия ионов кислорода через тонкие оксидные слои.
- Исключает коррозию хлорид-ионами ( кл. − , кл. 3+ и т. д.). [б]
- Обычно применимо только к температуре 25 °C (77 °F), которая принимается по умолчанию. Существуют диаграммы Пурбе для более высоких температур.
Выражение уравнения Нернста в зависимости от pH
[ редактировать ]The и pH раствора связаны уравнением Нернста, которое обычно представляется диаграммой Пурбе ( – pH график ) . явно обозначает выражается по сравнению со стандартным водородным электродом (SHE). Для уравнения полуячейки , условно записанного как реакция восстановления ( т. е . электроны, принятые окислителем с левой стороны):
Константа равновесия K этой реакции восстановления равна:
где фигурные скобки { } обозначают активность ( a ), прямоугольные скобки [ ] обозначают молярную или моляльную концентрацию ( C ), представляют коэффициенты активности , а стехиометрические коэффициенты показаны в виде показателей степени.
Активности соответствуют термодинамическим концентрациям и учитывают электростатические взаимодействия между ионами, присутствующими в растворе. Когда концентрации не слишком высоки, активность ( ) может быть связано с измеримой концентрацией ( ) линейной зависимостью от коэффициента активности ( ):
полуклетки Потенциал восстановления стандарта дается
где — стандартное изменение свободной энергии Гиббса , z — количество вовлеченных электронов, а F — постоянная Фарадея . Уравнение Нернста связывает pH и следующее:
Далее наклон Нернста (или тепловое напряжение ) используется , который имеет значение 0,02569... В при STP . При использовании логарифмов с основанием 10 V T λ = 0,05916... V при STP, где λ = ln[10] = 2,3026.
Это уравнение представляет собой уравнение прямой для в зависимости от pH с наклоном вольт (у pH нет единиц измерения).
Это уравнение предсказывает более низкую при более высоких значениях pH. Это наблюдается при восстановлении O 2 до H 2 O, или OH − , а для уменьшения H + в Н 2 . тогда часто отмечают как чтобы указать, что речь идет о стандартном водородном электроде (SHE), чей = 0 условно в стандартных условиях (T = 298,15 K = 25 ° C = 77 F, газ P = 1 атм (1,013 бар), концентрации = 1 M и, следовательно, pH = 0).
Расчет диаграммы Пурбе
[ редактировать ]Когда деятельность ( ) можно считать равными молярной или моляльной концентрации ( ) в достаточно разбавленных концентрациях, когда коэффициенты активности ( ) стремятся к единице, член, перегруппировывающий все коэффициенты активности, равен единице, и уравнение Нернста можно записать просто с концентрациями ( ) обозначено здесь квадратными скобками [ ]:
На диаграмме Пурбе есть три типа границ линий: вертикальные, горизонтальные и наклонные. [5] [6]
Вертикальная граница
[ редактировать ]Когда электронами не обмениваются ( z = 0), равновесие между A , B , C и D зависит только от [H + ] и не зависит от потенциала электрода. В этом случае реакция представляет собой классическую кислотно-основную реакцию, включающую только протонирование /депротонирование растворенных частиц. Граничная линия будет представлять собой вертикальную линию при определенном значении pH. Уравнение реакции можно записать:
а энергетический баланс записывается как , где K – константа равновесия :
Таким образом:
или, в десятичных логарифмах,
которое можно решить для конкретного значения pH.
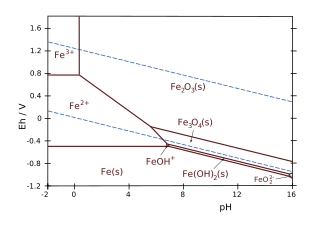
Например [5] рассмотрим систему железо-вода и линию равновесия между ионом трехвалентного железа Fe 3+ ион и гематит Fe 2 O 3 . Уравнение реакции:
который имеет . [5] Затем можно рассчитать pH вертикальной линии на диаграмме Пурбе:
Поскольку активности (или концентрации) твердых фаз и воды равны единице:
[Fe 2 O 3 ] = [H 2 O] = 1, pH зависит только от концентрации растворенного Fe 3+
:
В STP для [Fe 3+ ] = 10 −6 , это дает pH = 1,76.
Горизонтальная граница
[ редактировать ]Когда Ч + и ох − ионы в реакции не участвуют, линия границы горизонтальна и не зависит от pH.
Уравнение реакции записывается таким образом:
Как и стандартная свободная энергия Гиббса :
Используя определение электродного потенциала ∆G = -zFE , где F — постоянная Фарадея , это можно переписать в виде уравнения Нернста:
или, используя логарифмы по основанию 10:
Для равновесия Fe 2+
/ Фе 3+
, взятый здесь в качестве примера, учитывая линию границы между Fe 2+ и Fe 3+ , уравнение полуреакции:
Поскольку Ч + ионы не участвуют в этой окислительно-восстановительной реакции, она не зависит от pH. Э тот = 0,771 В, при этом в окислительно-восстановительной реакции участвует только один электрон. [7] Потенциал E h является функцией температуры через тепловое напряжение. и напрямую зависит от соотношения концентраций Fe 2+
и Fe 3+
ионы:
Для обоих ионных частиц при одинаковой концентрации (например, ) при STP log 1 = 0, поэтому , а границей будет горизонтальная линия при E h = 0,771 вольт. Потенциал будет меняться в зависимости от температуры.
Наклонная линия границы
[ редактировать ]В этом случае и электроны, и H + участвуют ионы, а потенциал электрода зависит от pH. Уравнение реакции можно записать:
Используя выражения для свободной энергии через потенциалы, баланс энергии задается уравнением Нернста:
В примере с железом и водой, учитывая границу между ионами двухвалентного железа Fe 2+ и гематита Fe 2 O 3 , уравнение реакции:
- с . [5]
Уравнение граничной линии, выраженное в десятичных логарифмах:
Так, активности, или концентрации, твердых фаз и воды всегда принимаются равными единице по соглашению при определении константы равновесия К : [Fe 2 O 3 ] = [H 2 O] = 1.
Таким образом, уравнение Нернста ограничивается растворенными частицами Fe. 2+
и Х + пишется как:
Ибо [Fe 2+ ] = 10 −6 М, это дает:
Обратите внимание на отрицательный наклон (-0,1775) этой линии на диаграмме E h – pH.
Область стабильности воды
[ редактировать ]
Во многих случаях возможные условия в системе ограничены областью стабильности воды. На диаграмме Пурбе для урана, представленной здесь выше, пределы устойчивости воды отмечены двумя пунктирными зелеными линиями, а область стабильности воды находится между этими двумя линиями. Здесь это также изображено рядом с двумя пунктирными красными линиями на упрощенной диаграмме Пурбе, ограниченной только областью устойчивости воды.
В сильно восстановительных условиях (низкий E H ) вода восстанавливается до водорода по формуле: [3]
- (при низком pH)
и,
- (при высоком pH)
Используя уравнение Нернста, положив E 0 = 0 В, как определено по соглашению для стандартного водородного электрода (SHE, служит эталоном в ряду потенциалов восстановления) и летучести газообразного водорода (соответствующей химической активности газа) при 1, уравнение для нижней линии стабильности воды на диаграмме Пурбе при стандартных температуре и давлении составляет:
Ниже этой линии вода восстанавливается до водорода, и обычно невозможно выйти за пределы этой линии, пока в системе еще присутствует вода, подлежащая восстановлению.
Соответственно, в сильно окислительных условиях (высокая E H ) вода окисляется до газообразного кислорода по формуле: [3]
- (при низком pH)
и,
- (при высоком pH)
Используя уравнение Нернста, как указано выше, но с E 0 = −ΔG 0 H 2 O /2 F = 1,229 В для окисления воды дает верхний предел стабильности воды в зависимости от значения pH:
при стандартной температуре и давлении. Выше этой линии вода окисляется с образованием газообразного кислорода, и обычно невозможно пройти за эту линию, пока в системе еще присутствует вода, подлежащая окислению.
Две верхняя и нижняя линии стабильности имеют одинаковый отрицательный наклон (единица -59 мВ/pH), они параллельны на диаграмме Пурбе, и потенциал восстановления уменьшается с ростом pH.
Приложения
[ редактировать ]Диаграммы Пурбе имеют множество применений в различных областях, например , коррозии в проблемах , геохимии и науках об окружающей среде . Правильное использование диаграммы Пурбе поможет пролить свет не только на природу веществ, присутствующих в водном растворе или твердых фазах , но также может помочь понять механизм реакции . [8]
Понятие ПЭ в химии окружающей среды
[ редактировать ]Диаграммы Пурбе широко используются для описания поведения химических веществ в гидросфере . В этом контексте часто используется восстановительный потенциал pe вместо E H . [3] Основное преимущество – прямая работа с логарифмической шкалой. pe — безразмерное число, и его можно легко связать с E H уравнением:
Где, — тепловое напряжение , R — газовая постоянная ( 8,314 Дж⋅К −1 ⋅mol −1 ), T , абсолютная температура в Кельвинах (298,15 K = 25 ° C = 77 ° F) и F , постоянная Фарадея (96 485 кулонов/моль e − ). Лямбда, λ = ln(10) ≈ 2,3026.
Более того,
- , выражение по форме похожее на pH.
Значения pe в химии окружающей среды колеблются от -12 до +25, поскольку при низком или высоком потенциале вода будет соответственно восстанавливаться или окисляться. В экологических приложениях концентрация растворенных веществ обычно устанавливается на уровне от 10 −2 М и 10 −5 М для определения линий равновесия.
Галерея
[ редактировать ]- Fe–H 2 O
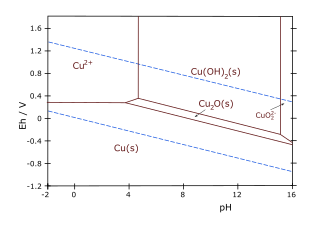
- Cu–H 2 O
- Au–H 2 O
- Al–H 2 O
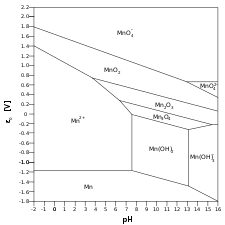
- Mn–H 2 O
- Zn–H 2 O–CO 3 2–
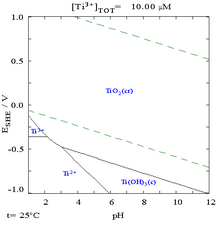
- Ti–H 2 O
См. также
[ редактировать ]- Уравнение Нернста
- Зависимость восстановительного потенциала от pH
- Диаграмма Эллингема
- Диаграмма Латимера
- Диаграмма заморозков
- Схема ионного распределения
- Бьеррумский сюжет
Примечания
[ редактировать ]Ссылки
[ редактировать ]- ^ «Университет Западного Орегона» .
- ^ Перейти обратно: а б . Игнаси Пучдоменек, База данных химического равновесия Hydra/Medusa и программное обеспечение для построения графиков (2004) Королевский технологический институт KTH, программное обеспечение, которое можно бесплатно загрузить по адресу «KTH - Программное обеспечение по химии / химическому равновесию» . Архивировано из оригинала 29 сентября 2007 г. Проверено 29 сентября 2007 г.
- ^ Перейти обратно: а б с д и ж ван Лун, Гэри; Даффи, Стивен (2011). Химия окружающей среды – глобальная перспектива (3-е изд.). Издательство Оксфордского университета. стр. 235–248. ISBN 978-0-19-922886-7 .
- ^ Перейти обратно: а б с Маккафферти, Э. (2010). Введение в науку о коррозии . Нью-Йорк: Спрингер. ISBN 978-1-4419-0454-6 . OCLC 663096583 .
- ^ Перейти обратно: а б с д Веринк, ЭД-младший (2000). «Упрощенная процедура построения диаграмм Пурбе» (PDF) . В Реви, Р. Уинстон (ред.). Справочник Улига по коррозии . Джон Уайли и сыновья, Inc. ISBN 0471157775 . Архивировано из оригинала (PDF) 6 августа 2020 года . Проверено 12 февраля 2021 г.
- ^ Копелиович, Дмитрий. «Диаграммы Пурбе» . СабсТех . Проверено 29 марта 2017 г.
- ^ «Химия железа в природной воде» (PDF) . Документ Геологической службы по водоснабжению 1459 . 1962 год . Проверено 29 марта 2017 г.
- ^ Нойхаузер, Томер; Бельмар-Алфорд, Дафни; Пейн, Николас А.; Мартино, Эрик; Маузеролл, Джанин (июль 2018 г.). «Раскрытие скрытых реакций в гальванических элементах» . Электрокатализ . 9 (4): 531–538. дои : 10.1007/s12678-018-0459-1 . S2CID 104177121 .
- Брукинс, Д.Г. (1988). Диаграммы Eh-pH для геохимии . Спрингер-Верлаг. ISBN 0-387-18485-6 .
- Джонс, Денни А. (1996). Принципы и предотвращение коррозии (2-е изд.). Прентис Холл. стр. 50–52. ISBN 0-13-359993-0 .
- Пурбе, М. (1974). Атлас электрохимических равновесий в водных растворах (2-е изд.). Национальная ассоциация инженеров по коррозии. ISBN 9780915567980 .
- Такено, Наото (май 2005 г.). Атлас диаграмм Eh-pH (Взаимное сравнение термодинамических баз данных) (PDF) (Отчет). Цукуба, Ибараки, Япония: Национальный институт передовых промышленных наук и технологий: Исследовательский центр глубоких геологических сред . Проверено 16 мая 2017 г.
Внешние ссылки
[ редактировать ]- Марсель Пурбе — Доктора коррозии
- Пакет преподавания и обучения DoITPoMS - «Уравнение Нернста и диаграммы Пурбе»
Программное обеспечение
[ редактировать ]- ChemEQL Бесплатное программное обеспечение для расчета химического равновесия от Eawag .
- FactSage Коммерческий банк термодинамических данных, также доступный в виде бесплатного веб-приложения .
- The Geochemist's Workbench Коммерческое программное обеспечение для геохимического моделирования от Aqueous Solutions LLC.
- GWB Community Edition Бесплатная загрузка популярного пакета программного обеспечения для геохимического моделирования.
- HYDRA/MEDUSA Бесплатное программное обеспечение для создания диаграмм химического равновесия от KTH . химического факультета
- HSC Chemistry Коммерческое программное обеспечение для термохимических расчетов от Outotec Oy .
- PhreePlot Бесплатная программа для построения геохимических графиков с использованием Геологической службы США кода PHREEQC .
- Thermo-Calc Windows Коммерческое программное обеспечение для термодинамических расчетов от Thermo-Calc Software.
- Публичный веб-сайт Materials Project , который может генерировать диаграммы Пурбе на основе большой базы данных рассчитанных свойств материалов, размещенной в NERSC .
![{\displaystyle K={\frac {[C]^{c}[D]^{d}}{[A]^{a}[B]^{b}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0efa08e603e9d1b3ee7e0f3ac56b0503b331008e)

![{\displaystyle E_{\text{H}}=E^{0}-{\frac {RT}{zF}}\ln {\frac {[C]^{c}[D]^{d}}{ [А]^{а}[Б]^{б}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db2f7f69f79b51a2875472cbe0c1ddbc65bcbcfe)
![{\displaystyle E_{\text{H}}=E^{0}-{\frac {V_{T}\lambda }{z}}\log {\frac {[C]^{c}[D]^ {d}}{[A]^{a}[B]^{b}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e7fd7742bf3507ba72bb30ce42293f8ad4261866)
![{\displaystyle E_{\text{H}}=E^{0}-{\frac {0.05916}{z}}\log {\frac {[C]^{c}[D]^{d}}{ [А]^{а}[Б]^{б}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7269645d0f868a2c8bbd5b73ada796073447c4a1)






![{\displaystyle K={\frac {\{C\}^{c}\{D\}^{d}}{\{A\}^{a}\{B\}^{b}\{{ \ce {H+}}\}^{h}}}={\frac {(\gamma _{c})^{c}\left[C\right]^{c}\ (\gamma _{d} )^{d}\left[D\right]^{d}}{(\gamma _{a})^{a}\left[A\right]^{a}\ (\gamma _{b}) ^{b}\left[B\right]^{b}\ (\gamma _{h+})^{h}\left[{\ce {H+}}\right]^{h}}}={\ frac {(\gamma _{c})^{c}(\gamma _{d})^{d}}{(\gamma _{a})^{a}(\gamma _{b})^{ b}(\gamma _{h})^{h}}}{\text{×}}{\frac {\left[C\right]^{c}\left[D\right]^{d}} {\left[A\right]^{a}\left[B\right]^{b}\left[{\ce {H+}}\right]^{h}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db8c47798e7d074071a615df5e3af3961044cccb)












![{\displaystyle E_{h}=E_{\text{red}}=E_{\text{red}}^{\ominus }-{\frac {0.05916}{z}}\log \left({\frac { \left[C\right]^{c}\left[D\right]^{d}}{\left[A\right]^{a}\left[B\right]^{b}}}\right )-{\frac {0.05916\,h}{z}}{\text{pH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/283a9fe881fa441d01c337d10f7a6e85bf3dd651)


![{\displaystyle K={\frac {\left[C\right]^{c}\left[D\right]^{d}}{\left[A\right]^{a}\left[B\right] ]^{b}\left[{\ce {H+}}\right]^{h}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77a14dc085fb0d8ed3b442aa618fd6167506845d)
![{\displaystyle \Delta G^{\circ }=-RT\ln \left({\frac {\left[C\right]^{c}\left[D\right]^{d}}{\left[ A\right]^{a}\left[B\right]^{b}\left[{\ce {H+}}\right]^{h}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f700e3ac9c2fc68f8ad9ee7a5674555b77e5c2a2)
![{\displaystyle \Delta G^{\circ }=-RT\lambda \,\left(\log \left({\frac {\left[C\right]^{c}\left[D\right]^{ d}}{\left[A\right]^{a}\left[B\right]^{b}}}\right)+h\,{\ce {pH}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6f320dae44421362b42c122bb5fefd396468a3ad)


![{\displaystyle {\ce {pH}}=-{\frac {1}{6}}\left({\frac {\Delta G^{\circ }}{RT\lambda }}+\log \left( {\frac {{\ce {[Fe2O3]}}}{{\ce {[Fe^{3+}]^2[H2O]^3}}}}\right)\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1e9b6b1f5d8a86be8e29cb048ef827940878a4a4)
![{\displaystyle {\ce {pH}}=-{\frac {1}{6}}\left({\frac {\Delta G^{\circ }}{RT\lambda }}+\log \left( {\frac {1}{[{\ce {Fe^{3+}}}]^{2}}}\right)\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d81d7344121f12ae407118dc20b8fc850372b257)

![{\displaystyle \Delta G^{\circ }=-RT\ln \left({\frac {\left[C\right]^{c}\left[D\right]^{d}}{\left[ A\right]^{a}\left[B\right]^{b}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77872903c344ee8522e5eaaefffdc3e85963fa4d)
![{\displaystyle E_{h}={E^{\circ }}-{\frac {V_{T}}{z}}\ln \left({\frac {\left[C\right]^{c} \left[D\right]^{d}}{\left[A\right]^{a}\left[B\right]^{b}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e6977406e65dcda045cf0cbaad4782e045b907a3)
![{\displaystyle E_{h}={E^{\circ }}-{\frac {V_{T}\lambda }{z}}\log \left({\frac {\left[C\right]^{ c}\left[D\right]^{d}}{\left[A\right]^{a}\left[B\right]^{b}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/44a332f15c0d7512469a1a8b0ed0f69f6d0a00fb)


![{\displaystyle E_{h}={E^{\circ }}-V_{T}\lambda \log \left({\frac {{\ce {[Fe^{2+}]}}}{{\ ce {[Fe^{3+}]}}}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5755676607ee2373af241565bfac30a00e7838cd)


![{\displaystyle E_{h}={E^{\circ }}-{\frac {V_{T}\lambda }{z}}\left(\log \left({\frac {\left[C\right ]^{c}\left[D\right]^{d}}{\left[A\right]^{a}\left[B\right]^{b}}}\right)+h\,{ \ce {pH}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1e181f6aec9bd252b50fe095dd9edaf05157913)


![{\displaystyle E_{h}={E^{\circ }}-{\frac {V_{T}\lambda }{2}}\left(\log \left({\frac {{\ce {[Fe ^{2+}]^2[H2O]^3}}}{{\ce {[Fe2O3]}}}}\right)+6\ {\ce {pH}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/902998434ac96ba653b671a30d926988cb46b122)
![{\displaystyle E_{h}={E^{\circ }}-{\frac {V_{T}\lambda }{2}}\left(\log \ {\ce {[Fe^{2+}] ^2}}+6\ {\ce {pH}}\right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/520856bc2bd34b111f02dc552b4a3fdaf923790c)











![{\displaystyle pe=-\log[e^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e26e524de25ff6405613eec07ac3d67bcfdf0dbc)