Оксид свинца(II)

| |

| |
| Имена | |
|---|---|
| Название ИЮПАК
Оксид свинца(II)
| |
| Другие имена | |
| Идентификаторы | |
3D model ( JSmol )
|
|
| КЭБ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.013.880 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID
|
|
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 3288 2291 3077 |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| PbO | |
| Молярная масса | 223.20 g/mol |
| Появление | красный или желтый порошок |
| Плотность | 9,53 г/см 3 |
| Температура плавления | 888 ° C (1630 ° F; 1161 К) |
| Точка кипения | 1477 ° C (2691 ° F; 1750 К) |
| 0,017 г/л [1] | |
| Растворимость | нерастворим в разбавленных щелочах , спирте растворим в концентрированных щелочах растворим в HCl , хлориде аммония |
| 4.20 × 10 −5 см 3 /моль | |
| Структура | |
| Четырехугольный , tP4 | |
| П4/нмм, №129 | |
| Опасности | |
| СГС Маркировка : | |
  
| |
| Опасность | |
| Х302 , Х332 , Х351 , Х360Дф , Х362 , Х373 , Х410 | |
| P201 , P202 , P260 , P261 , P263 , P264 , P270 , P271 , P273 , P281 , P301+P312 , P304+P312 , P304+P340 , P308+P313 , P312 , P314 , P330 , 391 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
LD Lo ( самый низкий опубликованный )
|
1400 мг/кг (собаки, перорально) [2] |
| Паспорт безопасности (SDS) | КМГС 0288 |
| Родственные соединения | |
Другие анионы
|
Сульфид свинца(II) Селенид свинца Теллурид свинца |
Другие катионы
|
Окись углерода Оксид кремния монооксид германия Оксид олова(II) |
| Оксид свинца(II,II,IV) Диоксид свинца | |
Родственные соединения
|
Оксид таллия(III) Оксид висмута(III) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Оксид свинца(II) , также называемый монооксидом свинца представляет собой неорганическое соединение с молекулярной формулой PbO . , PbO встречается в двух полиморфных модификациях : глет, имеющий тетрагональную кристаллическую структуру , и массикот, имеющий орторомбическую кристаллическую структуру . Современные применения PbO в основном связаны с и промышленной керамикой на основе свинца промышленным стеклом , включая компьютерные компоненты. Это амфотерный оксид. [3]
Типы
[ редактировать ]Оксид свинца существует двух типов:
- Красный тетрагонал (α-PbO), полученный при температуре ниже 486 ° C (907 ° F).
- Желтый орторомбический (β-PbO), полученный при температуре выше 486 ° C (907 ° F).
Синтез
[ редактировать ]PbO можно получить путем нагревания металлического свинца на воздухе примерно до 600 ° C (1100 ° F). При этой температуре он также является конечным продуктом разложения других оксидов свинца на воздухе: [4]
Термическое разложение нитрата свинца(II) или карбоната свинца(II) также приводит к образованию PbO:
PbO производится в больших масштабах в качестве промежуточного продукта при переработке сырых свинцовых руд в металлический свинец. Обычная свинцовая руда — галенит ( сульфид свинца (II) ). При температуре около 1000 ° C (1800 ° F) сульфид превращается в оксид: [5]
- 2 ПбС + 3 О
2 → 2 PbO + 2 SOSO2
Из свинца
[ редактировать ]Существует два основных метода получения монооксида свинца, оба из которых напоминают сжигание свинца при высокой температуре: [6]
- Метод горшка Бартона.
- Очищенные капли расплавленного свинца окисляются в емкости под принудительным потоком воздуха, который переносит их в систему разделения (например, циклонные сепараторы ) для дальнейшей обработки. [6] [7] : 245 Оксиды, полученные этим методом, в основном представляют собой смесь α-PbO и β-PbO. Общая реакция такая:
2 Pb + O 2 2PbO
- Метод шаровой мельницы
- Свинцовые шарики окисляются во вращающемся охлаждаемом барабане. Окисление достигается за счет столкновений шариков. Как и в методе Бартона, также можно использовать подачу воздуха и сепараторы. [6] [7] : 245
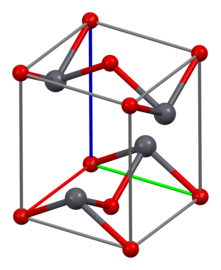
Структура
[ редактировать ]Как установлено методом рентгеновской кристаллографии , обе полиморфные модификации, тетрагональная и ромбическая, имеют пирамидальный четырехкоординатный свинцовый центр. В тетрагональной форме четыре связи свинец-кислород имеют одинаковую длину, но в ромбической две короче и две длиннее. Пирамидальная природа указывает на наличие стереохимически активной неподеленной пары электронов. [8] Когда PbO имеет тетрагональную структуру решетки, его называют глетом ; а когда PbO имеет ромбическую структуру решетки, его называют массикотом . PbO можно изменить с массикота на глет или наоборот путем контролируемого нагревания и охлаждения. [9] Тетрагональная форма обычно красного или оранжевого цвета, а ромбическая обычно желтого или оранжевого цвета, но цвет не является очень надежным индикатором структуры. [10] Тетрагональная и ромбическая формы PbO встречаются в природе как редкие минералы.
-
Pb имеет квадратно-пирамидальные координаты
-
Координаты О искажены – тетраэдрически
-
Элементарная ячейка
-
3×3×3 элементарные ячейки
-
Вдоль оси
-
По с оси
Реакции
[ редактировать ]Металлический свинец получают восстановлением PbO угарным газом при температуре около 1200 ° C (2200 ° F): [13]
- PbO + CO → Pb + CO 2
Красная и желтая формы этого материала связаны небольшим изменением энтальпии :
- PbO (красный) → PbO (желтый) Δ H = 1,6 кДж/моль
PbO амфотерен , то есть реагирует как с кислотами, так и с основаниями. С кислотами образует соли Pb 2+
через посредничество оксокластеров, таких как [Pb
6 О(ОН)
6 ] 4+
. В случае сильных оснований PbO растворяется с образованием солей плюмбита (также называемого плюмбатом (II)): [14]
- PbO + Н 2 О + ОН −
→ [Pb(OH)
3 ] −
Приложения
[ редактировать ]Свинцом в свинцовом стекле обычно является PbO, а PbO широко используется при производстве стекла. В зависимости от стекла, преимущество использования PbO в стекле может заключаться в одном или нескольких из увеличения показателя преломления стекла, увеличения дисперсии (т. е. уменьшения числа Аббе ) стекла, уменьшения вязкости стекла, увеличения электрических удельное сопротивление стекла и увеличение способности стекла поглощать рентгеновские лучи . Добавление PbO в промышленную керамику (а также в стекло) делает материалы более магнитно- и электрически инертными (за счет повышения их температуры Кюри ) и часто используется с этой целью. [15] Исторически PbO также широко использовался в керамических глазурях для бытовой керамики и используется до сих пор, но уже не так широко. Другие менее распространенные области применения включают вулканизацию резины и производство некоторых пигментов и красок. [3] PbO используется в стекле электронно-лучевой трубки для блокировки рентгеновского излучения, но в основном в горловине и воронке трубки, поскольку он может вызвать изменение цвета при использовании на лицевой панели. оксид стронция и оксид бария . Для лицевой панели предпочтительны [16]
Потребление свинца и, следовательно, переработка PbO коррелирует с количеством автомобилей, поскольку свинец остается ключевым компонентом автомобильных свинцово-кислотных аккумуляторов . [17]
Нишевое или сокращающееся использование
[ редактировать ]Смесь PbO с глицерином образует твердый водостойкий цемент , который использовался для соединения плоских стеклянных стенок и дна аквариумов , а также когда-то использовался для герметизации стеклянных панелей в оконных рамах. Это компонент свинцовых красок .
PbO был одним из сырьевых материалов для производства яиц века , разновидности китайских консервированных яиц . но его постепенно заменили из-за проблем со здоровьем. На некоторых небольших фабриках это была недобросовестная практика, но она получила широкое распространение в Китае и вынудила многих честных производителей маркировать свои коробки как «не содержащие свинец» после того, как скандал в 2013 году стал массовым.
В виде порошкообразного тетрагонального глета его можно смешать с льняным маслом , а затем кипятить, чтобы получить устойчивую к погодным условиям проклейку , используемую при позолоте . Глет придавал проклейке темно-красный цвет, благодаря чему сусальное золото выглядело теплым и блестящим, а льняное масло придавало клейкость и плоскую прочную поверхность скрепления.
PbO используется в некоторых реакциях конденсации в органическом синтезе . [18]
PbO — это входной фотопроводник в трубке видеокамеры, называемой плюмбикон .
Проблемы со здоровьем
[ редактировать ]
Оксид свинца может быть смертельным при проглатывании или вдыхании. Вызывает раздражение кожи, глаз и дыхательных путей. Он поражает ткани десен, центральную нервную систему, почки, кровь и репродуктивную систему. Он может биоаккумулироваться в растениях и млекопитающих. [19]
Ссылки
[ редактировать ]- ^ Оксид свинца(II) . Мерк
- ^ «Соединения свинца (как Pb)» . Непосредственно опасные для жизни и здоровья концентрации (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Перейти обратно: а б Карр, Додд С. (2005). «Соединения свинца». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a15_249 . ISBN 978-3527306732 .
- ^ Перейти обратно: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 382–387. ISBN 978-0-08-037941-8 .
- ^ Абдель-Рехим, AM (2006). «Термический и рентгеноструктурный анализ египетского галенита». Журнал термического анализа и калориметрии . 86 (2): 393–401. дои : 10.1007/s10973-005-6785-6 . S2CID 96393940 .
- ^ Перейти обратно: а б с Дикс, Дж. Э. (1 февраля 1987 г.). «Сравнение процессов производства оксида свинца в бартонной и шаровой мельницах» . Журнал источников энергии . 19 (2): 157–161. Бибкод : 1987JPS....19..157D . дои : 10.1016/0378-7753(87)80024-1 . ISSN 0378-7753 .
- ^ Перейти обратно: а б Павлов, Д. (2017). Свинцово-кислотные аккумуляторы: наука и техника: справочник по технологии свинцово-кислотных аккумуляторов и ее влиянию на изделие (2-е изд.). Сент-Луис. ISBN 978-0-444-59560-7 . OCLC 978538577 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) - ^ Уэллс, AF (1984), Структурная неорганическая химия (5-е изд.), Оксфорд: Clarendon Press, ISBN 0-19-855370-6 [ нужна страница ]
- ^ Простой пример приведен в Анил Кумар Де (2007). «§9.2.6 Свинец (Pb): монооксид свинца PbO» . Учебник неорганической химии . Нью Эйдж Интернэшнл. п. 383. ИСБН 978-81-224-1384-7 . Более сложный пример находится в Турова, Нью-Йорк (2002). «§9.4 Алкоксиды германия, олова, свинца» . Химия алкоксидов металлов . Спрингер. п. 115. ИСБН 978-0-7923-7521-0 .
- ^ Роу, Дэвид Джон (1983). Производство свинца в Великобритании: история . Крумский шлем. п. 16. ISBN 978-0-7099-2250-6 .
- ^ Пировано, Кэролайн; Ислам, М. Сайфул ; Ваннье, Роза-Ноэль; Новогроцкий, Гай; Майресс, Гаэтан (2001). «Моделирование кристаллических структур фаз Ауривиллиуса». Твердотельный ион. 140 (1–2): 115–123. дои : 10.1016/S0167-2738(01)00699-3 .
- ^ «Запись ICSD: 94333» . Кембриджская структурная база данных : Структуры доступа . Кембриджский центр кристаллографических данных . Проверено 1 июня 2021 г.
- ^ Обработка лидов @ Universalium.academic.ru . Альтернативный адрес: Обработка потенциальных клиентов @ Enwiki.net .
- ^ Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5 [ нужна страница ]
- ^ Глава 9, «Соединения свинца», в книге «Керамические и стеклянные материалы: структура, свойства и обработка» , опубликованной Springer, 2008 год.
- ^ Комптон, Кеннет (5 декабря 2003 г.). Качество изображения на ЭЛТ-дисплеях . СПАЙ Пресс. ISBN 9780819441447 – через Google Книги.
- ^ Сазерленд, Чарльз А.; Милнер, Эдвард Ф.; Керби, Роберт С.; Тейндл, Герберт; Мелин, Альберт; Болт, Герман М. «Свинец». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a15_193.pub2 . ISBN 978-3527306732 .
- ^ Корсон, Б.Б. (1936). «1,4-Дифенилбутадиен» . Органические синтезы . 16:28 ; Сборник томов , т. 2, с. 229 .
- ^ «Оксид свинца(II)» . Международный информационный центр по безопасности и гигиене труда. Архивировано из оригинала 15 декабря 2011 г. Проверено 6 июня 2009 г.

![{\displaystyle {\ce {PbO2->[{293 °C}] Pb12O19 ->[{351 °C}] Pb12O17 ->[{375 °C}] Pb3O4 ->[{605 °C}] PbO}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/65b5cadcc73921d39d6f69f4b6d59a4227e2b780)