Триоксид азота
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК N -оксонитрамид [1] | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.031.013 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Число | 2421 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| N2ON2O3 | |
| Молярная масса | 76.011 g·mol −1 |
| Появление | Жидкость темно-синего цвета |
| Плотность |
|
| Температура плавления | −100.7 [2] ° C (-149,3 ° F; 172,5 К) |
| Точка кипения | 3,5 ° C (38,3 ° F; 276,6 К) (диссоциирует [2] ) |
| реагирует с образованием азотистой кислоты | |
| Растворимость | растворим в эфире |
| −16.0·10 −6 см 3 /моль | |
| Структура | |
| плоский, C s | |
| 2,122 Д | |
| Термохимия | |
Теплоемкость ( С ) | 65,3 Дж/(моль·К) |
Стандартный моляр энтропия ( S ⦵ 298 ) | 314,63 Дж/(моль·К) |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | 91,20 кДж/моль |
| Опасности | |
| СГС Маркировка : [3] | |
    | |
| Опасность | |
| Х270 , Х280 , Х310 , Х310+Х330 , Х314 , Х330 | |
| P220 , P244 , P260 , P262 , P264 , P270 , P271 , P280 , P284 , P301+P330+P331 , P302+P350 , P303+P361+P353 , P304+P340 , P305+P351+P338 , П310 , П320 , П321 , P322 , P361 , P363 , P370+P376 , P403 , P403+P233 , P405 , P410+P403 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Родственные соединения | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
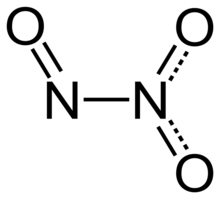
Триоксид азота (также известный как азотистый ангидрид ) представляет собой неорганическое соединение с формулой Н 2 О 3 . Это оксид азота . Он образуется при смешивании равных частей оксида азота и диоксида азота и охлаждении смеси ниже -21 ° C (-6 ° F): [4]
- •
НЕТ + •
НЕТ
2 ⇌ Н
22О
3
Триоксид азота можно выделить только при низких температурах, т.е. в жидкой и твердой фазах . В жидком и твердом состояниях он имеет темно-синий цвет. [2] При более высоких температурах равновесие благоприятствует составляющим газам с K D = 193 кПа (25 °C). [5] [ нужны разъяснения ]
Это соединение иногда называют «триоксид азота», но это название правильно относится к другому соединению, (незаряженному) нитратному радикалу. •NO 3 .
Структура и связь
[ редактировать ]Молекула триоксида азота содержит связь N –N. Одной из многочисленных резонансных структур молекулы триоксида азота является O=N-NO 2 , который можно описать как нитрозогруппу. −N=O, присоединенный к нитрогруппе −NO 2 за счет одинарной связи между двумя атомами азота . Этот изомер считается «ангидридом » нестабильной азотистой кислоты ( HNO 2 ) и образует его при смешивании с водой , хотя для истинного ангидрида азотистой кислоты можно предположить и альтернативную структуру, т.е. О=Н-О-Н=О . Этот изомер можно получить реакцией нитрита тетрабутиламмония и трифликового ангидрида в растворе дихлорметана при -30°С. [6]
Если азотистая кислота не израсходуется быстро, она разлагается на оксид азота и азотную кислоту . Нитритные соли иногда получают добавлением N 2 O 3 к водным растворам оснований :
- N 2 O 3 + 2 NaOH → 2 NaNO 2 + H 2 O
Обычно связи N–N по длине аналогичны связям в гидразине (145 пм ). Однако триоксид азота имеет необычно длинную связь N–N в 186 часов вечера. Некоторые другие оксиды азота также имеют длинные связи N–N, в том числе четырехокись азота (175 пм). N 2 O 3 Молекула плоская и обладает C s симметрией . Размеры, показанные на рисунке ниже, получены в результате спектроскопии низкотемпературных . микроволновой газообразных газов N2O3 O3: [4]
Подобно нитрату нитрония , эта молекула также может сосуществовать в равновесии с ионным газом, называемым нитритом нитрозония ([NO] + [НО2] – ) [7]
Ссылки
[ редактировать ]- ^ «Триоксид азота» .
- ^ Перейти обратно: а б с Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . п. 444. ИСБН 978-0-08-037941-8 .
- ^ «Триоксид азота» . pubchem.ncbi.nlm.nih.gov . Проверено 23 декабря 2021 г.
- ^ Перейти обратно: а б Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Пергамон Пресс . стр. 521–22. ISBN 978-0-08-022057-4 .
- ^ Холлеман, Арнольд Фредерик; Виберг, Эгон (2001), Виберг, Нильс (ред.), Неорганическая химия , перевод Иглсона, Мэри; Брюэр, Уильям, Сан-Диего/Берлин: Academic Press/De Gruyter, ISBN 0-12-352651-5
- ^ Редди, Г. Судхакар; Эх, Элайджа Дж.; Кори, Э.Дж. (17 июня 2022 г.). «Нитрозилтрифлат и азотистый ангидрид, один и тот же способ образования, но очень разные пути реакции. Прямой синтез 1,2-оксазетов, нитрозо- или бисоксазосоединений из олефинов». Органические письма . 24 (23): 4202–4206. doi : 10.1021/acs.orglett.2c01466 . ISSN 1523-7052 . ПМИД 35653176 .
- ^ Захаров, И.И.; Захарова, О.И. (01.04.2009). «Нитрозоний-нитрит-изомер N2O3: Квантово-химические данные» . Журнал структурной химии . 50 (2): 212–218. дои : 10.1007/s10947-009-0031-1 . ISSN 1573-8779 .

