Гипонитрит
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Гипонитрит | |||
| Систематическое название ИЮПАК Диазенебис (олеат) | |||
| Другие имена Гипонитрит (2–) | |||
| Идентификаторы | |||
3D model ( JSmol ) |
| ||
| 3DMeet | |||
| ЧЭБИ | |||
| ХимическийПаук |
| ||
| 130273 | |||
| КЕГГ | |||
ПабХим CID | |||
| Характеристики | |||
| Н 22О 2− 2 | |||
| Молярная масса | 60.012 g·mol −1 | ||
| Конъюгатная кислота | Гипонитистая кислота | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
В химии гипонитрит может относиться к аниону N.
22О 2−
2 ([ГДЕ=НЕТ] 2− ) или к любому ионному соединению , которое его содержит. В органической химии это может также относиться к группе -O-N=NO-O- или любому органическому соединению с общей формулой R. 1 −O-N=N-O-R 2 , где Р 1 и Р 2 являются органическими группами. [1] Такие соединения можно рассматривать как соли и эфиры кислоты азотистой .Кислый гипонитрит – ионное соединение с анионом HN.
22О −
2 ([ХОН=НЕТ] − ).
Гипонитрит-ион
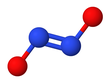
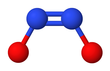
[ редактировать ]Гипонитрит проявляет цис-транс-изомерию . [2]
Транс - форма ( E ) обычно встречается в солях гипонитрита, таких как гипонитрит натрия ( Na
2 Н
22О
2 ) и гипонитрит серебра(I) ( Ag
2 Н
22О
2 ).
Цис транс ( Z )-форму гипонитрита натрия также можно получить, но она более реакционноспособна, чем - форма. [2] Цис - гипонитрит-анион почти плоский и почти симметричный, с длиной около 140 пм для связи N-O и 120 пм для связи N-N и углами O-N-N около 119 °. [3]
Реакции
[ редактировать ]Ионы гипонитрита могут действовать как бидентатный лиганд либо в мостиковом, либо в хелатирующем режиме. имеется мостиковая цис В красной двуядерной форме хлорида нитрозилпентамин-кобальта(III) -гипонитритная группа, [Co(NH 3 ) 5 NO]Cl 2 . [4]
Гипонитрит может восстанавливать элементарный йод до иодистоводородной кислоты : [4]
- Н
22О 2−
2 + 3 я
2 + 3 часа
2 О → НЕТ −
3 + НЕТ −
2 + 6 Привет
Эфиры гипонитрита
[ редактировать ]Органические транс -гипонитриты R 1 −O-N=N-O-R 2 можно получить реакцией транс- гипонитрита серебра(I) Ag
2 Н
22О
2 с различными алкилгалогенидами . Например, реакция с трет -бутилхлоридом дает транс- ди- трет -бутилгипонитрит. [5] [6] [7] [8]
Другие алкильные радикалы, о которых сообщается в литературе, включают этил , [9] и бензил . [10] [11] [12] Эти соединения могут быть источником алкоксильных радикалов . [13]
См. также
[ редактировать ]Другие азота оксианионы включают
- нитрат , НЕТ −
3 - нитрит , НЕТ −
2 - пероксонитрит , (пероксинитрит), ООНО −
- пероксонитрат , HNO −
4 - триокодинитрат , (гипонитрат), [ON=NO 2 ] 2−
- нитроксилат , [O 2 N-NO 2 ] 4−
- ортонитрат , НЕТ 3−
4
Ссылки
[ редактировать ]- ^ Хьюз, Миннесота (1968). «Гипонитриты». Ежеквартальные обзоры, Химическое общество . 22 :1. дои : 10.1039/QR9682200001 .
- ^ Jump up to: а б Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия , Elsevier ISBN 0-12-352651-5
- ^ Фельдманн, Клаус; Янсен, Мартин (1996). «Цис-гипонитрит натрия - новый препаративный путь и анализ кристаллической структуры». Angewandte Chemie International Edition на английском языке . 35 (15): 1728–1730. дои : 10.1002/anie.199617281 .
- ^ Jump up to: а б Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Навамани Арулсами; Д. Скотт Боле; Джером А. Имониджи; Элизабет С. Саган (2000). «Корреляция геометрии E / Z -каркаса продукта и региоселективности O/O и O/N при диалкилировании гипонитрита». Дж. Ам. хим. Соц. 122 (23): 5539–5549. дои : 10.1021/ja994261o .
- ^ Кифер, Хансруди; Трейлор, Т.Г. (1966). «Ди-т-бутилгипонитрит. Удобный источник т-бутокси-радикалов». Буквы тетраэдра . 7 (49): 6163–6168. дои : 10.1016/s0040-4039(00)70159-6 . ISSN 0040-4039 .
- ^ Хуанг, РЛ; Ли, Тонг-Вай; Онг, С.Х. (1969). «Реакции α-метоксибензильного радикала в четыреххлористом углероде и в других растворителях. Четыреххлористый углерод как хлорирующий агент». Дж. Хим. Соц. С (1): 40–44. дои : 10.1039/j39690000040 . ISSN 0022-4952 .
- ^ Нойман, Роберт С.; Басси, Роберт Дж. (1970). «Исследования под высоким давлением. V. Активационные объемы для объединения и диффузии геминированных трет-бутокси-радикалов». Журнал Американского химического общества . 92 (8): 2440–2445. дои : 10.1021/ja00711a039 . ISSN 0002-7863 .
- ^ Партингтон, Джеймс Р.; Шах, Чандулал К. (1932). «384. Гипонитриты. Часть II: соли металлов. Часть III: сложные эфиры». Журнал Химического общества : 2589. doi : 10.1039/jr9320002589 . ISSN 0368-1769 .
- ^ Хо, СК; де Соуза, JB (1961). «347. Алкоксирадикалы. Часть I. Кинетика термического разложения дибензилгипонитрита в растворе». Журнал Химического общества : 1788. doi : 10.1039/jr9610001788 . ISSN 0368-1769 .
- ^ де СОУЗА, JB; ХО, СК (1960). «Диспропорционирование и димеризация бензилоксильного свободного радикала в растворе». Природа . 186 (4727): 776–778. Бибкод : 1960Natur.186..776D . дои : 10.1038/186776a0 . ISSN 0028-0836 . S2CID 4248607 .
- ^ Рэй, Нью-Хэмпшир (1960). «794. Скорость разложения свободнорадикальных катализаторов полимеризации: измерения коротких периодов полураспада термическим методом». Журнал Химического общества : 4023. doi : 10.1039/jr9600004023 . ISSN 0368-1769 .
- ^ Крейг А. Огл; Стивен В. Мартин; Майкл П. Дзиобак; Марек В. Урбан; Дж. Дэвид Менденхолл (1983). «Скорость разложения, синтез и спектральные свойства ряда алкилгипонитритов». Дж. Орг. хим. 48 (21): 3728–3733. дои : 10.1021/jo00169a023 .