оксианион
Оксианион оксоанион , или ион , представляет собой с общей формулой A.
х О с —
y (где A представляет собой химический элемент , а O представляет собой атом кислорода ). Оксианионы образуются подавляющим большинством химических элементов . [1] Формулы простых оксианионов определяются по правилу октетов . Соответствующей оксикислотой оксианиона является соединение H
с А
х О
й . Структуры конденсированных оксианионов можно объяснить с точки зрения AO n полиэдрических единиц с общими углами или ребрами между многогранниками. Оксианионы (в частности, фосфатные и полифосфатные эфиры) аденозинмонофосфат ( АМФ ), аденозиндифосфат ( АДФ ) и аденозинтрифосфат (АТФ) важны в биологии.
Мономерные оксианионы
[ редактировать ]Формула мономерных оксианионов АО м -
n , определяется степенью окисления элемента A и его положением в таблице Менделеева . Максимальное координационное число элементов первого ряда ограничено 4. Однако ни один из элементов первого ряда не имеет мономерного оксианиона с таким координационным числом. Вместо этого карбонат ( CO 2−
3 ) и нитраты ( NO −
3 ) имеют тригональную планарную структуру с π-связью между центральным атомом и атомами кислорода. Этой π-связи способствует сходство размеров центрального атома и кислорода.
Оксианионы элементов второго ряда по степени группового окисления тетраэдрические . Тетраэдрический Единицы SiO 4 встречаются в минералах оливина , (Mg,Fe) 2 SiO 4 , но анион не существует отдельно, так как в твердом состоянии атомы кислорода тетраэдрически окружены катионами. Фосфат ( ПО 3−
4 ), сульфат ( SO 2−
4 ) и перхлорат ( ClO −
4 ) ионы могут быть обнаружены в различных солях. Многие оксианионы элементов в низшей степени окисления подчиняются правилу октетов , и это можно использовать для рационализации принятых формул. Например, хлор(V) имеет два валентных электрона, поэтому он может разместить три пары электронов от связей с ионами оксида. Заряд иона равен +5 − 3 × 2 = −1, поэтому формула имеет вид ClO. −
3 . предсказывает, что ион имеет Теория VSEPR пирамидальную структуру с тремя связывающими электронными парами и одной неподеленной парой. Подобным образом,Оксианион хлора(III) имеет формулу ClO. −
2 , и согнут с двумя неподеленными парами и двумя связующими парами.
| Степень окисления | Имя | Формула | Изображение |
|---|---|---|---|
| +1 | ион Гипохлорит - | ClO − |  |
| +3 | ион Хлорит - | ClO − 2 |  |
| +5 | Хлорат - ион | ClO − 3 |  |
| +7 | ион Перхлорат - | ClO − 4 |  |
В третьем и последующих рядах таблицы Менделеева возможна 6-координация, но изолированные октаэдрические оксианионы неизвестны, поскольку они несут слишком большой электрический заряд. Таким образом, молибден(VI) не образует MoO. 6−
6 , но образует тетраэдрический молибдат -анион MoO. 2−
4 . Агрегаты МоО 6 встречаются в конденсированных молибдатах. Полностью протонированные оксианионы октаэдрической структуры встречаются в таких соединениях, как Sn(OH) 2−
6 и Sb(OH) −
6 . Кроме того, ортопериодат может быть депротонирован лишь частично, [Примечание 1] с
Мы
[ редактировать ]Наименование мономерных оксианионов следует следующим правилам.
Здесь группа галогенов (группа 7 А, 17) обозначается как группа VII, а группа благородных газов (группа 8 А) обозначается как группа VIII.
- Если центральный атом не принадлежит к группе VII или VIII
| Степень окисления центрального атома | Схема именования | Примеры |
|---|---|---|
| = Номер группы | *-ел | Борат ( БО 3− 3 ), Карбонат ( CO 2− 3 ), Нитрат ( НЕТ − 3 ), Фосфат ( ПО 3− 4 ), Сульфат ( SO 2− 4 ), хромат ( CrO 2− 4 ), арсенат ( AsO 3− 4 ), феррат ( FeO 2− 4 ) |
| = Номер группы − 2 | *-ите | Нитрит ( НЕТ − 2 ), фосфит ( PO 3− 3 ), Сульфит ( SO 2− 3 ), Арсенит ( AsO 3− 3 ) |
| = Номер группы − 4 | гипо-*-ит | Гипофосфит ( PO 3− 2 ), гипосульфит ( SO 2− 2 ) |
- Если центральный атом находится в группе VII или VIII
| Степень окисления центрального атома | Схема именования | Примеры |
|---|---|---|
| = Номер группы | за-*-ел | Перхлорат ( ClO − 4 ), пербромат ( BrO − 4 ), Периодат ( IO − 4 ), Перманганат ( MnO − 4 ), перксенат ( XeO 4− 6 ) |
| = Номер группы − 2 | *-ел | Хлорат ( ClO − 3 ), Бромат ( BrO − 3 ), Иодат ( IO − 3 ) |
| = Номер группы − 4 | *-ите | Хлорит ( ClO − 2 ), Бромит ( BrO − 2 ) |
| = Номер группы − 6 | гипо-*-ит | Гипохлорит (ClO − ), Гипобромит (BrO − ) |
Реакции конденсации
[ редактировать ]
В водном растворе оксианионы с высоким зарядом могут подвергаться реакциям конденсации, например, с образованием дихромат- иона. Cr2O2−7 2O2−:
Движущей силой этой реакции является уменьшение плотности электрического заряда аниона и удаление гидроксония ( ЧАС + ) ион. Степень порядка в решении уменьшается, высвобождая определенное количество энтропии , что делает свободную энергию Гиббса более отрицательной и способствует прямой реакции. Это пример кислотно-основной реакции, в которой мономерный оксианион действует как основание, а конденсированный оксианион действует как сопряженная с ним кислота . Обратная реакция — это реакция гидролиза , поскольку молекула воды , действующая как основание, расщепляется. Может происходить дальнейшая конденсация, особенно с анионами с более высоким зарядом, как это происходит с аденозинфосфатами.
 | 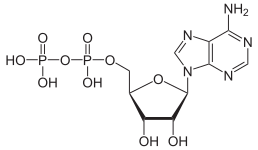 | 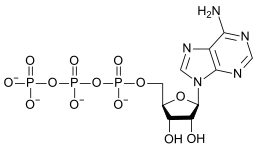 |
| AMP | АДП | СПС |
Превращение АТФ в АДФ представляет собой реакцию гидролиза и является важным источником энергии в биологических системах.
Образование большинства силикатных минералов можно рассматривать как результат реакции деконденсации, в которой кремнезем реагирует с основным оксидом, кислотно-основной реакции в смысле Люкса-Флада .
Структуры и формулы полиоксианионов
[ редактировать ]
Полиоксианион оксианион , представляет собой полимерный в котором несколько мономеров оксианиона, обычно рассматриваемых как MO n многогранники соединяются общими углами или ребрами. [4] Когда два угла многогранника являются общими, результирующая структура может представлять собой цепь или кольцо. Короткие цепи встречаются, например, в полифосфатах . Иносиликаты, такие как пироксены , имеют длинную цепочку SiO 4 тетраэдры, каждый из которых имеет два общих угла. Такая же структура встречается в так называемых метаванадатах, таких как метаванадат аммония , NH4VO3 4VO.
Формула оксианиона SiO 2− 3 получается следующим образом: каждый номинальный ион кремния ( И 4+ ) присоединен к двум номинальным оксид-ионам ( ТО 2− ) и имеет половину доли в двух других. Таким образом, стехиометрия и заряд определяются как:
Кольцо можно рассматривать как цепь, в которой два конца соединены. циклический трифосфат , P 3 O 3- 9 является примером.
Когда три угла являются общими, конструкция расширяется в двух измерениях. У амфиболов (примером которых является асбест ) две цепи связаны друг с другом за счет общего третьего угла в разных местах цепи. В результате получается идеальная формула Si 4 O 6− 11 и линейно-цепочечная структура, объясняющая волокнистую природу этих минералов. Совместное использование всех трех углов может привести к листовой структуре, как у слюды . Si 2 O 2− 5 , в котором каждый кремний имеет один кислород для себя и половину доли в трех других. Кристаллическую слюду можно расколоть на очень тонкие пластинки.
Совместное использование всех четырех углов тетраэдров приводит к трехмерной структуре, например, в кварце . Алюмосиликаты – это минералы, в которых часть кремния заменена алюминием. Однако степень окисления алюминия на единицу меньше, чем у кремния, поэтому замена должна сопровождаться добавлением другого катиона. Число возможных комбинаций такой структуры очень велико, что отчасти и является причиной такого большого количества алюмосиликатов.

Октаэдрический Единицы MO 6 часто встречаются в оксианионах более крупных переходных металлов. Некоторые соединения, например соли цепочечного полимерного иона, Mo 2 O 2− 7 содержит даже как тетраэдрические, так и октаэдрические звенья. [5] [6] Общие края часто встречаются у ионов, содержащих октаэдрические строительные блоки, а октаэдры обычно искажаются, чтобы уменьшить напряжение на мостиковых атомах кислорода. В результате образуются трехмерные структуры, называемые полиоксометаллатами . Типичные примеры встречаются в структуре Кеггина иона фосфомолибдат- . Совместное использование ребер является эффективным средством снижения плотности электрического заряда, как это можно видеть на примере гипотетической реакции конденсации с участием двух октаэдров:
Здесь средний заряд каждого атома М уменьшается на 2. Эффективность разделения ребер демонстрируется следующей реакцией, которая происходит при подкислении щелочного водного раствора молибдата.
Тетраэдрический молибдат-ион превращается в кластер из 7 октаэдров, соединенных ребрами. [6] [7] давая средний заряд на каждый молибден 6 ⁄ 7 . Гептамолибдатный кластер настолько стабилен, что кластеры, содержащие от 2 до 6 молибдатных звеньев, не обнаружены, хотя они должны образовываться как промежуточные соединения.
Эвристика кислотности
[ редактировать ]О pKa родственных кислот можно судить по количеству двойных связей с кислородом. Таким образом, хлорная кислота является очень сильной кислотой, а хлорноватистая кислота - очень слабой. Простое правило обычно работает с точностью до 1 единицы pH.
Кислотно-основные свойства
[ редактировать ]Большинство оксианионов являются слабыми основаниями и могут протонироваться с образованием кислот или кислых солей. Например, фосфат-ион может быть последовательно протонирован с образованием фосфорной кислоты.


Степень протонирования в водном растворе будет зависеть от констант диссоциации кислоты и pH . Например, AMP (аденозинмонофосфат) имеет значение ap 6,21 K . [8] поэтому при pH 7 он будет протонирован примерно на 10%. Нейтрализация заряда является важным фактором в этих реакциях протонирования. Напротив, одновалентные анионы перхлорат- и перманганат- ионы очень трудно протонировать, поэтому соответствующие кислоты являются сильными кислотами .
Хотя кислоты, такие как фосфорная кислота, обозначаются как H 3 PO 4 , протоны присоединяются к атомам кислорода, образуя гидроксильные группы, поэтому формулу также можно записать как OP(OH) 3 для лучшего отражения структуры. Серную кислоту можно записать как О 2 S(ОН) 2 ; это молекула, наблюдаемая в газовой фазе.
Фосфит - ион, PO 3− 3 является сильным основанием и поэтому всегда несет хотя бы один протон. В этом случае протон присоединен непосредственно к атому фосфора структуры ГПО 2- 3 . При образовании этого иона фосфитный ион ведет себя как основание Льюиса и отдает пару электронов кислоте Льюиса. ЧАС + .

Как уже говорилось выше, реакция конденсации также является кислотно-основной реакцией. Во многих системах могут протекать реакции как протонирования, так и конденсации. Случай хромат-иона представляет собой относительно простой пример. На диаграмме преобладания хромата, показанной справа, pCr обозначает отрицательный логарифм концентрации хрома, а pH обозначает отрицательный логарифм концентрации хрома. ЧАС + концентрация ионов. Имеются два независимых равновесия. Константы равновесия определяются следующим образом. [9]
Диаграмма доминирования интерпретируется следующим образом.
- Хромат-ион, CrO 2- 4 является преобладающей разновидностью при высоком pH. По мере повышения pH хромат-ион становится все более преобладающим, пока не станет единственным видом в растворах с pH > 6,75.
- При pH < p K 1 ион хромата водорода, HcrO - 4 преобладает в разбавленном растворе.
- Дихромат-ион, Cr 2 O 2− 7 преобладает в более концентрированных растворах, за исключением высоких значений pH.
Вид H 2 CrO 4 и Hcr 2 O − 7 не показаны, так как они образуются только при очень низких значениях pH.
Диаграммы доминирования могут стать очень сложными, если может образоваться множество полимерных частиц. [10] такие как ванадаты , молибдаты и вольфраматы . Другая сложность заключается в том, что многие из высших полимеров образуются чрезвычайно медленно, так что равновесие не может быть достигнуто даже за несколько месяцев, что приводит к возможным ошибкам в константах равновесия и диаграмме преобладания.
См. также
[ редактировать ]Ссылки и примечания
[ редактировать ]Примечания
[ редактировать ]- ^ высокое значение четвертого p K a делает маловероятным возникновение пятого и шестого депротонирования в водном растворе.
Ссылки
[ редактировать ]- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Эйлетт, основанный А. Ф. Холлеманом; продолжение Эгона Виберга; перевод Мэри Иглсон, Уильяма Брюэра; отредактировано Бернхардом Дж. (2001). Неорганическая химия (1-е изд. на английском языке, [под редакцией] Нильса Виберга. Изд.). Сан-Диего, Калифорния: Берлин: Academic Press, W. de Gruyter. п. 454. ИСБН 0123526515 .
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Бурго, Жан-Луи (30 марта 2012 г.). Ионные равновесия в аналитической химии . Нью-Йорк: Спрингер. п. 358. ИСБН 978-1441983824 .
- ^ Мюллер, У. (1993). Неорганическая структурная химия . Уайли. ISBN 0-471-93717-7 .
- ^ Линдквист, И.; Хассель, О.; Уэбб, М.; Роттенберг, Макс (1950). «Исследование кристаллической структуры безводных молибдатов и вольфраматов натрия» . Акта Хим. Скан . 4 : 1066–1074. doi : 10.3891/acta.chem.scand.04-1066 .
- ^ Перейти обратно: а б Уэллс, А. Ф. (1962). Структурная неорганическая химия (3-е изд.). Оксфорд: Кларендон Пресс. стр. 446
- ^ Линдквист, И. (1950). «Архив химии». Архивы по химии . 2 : 325.
- ^ да Кошта, CP; Сигел, Х. (2000). «Свойства связывания свинца (II) 5'-монофосфатов аденозина (AMP) 2− ), инозин (ИМП 2− ) и гуанозин (GMP 2− ) в водном растворе. Доказательства взаимодействия нуклеинового основания и свинца (II)». Inorg. Chem . 39 (26): 5985–5993. doi : 10.1021/ic0007207 . PMID 11151499 .
- ^ Брито, Ф.; Асканиоа, Дж.; Матеоа, С.; Эрнандеса, К.; Араужоа, Л.; Гили, П.; Мартин-Зарзаб, П.; Домингес, С.; Медерос, А. (1997). «Равновесие видов хромата (VI) в кислой среде и ab initio исследования этих видов». Многогранник . 16 (21): 3835–3846. дои : 10.1016/S0277-5387(97)00128-9 .
- ^ Поуп, Монтана (1983). Гетерополи- и изополиоксометаллаты . Спрингер. ISBN 0-387-11889-6 .
Внешние ссылки
[ редактировать ] СМИ, связанные с оксоанионами, на Викискладе?
СМИ, связанные с оксоанионами, на Викискладе?











![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2-}} ][\mathrm {H^{ +}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/58c28311b8a8a69931b4cfa144888a4d9e4306b1)


![{\displaystyle K_{2}={\frac {[\mathrm {Cr_{2}O_{7}^{2-}} ]}{[\mathrm {HCrO_{4}^{-}} ]^{2 }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)
