хлорат
 | |
 | |
| Имена | |
|---|---|
| Другие имена Хлорат(V) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ |
|
| ХимическийПаук | |
| 1491 | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
| Число | 1461 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ClO 3 − | |
| Молярная масса | 83.4512 |
| Структура | |
| Трехугольная пирамидальная | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | окислитель |
| Родственные соединения | |
Другие анионы | |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Хлорат – это общее название ClO. −
3- анион, атом хлора +5 которого находится в степени окисления . Этот термин также может относиться к химическим соединениям, содержащим этот анион, причем хлораты представляют собой соли хлорной кислоты . Другие оксианионы хлора можно назвать «хлоратами», за которыми следует римская цифра в скобках, обозначающая степень окисления хлора: например, ClO. −
Ион 4 , обычно называемый перхлоратом, также может называться хлоратом (VII).
Как предсказывает теория отталкивания электронных пар валентной оболочки , хлорат-анионы имеют тригональную пирамидальную структуру .
Хлораты являются мощными окислителями , и их следует хранить вдали от органических или легко окисляемых материалов. Смеси хлоратных солей практически с любыми горючими материалами (сахаром, опилками , древесным углем, органическими растворителями , металлами и т. д.) легко сгорают . По этой причине хлораты когда-то широко использовались в пиротехнике , хотя их использование сократилось из-за их нестабильности. В большинстве пиротехнических приложений, в которых раньше использовались хлораты, теперь вместо них используются более стабильные перхлораты .
Структура и связь
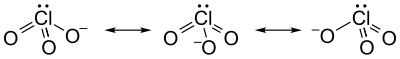
[ редактировать ]Хлорат-ион не может быть удовлетворительно представлен только одной структурой Льюиса , поскольку все связи Cl–O имеют одинаковую длину (1,49 Å в хлорате калия). [1] ), а атом хлора гипервалентен . Вместо этого его часто рассматривают как гибрид нескольких резонансных структур :
Подготовка
[ редактировать ]Лаборатория
[ редактировать ]Хлораты металлов можно получить добавлением хлора к горячим гидроксидам металлов, таким как КОН :
В этой реакции хлор подвергается диспропорционированию , как восстановлению, так и окислению. Хлор, степень окисления 0, образует хлорид Cl. − (степень окисления -1) и хлорат(V) ClO −
3 (степень окисления +5). В результате реакции холодных водных гидроксидов металлов с хлором вместо этого образуются хлорид и гипохлорит (степень окисления +1). [ нужна ссылка ]
Промышленный
[ редактировать ]Промышленный синтез хлората натрия начинается с водного раствора хлорида натрия (рассола), а не с газообразного хлора. Если электролизное оборудование позволяет смешивать хлор и гидроксид натрия , то происходит описанная выше реакция диспропорционирования. Нагрев реагентов до 50–70 °С осуществляется за счет электроэнергии, используемой для электролиза . [ нужна ссылка ]
Естественное явление
[ редактировать ]Исследование 2010 года обнаружило наличие природных месторождений хлората по всему миру, причем относительно высокие концентрации обнаружены в засушливых и гиперзасушливых регионах. [2] Содержание хлората также измерялось в пробах осадков, количество хлората было близким к перхлорату . Предполагается, что хлорат и перхлорат могут иметь общий природный механизм образования и могут быть частью биогеохимического цикла хлора. С микробной точки зрения наличие природного хлората также может объяснить, почему существует множество микроорганизмов, способных восстанавливать хлорат до хлорида. Кроме того, эволюция восстановления хлората может быть древним явлением, поскольку все бактерии, восстанавливающие перхлорат, описанные на сегодняшний день, также используют хлорат в качестве терминального акцептора электронов. [3] Следует четко указать, что в настоящее время минералы с преобладанием хлората не известны. Это означает, что хлорат-анион существует только в виде замещения в известных минеральных видах или – в конечном итоге – присутствует в растворах, заполняющих поры. [4]
В 2011 году исследование Технологического института Джорджии выявило присутствие хлората магния на планете Марс. [5]
Соединения (соли)
[ редактировать ]Примеры хлоратов включают
- хлорат калия , KClO 3
- хлорат натрия , NaClO 3
- хлорат магния , Mg(ClO 3 ) 2
Другие оксианионы
[ редактировать ]Если после слова «хлорат» стоит римская цифра в скобках, это означает, что оксианион содержит хлор в указанной степени окисления, а именно:
| Общее имя | Название акции | Степень окисления | Формула |
|---|---|---|---|
| Гипохлорит | Хлорат(I) | +1 | ClO − |
| Хлорит | Хлорат(III) | +3 | ClO − 2 |
| хлорат | Хлорат(V) | +5 | ClO − 3 |
| Перхлорат | Хлорат(VII) | +7 | ClO − 4 |
Используя это соглашение, «хлорат» означает любой оксианион хлора. Обычно «хлорат» относится только к хлору в степени окисления +5.
Токсичность
[ редактировать ]Хлораты относительно токсичны, хотя при восстановлении они образуют, как правило, безвредные хлориды.
Ссылки
[ редактировать ]- ^ Дж. Дэниэлсен; А. Хэзелл; ФК Ларсен (1981). «Строение хлората калия при 77 и 298 К». Акта Кристаллогр. Б. 37 (4): 913–915. дои : 10.1107/S0567740881004573 .
- ^ Рао, Б.; Хацингер, П.Б.; Бёльке, Дж. К.; Стурчио, Северная Каролина; Андраски, Б.Дж.; Экардт, Флорида; Джексон, В. (2010). «Природный хлорат в окружающей среде: применение нового метода IC-ESI/MS/MS с Cl 18 OО3 − Внутренний стандарт». Environ. Sci. Technol . 44 (22): 8429–8434. Bibcode : 2010EnST...44.8429R . doi : 10.1021/es1024228 . PMID 20968289 .
- ^ Коутс, доктор медицинских наук; Ахенбах, Луизиана (2004). «Микробное восстановление перхлората: ракетный метаболизм». Обзоры природы Микробиология . 2 (июль): 569–580. дои : 10.1038/nrmicro926 . ПМИД 15197392 . S2CID 21600794 .
- ^ "Дом" . Mindat.org .
- ^ «Жидкая ВОДА замечена на склонах Марса» . Время . 28 сентября 2015 г.
Внешние ссылки
[ редактировать ]- . Британская энциклопедия . Том. 6 (11-е изд.). 1911. с. 254.