Органосульфат
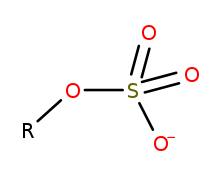
В сероорганической химии органосульфаты представляют собой класс органических соединений, имеющих общую функциональную группу со структурой Р-О-СО - 3 . SO 4 Ядро представляет собой сульфатную группу, а группа R представляет собой любой органический остаток . Все органосульфаты формально представляют собой сложные эфиры, полученные из спиртов и серной кислоты ( H 2 SO 4 ), хотя многие не готовятся таким образом. Многие сложные эфиры сульфатов используются в моющих средствах , а некоторые являются полезными реагентами . Алкилсульфаты состоят из гидрофобной углеводородной цепи, полярной сульфатной группы (содержащей анион) и катиона или амина для нейтрализации сульфатной группы. Примеры включают: лаурилсульфат натрия (также известный как натриевая соль монододецилового эфира серной кислоты) и родственные соли калия и аммония.
Приложения
[ редактировать ]Алкилсульфаты обычно используются в качестве анионного поверхностно-активного вещества в жидком мыле и моющих средствах, используемых для чистки шерсти, в качестве очистителей поверхностей, а также в качестве активных ингредиентов в стиральных порошках, шампунях и кондиционерах. Их также можно найти в продуктах домашнего обихода, таких как зубная паста, антациды, косметика и продукты питания. Обычно они содержатся в потребительских товарах в концентрациях от 3 до 20%. В 2003 году в США использовалось около 118 000 т/год алкилсульфатов. [1]
Синтетические органосульфаты
[ редактировать ]Типичным примером является лаурилсульфат натрия с формулой CH 3 (CH 2 ) 11 OSO 3 Na. В потребительских товарах также распространены сульфатные эфиры этоксилированных жирных спиртов , например, полученные из лаурилового спирта . Примером может служить лауретсульфат натрия , ингредиент некоторых косметических средств . [2]
Алкилсульфат можно производить из спиртов, которые, в свою очередь, получают гидрированием животных или растительных масел и жиров, либо с использованием процесса Циглера , либо посредством оксосинтеза . Если спирт производится из олеохимического сырья или по процессу Циглера, углеводородная цепь спирта будет линейной. При получении с использованием оксо-процесса обычно появляется низкий уровень разветвления с метильной или этильной группой в положении C-2, содержащей четные и нечетные количества алкильных цепей. [3] Эти спирты реагируют с хлорсерной кислотой :
- ClSO 3 H + RCH 2 OH → RCH 2 OSO 3 H + HCl
Альтернативно спирты можно превратить в полусульфатные эфиры с помощью триоксида серы : [4]
- SO 3 + RCH 2 OH → RCH 2 OSO 3 H
Лабораторные маршруты
[ редактировать ]Специализированные органосульфаты можно получить персульфатным окислением фенолов по Эльбсу и по Бойланду-Симсу окислением анилинов .
Диалкилсульфаты
[ редактировать ]
Менее распространенное семейство органосульфатов имеет формулу RO-SO 2 -OR'. Их готовят из серной кислоты и спирта. Основные примеры — диэтилсульфат и диметилсульфат — бесцветные жидкости, используемые в качестве реагентов в органическом синтезе . Эти соединения являются потенциально опасными алкилирующими агентами . Диалкилсульфаты не встречаются в природе. [5]
Природные эфиры сульфатов
[ редактировать ]
В природе существует несколько классов сульфатных эфиров. Особенно распространены производные сахара, такие как кератансульфат , хондроитинсульфат и антикоагулянт гепарин . [6] Посттрансляционные модификации некоторых белков влекут за собой сульфатирование, часто фенольной группы остатков тирозина . [7] Стероидный сульфат – это сульфат эстрадиола , латентный предшественник гормона эстрогена.
Основная часть почвенной серы находится в форме сульфатных эфиров. [8]
Метаболизм
[ редактировать ]Сульфат является инертным анионом, поэтому природа активирует его путем образования сложноэфирного производного аденозин-5'-фосфосульфата (APS) и 3'-фосфоаденозин-5'-фосфосульфата (PAPS). Многие организмы используют эти реакции для метаболических целей или для биосинтеза соединений серы, необходимых для жизни. [9] Образование и гидролиз природных сульфатных эфиров катализируются сульфатазами (также известными как сульфогидролазы). [5]
Безопасность
[ редактировать ]Поскольку они широко используются в коммерческих продуктах, аспекты безопасности органосульфатов тщательно исследуются. [10]
Здоровье человека
[ редактировать ]Алкилсульфаты при приеме внутрь хорошо всасываются и метаболизируются до сульфата C3 , C4 или C5 и дополнительного метаболита. Из алкилсульфатов самым сильным раздражителем является лаурилсульфат натрия, порог раздражения которого составляет 20%. Поверхностно-активные вещества в потребительских товарах обычно смешиваются, что снижает вероятность раздражения. Согласно OECD TG 406, алкилсульфаты в исследованиях на животных не оказались сенсибилизаторами кожи. [10] [11]
алкилсульфатов Лабораторные исследования не обнаружили генотоксичности , мутагенности или канцерогенности . Никаких долгосрочных репродуктивных эффектов обнаружено не было. [12]
Среда
[ редактировать ]Первичной утилизацией алкилсульфата из использованной коммерческой продукции являются сточные воды. Концентрация алкилсульфатов в сточных водах очистных сооружений (ОСВ) измерялась на уровне 10 микрограммов на литр (5,8 × 10 −9 унция/куб. дюйм) и ниже. Алкилсульфаты легко биоразлагаются, начиная, скорее всего, еще до попадания на очистные сооружения. Попадая на очистные сооружения, они быстро удаляются путем биоразложения . Было обнаружено, что беспозвоночные являются наиболее чувствительной трофической группой к алкилсульфатам. Было обнаружено, что лаурилсульфат натрия, протестированный на Uronema parduczi , простейшем, имеет наименьшее значение эффекта: 20 h-EC5 составляет 0,75 миллиграммов на литр (2,7 × 10 −8 фунт/куб. дюйм). Тесты на хроническое воздействие C 12 –C 18 на беспозвоночных Ceriodaphnia dubia показали, что наибольшая токсичность наблюдается у C 14 ( NOEC составлял 0,045 мг/л).
С точки зрения термической стабильности алкилсульфаты хорошо разлагаются до достижения температуры кипения из-за низкого давления паров (для С 8-18 от 10-11 до 10-15 гПа). Сорбция почвы пропорциональна длине углеродной цепи, при этом длина 14 и более имеет наибольшую скорость сорбции. Было обнаружено, что концентрации в почве варьируются от 0,0035 до 0,21 миллиграмма на килограмм (5,6 × 10 −8 до 3,4 × 10 −6 унция/фунт) сухого веса.
Ссылки
[ редактировать ]- ^ ЦВЗ (октябрь 2004 г.). «Поверхностно-активные вещества, бытовые моющие средства и сырье для них» . Отчет CEH о маркетинговом исследовании .
- ^ Эдуард Смолдерс, Вольфганг фон Рыбински, Эрик Сунг, Вильфред Рэзе, Йозеф Стебер, Фредерика Вибель, Анетт Нордског «Средства для стирки» в Энциклопедии промышленной химии Ульмана 2007, Wiley-VCH, Weinheim. два : 10.1002/14356007.a08_315.pub2 .
- ^ Клаус Новек, Вольфганг Графаренд, «Жирные спирты» в Энциклопедии промышленной химии Ульмана, 2006, Wiley-VCH, Вайнхайм. два : 10.1002/14356007.a10_277.pub2
- ^ Хольмберг, Кристер (2019). «Поверхностно-активные вещества». Энциклопедия промышленной химии Ульмана . стр. 1–56. дои : 10.1002/14356007.a25_747.pub2 . ISBN 978-3-527-30673-2 .
- ^ Jump up to: а б Клеланд, В. Уоллес; Хенгге, Алван К. (2006). «Ферментативные механизмы переноса фосфатов и сульфатов». Химические обзоры . 106 (8): 3252–3278. дои : 10.1021/cr050287o . ПМИД 16895327 .
- ^ Дж. В. Фицджеральд (1976). «Образование и гидролиз эфиров сульфатов: потенциально важный, но часто игнорируемый аспект цикла серы в аэробных почвах» . Бактериологические обзоры . 40 (3): 698–721. дои : 10.1128/бр.40.3.698-721.1976 . ПМК 413977 . ПМИД 791238 .
- ^ Мур, Кевин Л. (2003). «Биология и энзимология о-сульфатирования тирозина белка» . Журнал биологической химии . 278 (27): 24243–24246. дои : 10.1074/jbc.R300008200 . ПМИД 12730193 .
- ^ Шерер, HW (2001). «Сера в растениеводстве — приглашенный доклад». Европейский журнал агрономии . 14 (2): 81–111. дои : 10.1016/S1161-0301(00)00082-4 .
- ^ М. Т. Мэдиган, Дж. М. Мартинко, Дж. Паркер «Биология микроорганизмов Брока», Прентис Холл, 1997. ISBN 0-13-520875-0 .
- ^ Jump up to: а б Консорциум SDA/Алкилсульфат (2007). «Профиль начальной оценки СВДС. SIAM 25: алкилсульфаты, алкансульфонаты и альфа-олефинсульфонаты» (PDF) . ОЭСР МОСТРАГ . Хельсинки. Архивировано из оригинала (PDF) 3 марта 2016 г. Проверено 14 октября 2011 г.
- ^ DE/ICCA (2009). «Профиль первоначальной оценки СВДС SIAM 25: алкилсульфаты, алкансульфонаты и альфа-олефинсульфонаты» . ОЭСР .
- ^ Виббертманн, А; Мангельсдорф, И.; Гамон, К.; Седлак, Р. (2011). «Токсикологические свойства и оценка риска категории анионных поверхностно-активных веществ: алкилсульфатов, первичных алкансульфонатов и сульфоната α-олефина». Экотоксикология и экологическая безопасность . 74 (5): 1089–1106. дои : 10.1016/j.ecoenv.2011.02.007 . ПМИД 21463896 .