Фосфат хрома(III)
 | |
| Имена | |
|---|---|
| Название ИЮПАК Фосфат хрома(III) | |
| Другие имена Фосфат хрома, Монофосфат хрома, Ортофосфат хрома, Фосфат хрома | |
| Идентификаторы | |
| |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.219 |
| Номер ЕС |
|
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| КрПО 4 | |
| Молярная масса | 146.97 g/mol |
| Плотность | 4,236 г/см 3 [1] |
| Температура плавления | 1907 ° C (3465 ° F; 2180 К) [1] |
| Точка кипения | 2671 ° C (4840 ° F; 2944 К) |
| нерастворимый экзотермический синий раствор [1] | |
| Структура | |
| моноклинический [1] | |
| Опасности | |
| NIOSH (пределы воздействия на здоровье в США): | |
МЕХ (Допускается) | СВВ 1 мг/м 3 [2] |
РЕЛ (рекомендуется) | СВВ 0,5 мг/м 3 [2] |
IDLH (Непосредственная опасность) | 250 мг/м 3 [2] |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Фосфат хрома (III) описывает неорганические соединения с химической формулой CrPO 4 ·(H 2 O) n , где n = 0, 4 или 6. Все они представляют собой насыщенно окрашенные твердые вещества. Безводный CrPO 4 имеет зеленый цвет. Шестиводный CrPO 4 ·6H 2 O — фиолетовый.
Синтез
[ редактировать ]Фосфат хрома получают обработкой фосфорнокислого раствора оксида хрома (VI гидразином ) . [1]
Гексагидрат фосфата хрома(III)
[ редактировать ]гексагидрат фосфата хрома, CrPO 4 ·6H 2 O , получают восстановлением триоксида хрома, CrO 3 , с этанолом в присутствии ортофосфорной кислоты, H 3 PO 4 , при температуре от −24°С до +80°С. [3]
Мезопористая фаза
[ редактировать ]Гелеобразный фосфат хрома(III) получают восстановлением дихромата аммония. (NH 4 ) 2 Cr 2 O 7 , используя этанол, CH 3 COOH и азотная кислота, ХНО 3 . Этот процесс осуществляется в присутствии дигидрофосфата аммония и мочевины при повышенной температуре, где бромид тетрадецилтриметиламмония (TTBr) используется в качестве структурообразующего агента. [4]
Фильмы
[ редактировать ]Приготовление текстурированного фосфата хрома осуществляют путем смешивания эквимолярных растворов водной нитрата хрома и диаммонийфосфата в чашке, помещенной в герметичную камеру с низкотемпературным паром аммиака-катализатора, диффундирующим в раствор с постоянной скоростью. Через 24 часа образующаяся фиолетовая пленка вырастает из жидкости в результате гидролиза и поликонденсации, происходящих в реакционной среде на границе воздух/жидкость и пленка/жидкость. Поверхностное натяжение делает пленку компактной, что позволяет легко вставлять предметное стекло микроскопа и поднимать пленку из-под поверхности раствора. После получения раствор промывают деионизированной водой и этанолом, затем сушат в вакууме. [5]
Аморфная фаза
[ редактировать ]Приготовление безводного фосфата хрома(III) начинают с измельчения смеси 75 мол% оксида хрома(III), Cr 2 O 3 и 25 мол% чистого гидрофосфата аммония, (NH 4 ) 2 HPO 4 . Эту смесь прессуют в гранулы и нагревают под давлением воздуха при температуре 400°С в течение 24 часов для удаления аммиака и воды. После этого происходит последовательность нагрева 450 °С (24 часа), 700 °С (3⋅24 часа), 800 °С (24 часа) и 850 °С (2⋅24 часа). После этого смесь гранул постепенно охлаждают. [6]
Физические свойства
[ редактировать ]Кристаллическая структура
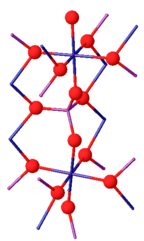
[ редактировать ]Фосфат хрома(III) может существовать в виде двух изоморфов . Его β-изоформа ромбическая с пространственной группой Cmcm (a = 0,5165, b = 0,7750, c = 0,6131 нм). Структура состоит из бесконечных цепочек транс-разделенных ребер. Октаэдры CrO 6 , идущие параллельно оси c, соединены между собой РО 4 тетраэдры. При температуре выше 1175 °C β-CrPO 4 превращается в α-CrPO 4 . α-CrPO 4 также является ромбическим, с пространственной группой Имма (a = 1,0380, b = 1,2845, c = 0,6278 нм). Структура состоит из бесконечной сети связанных многогранников с октаэдром CrO 6 и тетраэдром PO 4, имеющими общее ребро. Кр 3+ узел образует пары Cr(2)/Cr(2') с общими ребрами и разделяет два угла с четырьмя октаэдрами Cr(1). [7]
Магнитные свойства
[ редактировать ]Магнитные свойства β-CrPO 4 обусловлены расстояниями катион-катион вдоль октаэдрических цепочек, которые приводят к сильным прямообменным взаимодействиям и даже связи металл-металл. Нейтронографические исследования показывают, что спиральные моменты в β-CrPO 4 коллинеарны и антиферромагнитно связаны вдоль цепочек в плоскостях 001 при низкой температуре (5К, µeff = 2,55 µB). [7] Наблюдения дифракционного исследования показали, что при низкой температуре (2К) α-CrPO 4 октаэдры Единицы CrO 6 образуют бесконечную трехмерную сеть, которая, как ожидается, обеспечит сильные магнитные суперобменные связи Cr-O-Cr с путем обмена через фосфатную группу. Эти связи придают структуре антиферромагнитные характеристики (Ɵ = -35,1 К, µeff = 3,50 µB), что приводит к антипараллельным магнитным спинам в плоскости, перпендикулярной цепочкам октаэдра CrO 6 . [8]
Химические свойства
[ редактировать ]Ионный обмен
[ редактировать ]При высокой температуре и pH в диапазоне 283-383K и pH 4-7 соответственно уравновешенный раствор KOH/HCl нерастворим. Твердый CrPO 4 и водный раствор катиона дают реакцию сорбции. Исследования показывают, что CrPO 4 катализирует адсорбцию двухвалентных катионов на свою аморфную поверхность по механизму катионного обмена. Механизм предполагает, что H + ионы высвобождаются из твердой фазы в водную фазу, когда катионы гидролизуются и адсорбируются на поверхности катализатора. Таким образом, снижение pH реакции используется как прямой показатель скорости адсорбции в реакции:
График уравнения Курбатова используется для связи выделения H + иона к константе равновесия реакции:
где Kd (l г-1) представляет собой коэффициент распределения, а n представляет собой наклон прямой линии, указывающей на H + /М г+ стехиометрия реакции обмена. В аналогичных условиях селективность CrPO 4 для дативных катионов имеет следующую последовательность: Pb 2+ > С 2+ > Нет 2+ ≅ Кд 2+ . Повышение температуры и pH усиливает реакцию ионного обмена. [9]
Фосфат хрома (III) также используется для катализа катионного обмена в реакциях сорбции. Этот катализ широко используется для снижения токсичности металлов во время очистки окружающей среды. Это было применено для снижения концентрации свинца в водной среде обитания и питьевой воде. [9]
Приложение
[ редактировать ]Антикоррозийное покрытие
[ редактировать ]Краски, содержащие фосфат хрома (III), используются в качестве антикоррозионного покрытия металлов. Краски состоят из водного кислого раствора фосфата хрома (III), который превращается в однородную пленку при нанесении на металлы, широко используемые в производстве и быту, такие как цинк, сплавы цинка, алюминий и подложки из алюминиевых сплавов. Методы нанесения включают гальванопокрытие, погружение или распыление раствора на поверхность подложки. [10]
Катализатор
[ редактировать ]Фосфат хрома (III) находит разнообразное применение в полимерной промышленности. Комбинированный фосфат алюминия хрома (III) широко используется в качестве катализатора при алкилировании ароматических углеводородов спиртами, например, при метилировании толуола метанолом. Спирт дегидратируется в эфир, а алкилзамещенный продукт можно использовать в качестве промежуточного продукта при производстве синтетических волокон, таких как полиэтилентерефталат. [11]
Полимер
[ редактировать ]Предварительная обработка фосфат-силикатом хрома (III) также используется в качестве ламинированной структуры для гашения вибрации и шума в двигателе. [12]
Токсичность
[ редактировать ]Хотя фосфат хрома(III) с трудом растворим в воде, чрезмерное воздействие этого соединения из окружающей среды, промышленных помещений и истирания металла о металлические имплантаты может иметь вредные последствия. Токсичность фосфата хрома (III) зависит от продолжительности воздействия, концентрации фосфата хрома (III), путей проникновения через мембранный барьер и высвобождения ионов трехвалентного хрома из фосфата хрома (III). Клетки-макрофаги в организме, подвергшиеся воздействию фосфата хрома (III), поглощают или фагоцитируют это соединение в его эндосомальную и лизосомальную среду, которая является кислой. Это катализирует протеолитическую реакцию, приводящую к дозозависимому увеличению высвобождения ионов хрома (III) в пораженных клетках. Кр 3+ Ионы оказывают токсическое воздействие на белки цитозоля и митохондрий, окислительно изменяя их химические свойства, лишая возможности выполнять свои функции. Поражаются белки с высоким сродством к металлам, такие как енолаза, ферменты каталазы и гемоглобин, молекулярные переносчики ферритина. В конечном итоге это может привести к нефротоксичности, токсичности для репродуктивной системы и развития вследствие повреждения тканей, некроза и воспаления. [13]
Дальнейшее чтение
[ редактировать ]- Мустафа, С.; Муртаза, С.; Наим, А.; Фарина, К. (2010). «Ионообменная сорбция ионов Pb2+ на CrPO4». Экологические технологии . 26 (4): 353–359. дои : 10.1080/09593332608618544 . ПМИД 15906486 . S2CID 30688737 .
См. также
[ редактировать ]- Хром(III)
- Хром(IV)
- Фосфат алюминия
- Хромовая кислота
- Хромовые квасцы
- Хроматное конверсионное покрытие
Внешние ссылки
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Брауэр, Георг (1965) [1962]. неорганической химии Справочник по препаративной (на немецком языке). Том 2. Штутгарт; Нью-Йорк, Нью-Йорк: Фердинанд Энке Верлаг; Academic Press, Inc. с. 1341. ИСБН 978-0-32316129-9 . Проверено 10 января 2014 г.
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0141» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Вазович, Душанка Д.; Стоякович, Джордже Р. (1989). «Получение и свойства некоторых аморфных фосфатов хрома (III)». Журнал некристаллических твердых тел . 109 (1). Эльзевир Б.В.: 129–132. Бибкод : 1989JNCS..109..129В . дои : 10.1016/0022-3093(89)90451-1 . ISSN 0022-3093 .
- ^ Тарафдар, А.; Бисвас, Сусанта; Праманик, Северная Каролина; Праманик, П. (2006). «Синтез мезопористого фосфата хрома нетрадиционным золь-гель способом». Микропористые и мезопористые материалы . 89 (1–3). Эльзевир Б.В.: 204–208. дои : 10.1016/j.micromeso.2005.10.027 . ISSN 1387-1811 .
- ^ Гомм, Джон Р.; Швенцер, Биргит; Морс, Дэниел Э. (2007). «Текстурированные пленки фосфата хрома, синтезированные методом низкотемпературного пародиффузионного катализа». Науки о твердом теле . 9 (5). Эльзевир Б.В.: 429–431. Бибкод : 2007SSSci...9..429G . doi : 10.1016/j.solidstatesciences.2007.03.012 . ISSN 1293-2558 .
- ^ Босака, М.; Якубус, П.; Рыховска-Химмель, И. (2007). «Получение фосфатов хрома(III)(V) в твердом состоянии и их термическая стабильность». Журнал термического анализа и калориметрии . 88 (1): 133–137. дои : 10.1007/s10973-006-8050-z . ISSN 1388-6150 . S2CID 98435405 .
- ^ Jump up to: а б Аттфилд, Дж. Пол; Баттл, Питер Д.; Читам, Энтони К.; Джонсон, Дэвид К. (1989). «Магнитные структуры и свойства фосфата альфа-хрома и арсената альфа-хрома». Неорганическая химия . 28 (7). Американское химическое общество (ACS): 1207–1213. дои : 10.1021/ic00306a004 . ISSN 0020-1669 .
- ^ Аттфилд, Дж. Пол; Баттл, Питер Д.; Читам, Энтони К. (1985). «Спиральная магнитная структура ортофосфата β-хрома (III) (β-CrPO4)». Журнал химии твердого тела . 57 (3). Эльзевир Б.В.: 357–361. Бибкод : 1985ЖССЧ..57..357А . дои : 10.1016/0022-4596(85)90199-9 . ISSN 0022-4596 .
- ^ Jump up to: а б Мустафа, С.; Муртаза, С.; Наим, А.; Фарина, К. (2010). «Ионообменная сорбция Pb 2+ Ионы на CrPO 4 ". Экологические технологии . 26 (4): 353–359. : 10.1080 /09593332608618544 . PMID 15906486. . S2CID 30688737 doi
- ^ Патент США 20070243397 , Людвиг Р. и Рекер А., «Не содержащие хрома (VI) водные кислые конверсионные растворы хрома (III), опубликован в 2007 г., передан Columbia Chemical Corporation, Огайо.
- ^ Патент США 4543436 , Джонсон, М.М. и Новак, GP, «Фосфат хрома как катализатор алкилирования», опубликован 24 сентября 1985 г.
- ^ Патент США 20090252989 , Суонсон Р. и Хуфнагель А. «Ламинированная вязкоупругая демпфирующая структура и метод ее изготовления», опубликован 8 октября 2009 г.
- ^ Шарф, Б.; Клемент, CC; Золла, В.; Перино, Г.; Ян, Б.; Эльчи, СГ; Пердью, Э.; Голдринг, С.; Макалузо, Ф.; Кобелли, Н; Вачет, RW; Сантамброджо, Л. (2015). «Молекулярный анализ токсичности, связанной с хромом и кобальтом» . Научные отчеты . 2014 : 5729. doi : 10.1038/srep05729 . ПМК 4103093 . ПМИД 25034144 .