Гидроний
| |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК оксоний | |||
| Другие имена ион гидроксония | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| 141 | |||
ПабХим CID | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| H3H3O + | |||
| Молярная масса | 19.023 g·mol −1 | ||
| Кислотность ( pKa ) | 0 | ||
| Сопряженная база | Вода | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
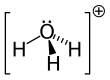
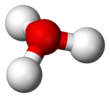
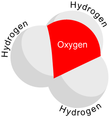
В химии гидроксоний . ( гидроксониум в традиционном британском английском ) является катионом [ Н3О ] + , также записанный как H3H3O + , тип иона оксония, при протонировании воды образующегося . Его часто рассматривают как положительный ион, присутствующий при кислоты Аррениуса растворении в воде, поскольку молекулы кислоты Аррениуса в растворе отдают протон (положительный водорода , ион ЧАС + ) к окружающим молекулам воды ( Н 2 О ). Фактически, кислоты должны быть окружены более чем одной молекулой воды, чтобы ионизироваться, образуя водную среду. ЧАС + и сопряженное основание. Три основные структуры водного протона получили экспериментальное подтверждение: собственный катион, который представляет собой тетрагидрат H 3 O. + (H 2 O) 3 , катион Цунделя, который представляет собой симметричный дигидрат, H + (H 2 O) 2 , и катион Стоянова, расширенный катион Цунделя, который представляет собой гексагидрат: H + (Н 2 О) 2 (Н 2 О) 4 . [1] [2] Спектроскопические данные четко определенных ИК-спектров в подавляющем большинстве подтверждают, что катион Стоянова является преобладающей формой. [3] [4] [5] [6] [ нужен неосновной источник ] По этой причине было предложено везде, где это возможно, использовать символ H. + (водный раствор) следует использовать вместо иона гидроксония. [2]
Связь с pH
[ редактировать ]Молярная концентрация гидроксония или ЧАС + раствора ионы определяют pH в соответствии с
- pH = -log([ H3H3O + ]/М)
где М = моль/л. Концентрация гидроксид раствора -ионов аналогичным образом определяет pH . Молекулы в чистой воде самодиссоциируют на водные протоны и гидроксид-ионы в следующем равновесии:
- Н 2 О ⇌ ОН − (вод) + Н + (вода)
В чистой воде содержится равное количество гидроксида и ЧАС + ионы, поэтому это нейтральный раствор. При 25 °C (77 °F) чистая вода имеет pH 7 и pH 7 (это значение меняется при изменении температуры: см. Самоионизация воды ). Значение pH менее 7 указывает на кислый раствор, а значение pH более 7 указывает на щелочной раствор. [7]
Номенклатура
[ редактировать ]Согласно номенклатуре органической химии ИЮПАК , ион гидроксония следует называть оксонием . [8] Гидроксоний также можно однозначно использовать для его идентификации. [ нужна ссылка ]
Ион оксония – это любой катион, содержащий трехвалентный атом кислорода.
Структура
[ редактировать ]С ТО + и N имеют одинаковое количество электронов, H3H3O + изоэлектронен аммиаку . Как показано на изображениях выше, H3H3O + имеет тригональную пирамидальную молекулярную геометрию с атомом кислорода на вершине. H-O-H Валентный угол составляет примерно 113 °, [9] [10] и центр масс очень близок к атому кислорода. Поскольку основание пирамиды состоит из трех одинаковых атомов водорода, H3H3O + конфигурация молекулы Симметричная верхняя такова, что она принадлежит C 3v Группа точек . Из-за этой симметрии и того факта, что он обладает дипольным моментом, вращательные правила отбора таковы: Δ J = ±1 и Δ K = 0. Переходный диполь расположен вдоль оси c и, поскольку отрицательный заряд локализован вблизи кислорода атома, дипольный момент направлен к вершине, перпендикулярной базовой плоскости. [ нужна ссылка ]
Кислоты и кислотность
[ редактировать ]Гидратированный протон очень кислый: при 25°С его рКа равно примерно 0 . [11] Значения, обычно приводимые для p K a ак ( H3O + ) равны 0 или –1,74. Первый использует соглашение, согласно которому активность растворителя в разбавленном растворе (в данном случае воды) равна 1, а второй использует значение концентрации воды в чистой жидкости, равное 55,5 М. Сильверстайн показал, что второй значение термодинамически неприемлемо. [12] Разногласия возникают из-за двусмысленности определения p K a H 3 O + в воде H 2 O должен действовать одновременно как растворенное вещество и растворитель. ИЮПАК не дал официального определения p K a, которое разрешило бы эту двусмысленность. Бургот утверждал, что H 3 O + (водный) + H 2 O (ж) ⇄ H 2 O (водный) + H 3 O + (aq) просто не является термодинамически четко определенным процессом. Для оценки p K a ак ( H3O + ), Бурго предлагает принять измеренное значение p K a этанол ( H3O + ) = 0,3, p K a H 3 O + в этаноле и применяя корреляционное уравнение p K a ак = п К а этанол – 1,0 (± 0,3) для перевода этанола p K a в водное значение, чтобы получить значение p K a ак ( H3O + ) = –0.7 (± 0.3). [13] С другой стороны, Сильверстайн показал, что экспериментальные результаты Баллинджера и Лонга [14] поддерживают ap K a 0,0 для водного протона. [15] Нилс и Шертель приводят дополнительные аргументы в пользу ap K a, равного 0,0. [16]
Водный протон является наиболее кислым видом, который может существовать в воде (при условии, что воды достаточно для растворения): любая более сильная кислота ионизируется и дает гидратированный протон. Кислотность ЧАС + (aq) — неявный стандарт, используемый для оценки силы кислоты в воде: сильные кислоты должны быть лучшими донорами протонов, чем ЧАС + (водн.), так как в противном случае значительная часть кислоты будет существовать в неионизированном состоянии (т.е. в виде слабой кислоты). В отличие от ЧАС + (водный) в нейтральных растворах, образующихся в результате автодиссоциации воды, в кислых растворах, ЧАС + (водный раствор) обладает длительным действием и имеет концентрацию, пропорциональную силе растворенной кислоты. [ нужна ссылка ]
Первоначально предполагалось, что pH является мерой концентрации ионов водорода в водном растворе. [17] Практически все такие свободные протоны быстро гидратируются; Таким образом, кислотность водного раствора более точно характеризуется концентрацией в нем ЧАС + (акв). В органических синтезах, таких как реакции, катализируемые кислотами, ион гидроксония ( H3H3O + ) используется взаимозаменяемо с ЧАС + ион; выбор одного вместо другого не оказывает существенного влияния на механизм реакции. [ нужна ссылка ]
сольватация
[ редактировать ]Исследователям еще предстоит полностью охарактеризовать сольватацию иона гидроксония в воде, отчасти потому, что существует множество различных значений сольватации. Исследование снижения температуры замерзания показало, что среднее количество гидратных ионов в холодной воде составляет примерно H3H3O + (Н 2 О) 6 : [18] в среднем каждый ион гидроксония сольватируется 6 молекулами воды, которые не способны сольватировать другие молекулы растворенного вещества. [ нужна ссылка ]
Некоторые гидратные структуры имеют довольно большие размеры: H3H3O + (H 2 O) 20 Структура магического числа ионов (называемая магическим числом из-за его повышенной стабильности по отношению к гидратным структурам, включающим сопоставимое количество молекул воды – это аналогичное использование термина «магическое число», как и в ядерной физике ) может гидроний внутри додекаэдрической клетки. [19] Однако более позднее моделирование молекулярной динамики методом ab initio показало, что в среднем гидратированный протон находится на поверхности H3H3O + (H 2 O) 20 кластер. [20] Кроме того, некоторые несопоставимые особенности этих симуляций согласуются с их экспериментальными аналогами, что предполагает альтернативную интерпретацию экспериментальных результатов. [ нужна ссылка ]

Двумя другими хорошо известными структурами являются катион Цунделя и катион Собственного . Собственная сольватная структура имеет ион гидроксония в центре Комплекс H 9 O + 4 , в котором гидроксоний прочно связан водородными связями с тремя соседними молекулами воды. [21] В Зунделе В комплексе H 5 O + 2 протон принадлежит поровну двум молекулам воды в симметричной водородной связи . [22] Недавняя работа показывает, что оба этих комплекса представляют собой идеальные структуры с более общим дефектом сети водородных связей. [23]
Выделение мономера иона гидроксония в жидкой фазе осуществляли в неводном растворе суперкислоты с низкой нуклеофильностью ( ВЧ − СбФ 5 СО 2 ). Ион характеризовался высоким разрешением. 17 О ядерный магнитный резонанс . [24]
Расчет энтальпий и свободных энергий различных водородных связей вокруг катиона гидроксония в жидкой протонированной воде, проведенный в 2007 году. [25] при комнатной температуре и исследование механизма прыжка протона с помощью молекулярной динамики показало, что водородные связи вокруг иона гидроксония (образованного тремя водными лигандами в первой сольватной оболочке гидроксония) довольно прочны по сравнению с таковыми в объемной воде. [ нужна ссылка ]
Новая модель была предложена Стояновым на основе инфракрасной спектроскопии , в которой протон существует как Н 13 О + 6 ион. Таким образом, положительный заряд делокализован по 6 молекулам воды. [26]
Твердые соли гидроксония
[ редактировать ]Для многих сильных кислот возможно образование кристаллов гидроксониевой соли, которые относительно стабильны. Эти соли иногда называют моногидратами кислот . Как правило, любая кислота с константой ионизации 10 9 или выше могут это сделать. Кислоты, константы ионизации которых ниже 10 9 как правило, не может сформировать стабильную H3H3O + соли. Например, азотная кислота имеет константу ионизации 10. 1.4 , а смеси с водой во всех соотношениях являются жидкими при комнатной температуре. Однако хлорная кислота имеет константу ионизации 10. 10 , а если жидкую безводную хлорную кислоту и воду объединить в молярном соотношении 1:1, они реагируют с образованием твердого перхлората гидроксония ( H3H3O + ·ClO - 4 ). [ нужна ссылка ]
Ион гидроксония также образует стабильные соединения с карборановой суперкислотой. H(CB 11 H(CH 3 ) 5 Br 6 ) . [27] Рентгеновская кристаллография показывает C 3v Симметрия для иона гидроксония, где каждый протон взаимодействует с атомом брома каждого из трех карборановых анионов, 320 пм находящихся в среднем на расстоянии друг от друга. Соль [H 3 O] [H(CB 11 HCl 11 )] также растворима в бензоле . В кристаллах, выращенных из раствора бензола, растворитель сокристаллизуется и Катион H 3 O·(C 6 H 6 ) 3 полностью отделяется от аниона. В катионе три молекулы бензола окружают гидроксоний, образуя пи-катионные взаимодействия с атомами водорода. Ближайшее (несвязывающее) сближение аниона хлора с катионом кислорода составляет 348 пм.
Известно также много примеров солей, содержащих гидратированные ионы гидроксония, таких как H 5 O + 2 ион в HCl·2H 2 O , Н 7 О + 3 и H 9 O + 4 встречаются в Ионы HBr·4H 2 O . [28]
серная кислота образует гидроксониевую соль. Известно также, что H3H3O + HSO − 4 при температуре ниже 8,49 ° C (47,28 ° F). [29]
Межзвездный H 3 O +
[ редактировать ]Гидроний — это распространенный молекулярный ион в межзвездной среде, который встречается в диффузных средах. [30] и плотный [31] молекулярные облака, а также плазменные хвосты комет. [32] Межзвездные источники наблюдений гидрония включают области Стрельца B2, Ориона OMC-1, Ориона BN–IRc2, Ориона KL и кометы Хейла–Боппа.
Межзвездный гидроксоний образуется в результате цепочки реакций, начинающихся с ионизации H 2 в H + 2 космическим излучением. [33] H3H3O + может произвести либо ОЙ − или H 2 O за счет реакций диссоциативной рекомбинации , которые протекают очень быстро даже при низких (≥10 К) температурах плотных облаков. [34] Это приводит к тому, что гидроний играет очень важную роль в межзвездной ионно-нейтральной химии. [ нужна ссылка ]
Астрономы особенно заинтересованы в определении содержания воды в различных межзвездных климатах из-за ее ключевой роли в охлаждении плотных молекулярных газов посредством радиационных процессов. [35] Однако, У H 2 O не так много благоприятных переходов для наземных наблюдений. [36] Хотя наблюдения HDO ( дейтерированная версия воды [37] ) потенциально может быть использован для оценки Содержание H 2 O , соотношение HDO к H 2 O известен не очень точно. [36]
С другой стороны, гидроний имеет несколько переходов, которые делают его лучшим кандидатом для обнаружения и идентификации в различных ситуациях. [36] Эта информация использовалась в сочетании с лабораторными измерениями коэффициентов ветвления различных H3H3O + реакции диссоциативной рекомбинации [34] предоставить то, что считается относительно точным ОЙ − и Обилие H 2 O без необходимости прямого наблюдения за этими видами. [38] [39]
Межзвездная химия
[ редактировать ]Как упоминалось ранее, H3H3O + встречается как в диффузных, так и в плотных молекулярных облаках. Применяя константы скорости реакции ( α , β и γ ), соответствующие всем доступным в настоящее время охарактеризованным реакциям с участием H3H3O + , можно вычислить k ( T ) для каждой из этих реакций. Умножив эти k ( T ) на относительное содержание продуктов, можно получить относительные скорости (в см 3 /s) для каждой реакции при данной температуре. Эти относительные ставки можно получить в абсолютных показателях, умножив их на [Ч 2 ] 2 . [40] Если предположить, что T = 10 K для плотного облака и T = 50 K для диффузного облака, результаты показывают, что наиболее доминирующие механизмы образования и разрушения были одинаковыми для обоих случаев. Следует отметить, что относительные содержания, используемые в этих расчетах, соответствуют TMC-1, плотному молекулярному облаку, и поэтому ожидается, что рассчитанные относительные скорости будут более точными при T = 10 K. Три самых быстрых механизма формирования и разрушения перечислены в таблице ниже, а также их относительная скорость. Обратите внимание, что скорости этих шести реакций таковы, что составляют примерно 99% химических взаимодействий ионов гидроксония в этих условиях. [32] Все три механизма разрушения, представленные в таблице ниже, классифицируются как диссоциативной рекомбинации . реакции [41]

| Реакция | Тип | Относительная скорость (см 3 /с) | |
|---|---|---|---|
| и 10 К | и 50 К | ||
| Н 2 + Н 2 О + → H3O + + Ч | Формирование | 2.97 × 10 −22 | 2.97 × 10 −22 |
| Н 2 О + НСО + → СО + Н 3 О + | Формирование | 4.52 × 10 −23 | 4.52 × 10 −23 |
| Н + 3 + Н 2 О → Н 3 О + + Ч 2 | Формирование | 3.75 × 10 −23 | 3.75 × 10 −23 |
| H3H3O + + и − → ОН + Ч + Ч | Разрушение | 2.27 × 10 −22 | 1.02 × 10 −22 |
| H3H3O + + и − → Н 2 О + Н | Разрушение | 9.52 × 10 −23 | 4.26 × 10 −23 |
| H3H3O + + и − → ОН + Н 2 | Разрушение | 5.31 × 10 −23 | 2.37 × 10 −23 |
Также стоит отметить, что относительные скорости реакций образования в таблице выше одинаковы для данной реакции при обеих температурах. Это связано с тем, что константы скорости этих реакций имеют константы β и γ, равные 0, что приводит к k = α , который не зависит от температуры. [ нужна ссылка ]
Поскольку все три эти реакции производят либо H 2 O или OH, эти результаты усиливают сильную связь между их относительным содержанием и содержанием H3H3O + . Скорости этих шести реакций таковы, что они составляют примерно 99% химических взаимодействий ионов гидроксония в этих условиях. [ нужна ссылка ]
Астрономические открытия
[ редактировать ]Еще в 1973 году, до первого межзвездного обнаружения, химические модели межзвездной среды (первая из которых соответствовала плотному облаку) предсказывали, что гидроний является распространенным молекулярным ионом и играет важную роль в ионно-нейтральной химии. [42] Однако до начала астрономических поисков оставался вопрос определения спектроскопических особенностей гидроксония в газовой фазе, которые на тот момент были неизвестны. Первые исследования этих характеристик были проведены в 1977 г. [43] за которым последовали другие эксперименты по спектроскопии более высокого разрешения. После того, как в лаборатории было идентифицировано несколько линий, произошло первое межзвездное обнаружение H 3 O. + был сделан двумя группами почти одновременно в 1986 году. [31] [36] В первом, опубликованном в июне 1986 года, сообщалось о наблюдении J. вт
К = 1 −
1 − 2 +
1 переход на частоте 307 192,41 МГц в OMC-1 и Sgr B2. Во втором, опубликованном в августе, сообщалось о наблюдении того же перехода к туманности Орион-KL. [ нужна ссылка ]
За этими первыми обнаружениями последовали наблюдения ряда дополнительных H3H3O + переходы. Первые наблюдения каждого последующего обнаружения перехода приведены ниже в хронологическом порядке:
В 1991 году 3 +
2 − 2 −
2 Переход на частоте 364 797 , 427 МГц наблюдался у OMC-1 и Sgr B2. [44] Год спустя 3 +
0 − 2 −
0 на частоте 396 272 , 412 МГц наблюдался в нескольких регионах, самым четким из которых было облако W3 IRS 5. [39]
Первый дальний ИК 4 −
3 − 3 +
Переход 3 на длине волны 69,524 мкм (4,3121 ТГц) был осуществлен в 1996 г. вблизи Ориона BN-IRc2. [45] В 2001 году произошло еще три перехода H3H3O + in наблюдались в дальнем инфракрасном диапазоне у Sgr B2; 2 −
1 − 1 +
1 переход на 100,577 мкм (2,98073 ТГц), 1 −
1 − 1 +
1 на 181,054 мкм (1,65582 ТГц) и 2 −
0 − 1 +
0 при 100,869 мкм (2,9721 ТГц). [46]
См. также
[ редактировать ]- Гидрон (катион водорода)
- Гидрид
- Анион водорода
- Ион водорода
- Механизм Гротгуса
- Трифтороксоний
- Закон разбавления
Ссылки
[ редактировать ]- ^ Рид, Калифорния (2013). «Мифы о протоне. Природа Н+ в конденсированных средах» . Акк. хим. Рез . 46 (11): 2567–2575. дои : 10.1021/ar400064q . ПМЦ 3833890 . ПМИД 23875729 .
- ^ Jump up to: Перейти обратно: а б Сильверстайн, Тодд П. (2014). «Водный протон гидратируется более чем одной молекулой воды: является ли ион гидроксония полезным тщеславием?». Дж. Хим. Образование . 91 (4): 608–610. Бибкод : 2014JChEd..91..608S . дои : 10.1021/ed400559t .
- ^ Тамер, М.; ДеМарко, Л.; Рамеша, К.; Мандель, А.; Токмаков, А. (2015). «Сверхбыстрая 2D ИК-спектроскопия избыточного протона в жидкой воде» . Наука . 350 (6256): 78–82. Бибкод : 2015Sci...350...78T . дои : 10.1126/science.aab3908 . ПМИД 26430117 . S2CID 27074374 .
- ^ Дейли-младший, Калифорния; Стрикер, LM; Сан, Ю.; Паттенод, СР; Хасанали, А.А.; Петерсен, П.Б.; и др. (2017). «Разложение экспериментальных спектров комбинационного рассеяния света и ИК-спектров кислой воды на вклады протонов, специальных пар и противоионов». Дж. Физ. хим. Летт . 8 (21): 5246–5252. doi : 10.1021/acs.jpclett.7b02435 . ПМИД 28976760 .
- ^ Дамс, Ф.; Фингерхут, БП; Нибберинг, ET; Пайнс, Э.; Эльзессер, Т. (2017). «Переносное движение гидратированных избыточных протонов с большой амплитудой, картированное с помощью сверхбыстрой двумерной ИК-спектроскопии» . Наука . 357 (6350): 491–495. Бибкод : 2017Sci...357..491D . дои : 10.1126/science.aan5144 . ПМИД 28705988 . S2CID 40492001 .
- ^ Фурнье, Ж.А.; Карпентер, ВБ; Льюис, Нью-Хэмпшир; Токмаков, А. (2018). «Широкополосная 2D ИК-спектроскопия выявляет доминирующие асимметричные структуры гидратации протонов H5O2+ в кислых растворах». Природная химия . 10 (9): 932–937. Бибкод : 2018НатЧ..10..932Ф . дои : 10.1038/s41557-018-0091-y . ОСТИ 1480907 . ПМИД 30061612 . S2CID 51882732 .
- ^ «РН и вода» . Геологическая служба США . Проверено 9 ноября 2021 г.
- ^ «Таблица 17. Мононуклеарные родительские ониевые ионы» . ИЮПАК.
- ^ Тан, Цзянь; Ока, Такеши (1999). «Инфракрасная спектроскопия H 3 O + : фундаментальная полоса v 1 ». Журнал молекулярной спектроскопии . 196 (1): 120–130. Bibcode : 1999JMoSp.196..120T . doi : 10.1006/jmsp.1999.7844 . PMID 10361062 .
- ^ Белл, Р.П. (1973). Протон в химии (2-е изд.). Итака: Издательство Корнельского университета. п. 15.
- ^ Мейстер, Эрих; Виллеке, Мартин; Ага, Вернер; Тони, Антонио; Вальде, Питер (2014). «Запутанные количественные описания кислотно-основного равновесия Брёнстеда-Лоури в учебниках по химии - критический обзор и разъяснения для преподавателей-химиков». Хелв. Хим. Акта . 97 (1): 1–31. дои : 10.1002/hlca.201300321 .
- ^ Сильверстайн, ТП; Хеллер, ST (2017). «Значения pKa в учебной программе бакалавриата: какова настоящая pKa воды?». Дж. Хим. Образование . 94 (6): 690–695. Бибкод : 2017ЖЧЭд..94..690С . doi : 10.1021/acs.jchemed.6b00623 .
- ^ Бурго, Жан-Луи (1998). «ПерспективаНовая точка зрения на значение и значения Ka○(H 3 O + , H 2 O) и Kb○(H 2 O, OH − ) пары в воде» . Аналитик . 123 (2): 409–410. Бибкод : 1998Ана...123..409Б . doi : 10.1039/a705491b .
- ^ Баллинджер, П.; Лонг, Ф.А. (1960). «Кислотные константы ионизации спиртов. II. Кислотность некоторых замещенных метанолов и родственных соединений». Дж. Ам. хим. Соц . 82 (4): 795–798. дои : 10.1021/ja01489a008 .
- ^ Сильверстайн, Т.П. (2014). «Водный протон гидратируется более чем одной молекулой воды: является ли ион гидроксония полезным тщеславием?». Дж. Хим. Образование . 91 (4): 608–610. Бибкод : 2014JChEd..91..608S . дои : 10.1021/ed400559t .
- ^ «Что такое рКа Воды» . Калифорнийский университет в Дэвисе . 09.08.2015.
- ^ Соренсен, SPL (1909). «Об измерении и значении концентрации ионов водорода в ферментативных процессах». Биохимический журнал (на немецком языке). 21 :131-304.
- ^ Завицас, А.А. (2001). «Свойства водных растворов электролитов и неэлектролитов». Журнал физической химии Б. 105 (32): 7805–7815. дои : 10.1021/jp011053l .
- ^ Хульте, Г.; Стенхаген, Г.; Веннерстрем, О.; Оттоссон, Ч. (1997). «Кластер воды, изученный методом масс-спектрометрии электрораспылением». Журнал хроматографии А. 512 : 155–165. дои : 10.1016/S0021-9673(97)00486-X .
- ^ Айенгар, СС; Петерсен, МК; Бернэм, CJ; День, TJF; Вот, Джорджия; Вот, Джорджия (2005). «Свойства кластеров ион-вода. I. Протонированный кластер 21-вода» (PDF) . Журнал химической физики . 123 (8):084309. Бибкод : 2005JЧФ.123х4309И . дои : 10.1063/1.2007628 . ПМИД 16164293 .
- ^ Зундель, Г.; Мецгер, Х. (1968). «Энергетические зоны туннелирования избыточных протонов в жидких кислотах. ИК-спектроскопическое исследование природы группировок H502+». Журнал физической химии . 58 (5_6): 225–245. дои : 10.1524/зпч.1968.58.5_6.225 . S2CID 101048854 .
- ^ Вике, Э.; Эйген, М.; Акерманн, Т. (1954). «О состоянии протона (иона гидроксония) в водном растворе». Журнал физической химии . 1 (5_6): 340–364. дои : 10.1524/зпч.1954.1.5_6.340 .
- ^ Маркс, Д.; Такерман, Мэн; Хаттер, Дж.; Парринелло, М. (1999). «Природа гидратированного избыточного протона в воде». Природа . 397 (6720): 601–604. Бибкод : 1999Natur.397..601M . дои : 10.1038/17579 . S2CID 204991299 .
- ^ Матееску, Грузия; Бенедикт, генеральный директор (1979). «Вода и родственные системы. 1. Ион гидроксония (H 3 O + ). Получение и характеристика с помощью ядерного магнитного резонанса кислорода-17 с высоким разрешением». Журнал Американского химического общества . 101 (14): 3959–3960. doi : 10.1021/ja00508a040 .
- ^ Маркович, О.; Агмон, Н. (2007). «Структура и энергетика гидратных оболочек гидроксония» (PDF) . Журнал физической химии А. 111 (12): 2253–6. Бибкод : 2007JPCA..111.2253M . CiteSeerX 10.1.1.76.9448 . дои : 10.1021/jp068960g . ПМИД 17388314 . Архивировано из оригинала (PDF) 31 августа 2018 г. Проверено 30 августа 2018 г.
- ^ Стоянов Евгений С.; Стоянова Ирина В.; Рид, Кристофер А. (15 января 2010 г.). «Структура иона водорода ( H +
aq ) в воде» . Журнал Американского химического общества . 132 (5): 1484–1485. : 10.1021 /ja9101826 . PMC 2946644. . PMID 20078058 doi - ^ Стоянов Евгений С.; Ким, Ки-Чан; Рид, Кристофер А. (2006). «Природа H 3 O + Ион гидроксония в растворителях бензола и хлорированных углеводородов. Условия существования и реинтерпретация инфракрасных данных» . Журнал Американского химического общества . 128 (6): 1948–58. : 10.1021 /ja0551335 . PMID 16464096. . S2CID 33834275 doi
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ И. Теслер и И. Олавссон (1968). «Исследование водородных связей. XXI. Кристаллическая структура моногидрата серной кислоты». Акта Кристаллогр. Б24, 299-304. https://doi.org/10.1107/S056774086800227X
- ^ Фор, А.; Теннисон, Дж. (2003). «Коэффициенты скорости электронно-ударного вращательного возбуждения H 3 + и Н 3 О + « . Ежемесячные уведомления Королевского астрономического общества . 340 (2): 468–472. Bibcode : 2003MNRAS.340..468F . doi : 10.1046/j.1365-8711.2003.06306.x .
- ^ Jump up to: Перейти обратно: а б Холлис, Дж. М.; Черчвелл, Э.Б.; Хербст, Э.; Де Люсия, ФК (1986). «Межзвездная линия, совпадающая с переходом P(2,l) гидроксония (H 3 O + )". Nature . 322 (6079): 524–526. Bibcode : 1986Natur.322..524H . doi : 10.1038/322524a0 . S2CID 4346975 .
- ^ Jump up to: Перейти обратно: а б Рауэр, Х (1997). «Ионный состав и взаимодействие солнечного ветра: наблюдения кометы C/1995 O1 (Хейла-Боппа)». Земля, Луна и планеты . 79 : 161–178. Бибкод : 1997EM&P...79..161R . дои : 10.1023/А:1006285300913 . S2CID 119953549 .
- ^ Вейби-Кристенсен, Л.; Андерсен, Л.Х.; Хибер, О.; Келла, Д.; Педерсен, Х.Б.; Шмидт, ХТ; Зайфман, Д. (1997). «Полные коэффициенты разветвления диссоциативной рекомбинации H 2 O + , H3O + , и СН 3 + " . Астрофизический журнал . 483 (1): 531–540. Бибкод : 1997ApJ...483..531V . doi : 10.1086/304242 .
- ^ Jump up to: Перейти обратно: а б Неу, А.; Аль Халили, А.; Розен, С.; Ле Паделлек, А.; Деркач А.М.; Ши, В.; Викор, Л.; Ларссон, М.; Семаньяк, Дж.; Томас, Р.; Ногард, МБ; Андерссон, К.; Данаред, Х.; Угглас, М. (2000). «Диссоциативная рекомбинация D 3 O + и Н 3 О + : Абсолютные сечения и коэффициенты ветвления». Журнал химической физики . 113 (5): 1762. Бибкод : 2000JChPh.113.1762N . doi : 10.1063/1.481979 .
- ^ Нойфельд, Д.А.; Лепп, С.; Мельник, Дж.Дж. (1995). «Тепловой баланс в плотных молекулярных облаках: скорость радиационного охлаждения и светимость эмиссионных линий». Серия дополнений к астрофизическому журналу . 100 : 132. Бибкод : 1995ApJS..100..132N . дои : 10.1086/192211 .
- ^ Jump up to: Перейти обратно: а б с д Вуттен, А.; Буланже, Ф.; Боги, М.; Комбс, Ф.; Энкреназ, П.Дж.; Герин, М.; Зюрис, Л. (1986). «Поиски межзвездной H 3 O + ". Астрономия и астрофизика . 166 : L15–8. Бибкод : 1986A&A...166L..15W . PMID 11542067 .
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Тяжелая вода ». дои : 10.1351/goldbook.H02758
- ^ Хербст, Э.; Грин, С.; Таддеус, П.; Клемперер, В. (1977). «Косвенное наблюдение ненаблюдаемых межзвездных молекул». Астрофизический журнал . 215 : 503–510. Бибкод : 1977ApJ...215..503H . дои : 10.1086/155381 . hdl : 2060/19770013020 . S2CID 121202097 .
- ^ Jump up to: Перейти обратно: а б Филлипс, Т.Г.; Ван Дишок, EF; Кин, Дж. (1992). «Интерстеллар H 3 O + и его связь с содержанием O 2 и H 2 O» (PDF) . The Astrophysical Journal . 399 : 533. Bibcode : 1992ApJ...399..533P . doi : 10.1086/171945 . hdl : 1887/2260 .
- ^ "Н 3 О + Реакции образования» . База данных UMIST по астрохимии .
- ^ «Диссоциативная рекомбинация | физика» . Британская энциклопедия . Проверено 30 сентября 2021 г.
- ^ Хербст, Э.; Клемперер, В. (1973). «Образование и истощение молекул в плотных межзвездных облаках» . Астрофизический журнал . 185 : 505. Бибкод : 1973ApJ...185..505H . дои : 10.1086/152436 .
- ^ Шварц, ХА (1977). «Инфракрасные спектры газовой фазы ионов гидрата оксония от 2 до 5 мкм». Журнал химической физики . 67 (12): 5525. Бибкод : 1977ЖЧФ..67.5525С . дои : 10.1063/1.434748 .
- ^ Вуттен, А.; Тернер, Британская Колумбия; Мангум, Дж. Г.; Боги, М.; Буланже, Ф.; Комбс, Ф.; Энкреназ, П.Дж.; Герин, М. (1991). «Обнаружение межзвездной H 3 O + – Подтверждающая строка». The Astrophysical Journal . 380 : L79. Bibcode : 1991ApJ...380L..79W . doi : 10.1086/186178 .
- ^ Тиммерманн, Р.; Никола, Т.; Поглич, А.; Гейс, Н.; Стейси, Дж.Дж.; Таунс, Швейцария (1996). «Возможное открытие 70 мкм {H 3 O + } 4 −
3 − 3 +
3 переход в Орионе BN-IRc2" . The Astrophysical Journal . 463 (2): L109. Bibcode : 1996ApJ...463L.109T . doi : 10.1086/310055 . - ^ Гойкоэчеа, младший; Черничаро, Дж. (2001). «Дальнее инфракрасное обнаружение H 3 O + в Стрельце B2" . The Astrophysical Journal . 554 (2): L213. Bibcode : 2001ApJ...554L.213G . doi : 10.1086/321712 . hdl : 10261/192309 .