Масс-спектральная интерпретация
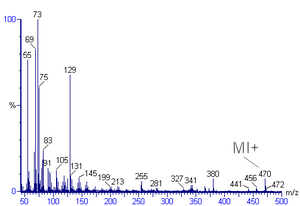
Масс-спектральная интерпретация — это метод, используемый для идентификации химической формулы, характерных структур фрагментов и возможных фрагментных ионов из масс-спектров. [1] [2] Масс-спектры представляют собой график зависимости относительного содержания от отношения массы к заряду. Его обычно используют для идентификации органических соединений методом с электронной ионизацией масс-спектрометрии . [3] [4] Химики-органики получают масс-спектры химических соединений в рамках выяснения структуры, и этот анализ является частью многих учебных программ по органической химии .
Генерация масс-спектров
[ редактировать ]
Электронная ионизация (ЭИ) — это тип источника ионов масс-спектрометра , в котором пучок электронов взаимодействует с молекулой газовой фазы M с образованием иона согласно
с молекулярным ионом . [5] Верхний индекс «+» указывает на заряд иона, а верхний индекс «•» указывает на неспаренный электрон ион -радикала . Энергия электронного луча обычно составляет 70 электронвольт , а процесс ионизации обычно приводит к обширной фрагментации химических связей молекулы.
Из-за высокого вакуумного давления в ионизационной камере длина свободного пробега молекул изменяется от 10 см до 1 км, и тогда фрагментация представляет собой мономолекулярный процесс. После начала фрагментации электрон сначала возбуждается из участка с наименьшей энергией ионизации. Поскольку порядок энергии электронов следующий: несвязывающие электроны > электроны пи-связи > электроны сигма-связи, порядок предпочтения ионизации следующий: несвязывающие электроны > электроны пи-связи > электроны сигма-связи. [6]

Пик масс-спектра с наибольшей интенсивностью называется базовым пиком. Пик, соответствующий молекулярному иону, часто, но не всегда, является основным пиком. Идентификация молекулярного иона может быть затруднена. При исследовании органических соединений относительная интенсивность пика молекулярного иона уменьшается по мере разветвления и увеличения массы в гомологическом ряду. Например, в спектре толуола пик молекулярного иона расположен при 92 m/z, что соответствует его молекулярной массе . Пикам молекулярных ионов также часто предшествуют пики М-1 или М-2, возникающие в результате потери водородного радикала или диводорода соответственно. Здесь М относится к молекулярной массе соединения. В спектре толуола теряется водородный радикал (пара протон-электрон), образуя пик М-1 (91).
Пики с массой меньше молекулярного иона являются результатом фрагментации молекулы. Существует множество путей реакции фрагментации, но в масс-спектре будут проявляться только вновь образованные катионы, а не радикальные или нейтральные фрагменты. Метастабильные пики представляют собой широкие пики низкой интенсивности при нецелых значениях массы. Эти пики возникают из-за ионов, время жизни которых меньше времени, необходимого для прохождения расстояния между ионизационной камерой и детектором.
Определение молекулярной формулы
[ редактировать ]Правило азота
[ редактировать ]Правило азота гласит, что органические молекулы, содержащие водород , углерод , азот , кислород , кремний , фосфор , серу или галогены , имеют нечетную номинальную массу , если они имеют нечетное число атомов азота, или четную массу, если они имеют четное число. атомов азота присутствуют. [7] [8] Правило азота справедливо для структур, в которых все атомы в молекуле имеют количество ковалентных связей, равное их стандартной валентности, при этом каждая сигма-связь и пи-связь считаются отдельной ковалентной связью.
Кольца правят
[ редактировать ]Исходя из принципов степени ненасыщенности, молекулы, содержащие только углерод, водород, галогены, азот и кислород, подчиняются формуле
где C — количество атомов углерода, H — количество атомов водорода, X — количество галогенов, а N — количество азота.
Даже электронное правило
[ редактировать ]Правило четных электронов гласит, что ионы с четным числом электронов (катионы, но не ион-радикалы) имеют тенденцию образовывать ионы-фрагменты с четными электронами, а ионы с нечетными электронами (ион-радикалы) образуют ионы с нечетными электронами или ионы с четными электронами. [9] Виды с четными электронами имеют тенденцию фрагментироваться на другой катион с четными электронами и нейтральную молекулу, а не на два вида с нечетными электронами.
Правила Стивенсона
[ редактировать ]Чем стабильнее образующийся катион, тем более обильным является соответствующий процесс разложения. Для предсказания процесса фрагментации можно использовать несколько теорий, таких как правило электронных октетов, резонансная стабилизация и гиперсопряжение и так далее. [6]
Правило 13
[ редактировать ]Правило 13 — это простая процедура для составления таблицы возможных химических формул для заданной молекулярной массы. [10] Первый шаг в применении этого правила — предположить, что в молекуле присутствуют только углерод и водород и что молекула состоит из некоторого количества «единиц» CH, каждая из которых имеет номинальную массу 13. Если молекулярная масса молекулы в вопрос M , количество возможных единиц CH равно n и
где r — остаток. Основная формула молекулы:
а степень ненасыщенности
Отрицательное значение u указывает на наличие гетероатомов в молекуле, а полуцелое значение u указывает на наличие нечетного числа атомов азота. При добавлении гетероатомов молекулярная формула корректируется эквивалентной массой углерода и водорода. Например, добавление N требует удаления CH 2 , а добавление O требует удаления CH 4 .
Изотопные эффекты
[ редактировать ]Пики изотопов в спектре могут помочь в выяснении структуры. Соединения, содержащие галогены (особенно хлор и бром ), могут давать очень отчетливые изотопные пики. Масс-спектр метилбромида имеет два заметных пика одинаковой интенсивности при m/z 94 (М) и 96 (М+2), а затем еще два при 79 и 81, принадлежащие бромному фрагменту.
Даже если соединения содержат только элементы с менее интенсивными изотопными пиками ( углерод или кислород ), распределение этих пиков можно использовать для определения спектра нужного соединения. Например, два соединения с одинаковой массой 150 Да, C 8 H 12 N 3 + и С 9 Н 10 О 2 + , будет иметь две разные интенсивности M+2, что позволяет различать их.
Фрагментация
[ редактировать ]Характер фрагментации спектров помимо определения молярной массы неизвестного соединения также пригоден для получения структурной информации, особенно в сочетании с расчетом степени ненасыщенности по молекулярной формуле (если таковая имеется). Часто теряются нейтральные фрагменты: окись углерода , этилен , вода , аммиак и сероводород . Существует несколько процессов фрагментации.
α - расщепление
[ редактировать ]Фрагментация возникает в результате процессов гомолиза . Это расщепление является результатом тенденции неспаренного электрона из радикального участка образовать пару с электроном из другой связи с атомом, соседним с заряженным участком, как показано ниже. [7] Эта реакция определяется как гомолитическое расщепление, поскольку переносится только один электрон. Движущей силой такой реакции является электронодонорная способность радикальных центров: N > S, O,π > Cl, Br > H. [11] Примером может служить разрыв связей углерод-углерод рядом с гетероатомом . На этом изображении одноэлектронные движения обозначены однонаправленной стрелкой .

Расщепление сигма-связи
[ редактировать ]Ионизация алканов ослабляет связь CC, что в конечном итоге приводит к разложению. [7] Когда связь разрывается, образуются заряженные, четные электроны (R+) и нейтральные радикалы (R•). Высокозамещенные карбокатионы более стабильны, чем незамещенные. Пример изображен ниже.

Индуктивное расщепление
[ редактировать ]Эта реакция является результатом индуктивного воздействия радикальных центров, как показано ниже. Эта реакция определяется как гетеролитическое расщепление, поскольку переносится пара электронов. [11] Движущей силой такой реакции является электроотрицательность радикальных центров: галогены > O, S >> N, C. Эта реакция менее предпочтительна, чем реакции радикальных центров. [11]

Перегруппировка Маклафферти
[ редактировать ]может Перегруппировка Маклафферти происходить в молекуле, содержащей кетогруппу, и включает β-расщепление с приобретением γ-атома водорода. [12] [13] [14] Образование ионно-нейтрального комплекса включает гомолиз или гетеролиз связей, при котором фрагменты не имеют достаточной кинетической энергии для разделения и вместо этого вступают в реакцию друг с другом, как ионно-молекулярная реакция.
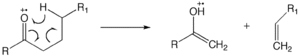
Перегруппировка водорода в насыщенный гетероатом
[ редактировать ]Водородный сдвиг «1,5» приводит к переносу одного γ-водорода в радикальный центр насыщенного гетероатома. Те же требования, которые предъявляются к перегруппировке Маклафферти, применимы и к перегруппировке водорода в насыщенный гетероатом. Такая перегруппировка инициирует реакцию в месте заряда, в результате которой образуется ион с нечетным электроном и небольшая нейтральная молекула (вода, кислота и т. д.). В случае спиртов в результате гетеролитического расщепления высвобождается молекула воды. Поскольку реакции места заряда доминируют в менее объемистых спиртах, эта реакция предпочтительна для спиртов как первичных > вторичных > третичных. [11]
Двойная водородная перегруппировка
[ редактировать ]Водородный сдвиг «1,5» приводит к переносу двух γ-водородов в два радикальных центра на двух разных ненасыщенных атомах. Те же требования, которые предъявляются к перегруппировке Маклафферти, применимы и к двойной водородной перегруппировке. Эта реакция наблюдается для трех ненасыщенных функциональных групп, а именно тиоэфиров, сложных эфиров и амидов. [15]
Ортоперестановка
[ редактировать ]Водородный сдвиг «1,5» приводит к переносу двух γ-водородов в два радикальных центра на двух разных ненасыщенных атомах. Те же требования к водородному сдвигу «1,5» предъявляются и между собственными заместителями в орто-положениях ароматических колец. Те же требования к перегруппировке Маклафферти применимы и к орто-перегруппировке, за исключением прочной двойной связи α,β углерод-углерод. Такая перегруппировка инициирует реакцию в месте заряда, в результате которой образуется ион с нечетным электроном и небольшая нейтральная молекула (вода, HCl и т. д.). Эту реакцию можно использовать для дифференциации орто- и мета-изомеров от пара- и мета-изомеров. Перегруппировка Маклафферти применяется к двойной водородной перегруппировке. Эта реакция наблюдается для трех ненасыщенных функциональных групп, а именно тиоэфиров, сложных эфиров и амидов. [11]

Ретро-реакция Дильса-Альдера
[ редактировать ]Эта реакция протекает преимущественно с циклогексеном и его производными. При ионизации пи-электроны возбуждаются и генерируют зарядовый участок и радикальный участок. После этого два последовательных α-расщепления дают бутадиеновый радикал и нейтральный этен, поскольку этен имеет более высокую энергию ионизации, чем бутадиен (правила Стивенсона). [11]

Реакция циклоэлиминирования
[ редактировать ]Эта реакция протекает преимущественно в четырехчленных циклических молекулах. После ионизации он производит дистонический ион, а затем фрагментируется с образованием иона-радикала этена и нейтральной молекулы этена. [11]
Шаблоны фрагментации конкретных составных классов
[ редактировать ]Алканы
[ редактировать ]Для линейных алканов часто наблюдаются пики молекулярных ионов. Однако для соединений с длинной цепью интенсивность пиков молекулярных ионов часто бывает слабой. Линейные фрагменты часто различаются на 14 Да (СН 2 = 14). Например, закономерности фрагментации гексана. Бутильный катион m/z=57 является основным пиком, а другие наиболее распространенные пики в спектре представляют собой алкилкарбокатионы с m/z=15, 29, 43 Да. [6] [2] [11]

Разветвленные алканы имеют в спектрах несколько более слабые пики молекулярных ионов. Они имеют тенденцию фрагментироваться в месте разветвления. Для 2,3-диметилбутана пик изопропил-катиона (m/z=43) очень сильный. [6] [2] [11]

Циклоалканы имеют относительно интенсивные пики молекулярных ионов (две связи должны разорваться). Пики фрагментации алкенов часто являются наиболее значимой модой. Потеря «CH 2 CH 2 » (= 28) является обычным явлением, если она присутствует. Однако в случае замещенных циклоалканов они предпочитают образовывать циклоалкильные катионы путем расщепления в точках разветвления. [11]

Алкены
[ редактировать ]Алкены часто дают более сильные пики молекулярных ионов, чем алканы, из-за более низкой энергии ионизации пи-электрона, чем σ-электрона. После ионизации двойные связи могут легко мигрировать, что делает определение изомеров практически невозможным. Аллильное расщепление является наиболее значимым способом фрагментации из-за резонансной стабилизации. [11]

Возможны перегруппировки типа Маклафферти (аналогично карбонильным пи-связям). Опять же, миграция облигаций возможна. [11]

Циклогексены часто подвергаются ретро-реакциям Дильса-Альдера.
Алкины
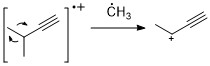
[ редактировать ]Подобно алкенам, алкины часто демонстрируют сильный пик молекулярных ионов. Пропаргильное расщепление является наиболее значимым способом фрагментации. [11]
Ароматические углеводороды
[ редактировать ]Ароматические углеводороды демонстрируют отчетливый пик молекулярных ионов. Бензильное расщепление довольно распространено. Когда к кольцу присоединяются алкильные группы, благоприятным способом расщепления является потеря H-радикала с образованием катиона тропилия (m/z 91). [2] [11]
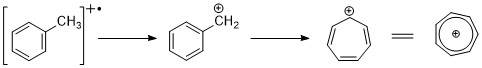
Алкилзамещенные бензолы могут фрагментироваться посредством кинетически контролируемого процесса с образованием C 6 H 5 + , С 6 Ч 6 + ионы. [11]

Другим распространенным способом фрагментации является перегруппировка Маклафферти, которая требует, чтобы длина алкильной цепи была как минимум длиннее трех атомов углерода. [11]

Спирты
[ редактировать ]Спирты обычно имеют слабые пики молекулярных ионов из-за сильной электроотрицательности кислорода. «Альфа»-расщепление является обычным явлением из-за резонансной стабилизации. Самая большая алкильная группа будет потеряна. [2]

Другим распространенным способом фрагментации является обезвоживание (М-18). Для спиртов с более длинной цепью перегруппировка типа Маклафферти может привести к образованию воды и этилена (М-46).
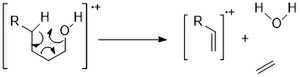
Циклические спирты имеют тенденцию показывать более сильные пики M+, чем линейные цепи. И они следуют схожим путям фрагментации: альфа-расщепление и обезвоживание. [11]
Фенол
[ редактировать ]Фенол демонстрирует сильный пик молекулярных ионов. Наблюдается потеря H· (M – 1), часто наблюдается CO (M – 28) и формильный радикал (HCO·, M – 29). [2] [11]

Эфир
[ редактировать ]Эфиры дают несколько более интенсивные пики молекулярных ионов по сравнению с соответствующими спиртами или алканами. Существует два распространенных режима расщепления. α-расщепление и разрыв связи CO.

Ароматические эфиры могут генерировать ион C6H5O+ за счет потери алкильной группы, а не H; это может привести к выбросу CO, как при фенольном разложении. [11]

Карбонильные соединения
[ редактировать ]Существует пять типов карбонильных соединений, включая альдегиды, кетоны, карбоновые кислоты и сложные эфиры. [2] Основные режимы фрагментации описываются следующим образом:
Альфа-расщепление может происходить по обе стороны от карбонильной функциональной группы, поскольку неподеленная пара кислорода может стабилизировать положительный заряд.

β-расщепление является характерным способом фрагментации карбонильных соединений вследствие резонансной стабилизации.
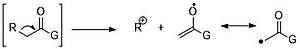
Для карбонильных соединений с более длинной цепью (число атомов углерода больше 4) преобладают перегруппировки Маклафферти.

В соответствии с этими закономерностями фрагментации характеристические пики карбонильных соединений сведены в следующую таблицу.
| Фрагментация | Путь | m/z наблюдаемого иона | ||||
|---|---|---|---|---|---|---|
| Альдегиды Г = Ч | Кетоны Г= СН3 | Эфиры Г=И 3 | Кислоты Г = ОН | Амиды Г = NH2 | ||
| Альфа-расщепление | Потеря радикала R | 29 | 43 | 59 | 45 | 44 |
| Альфа-расщепление | Потеря радикала G | М-1 | М-15 | М-59 | М-45 | М-44 |
| Бета-расщепление | М-43 | М-57 | М-73 | М-59 | М-58 | |
| Перегруппировка Маклафферти | 44 | 58 | 74 | 60 | 59 | |
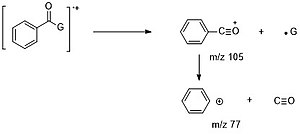
Для ароматических карбонильных соединений альфа-расщепление выгодно, прежде всего, для потери G· (M – 1,15, 29…) с образованием иона C6H5CO+ (m/z=105), который в дальнейшем может терять CO (m/z= 77). и ГХЦГ (m/z=51). [6]
Амины
[ редактировать ]Амины подчиняются правилу азота. Нечетное соотношение массы и заряда молекулярных ионов предполагает существование нечетного количества атомов азота. Тем не менее, пики молекулярных ионов в алифатических аминах слабы из-за легкости фрагментации рядом с аминами. Реакции альфа-расщепления являются наиболее важным способом фрагментации аминов; для 1° н-алифатических аминов наблюдается интенсивный пик при m/z 30. [11] [6]
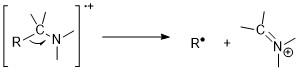
Ароматические амины имеют интенсивные пики молекулярных ионов. Анилины предпочитают терять атом водорода до выхода HCN.

Нитрилы
[ редактировать ]Основным способом фрагментации является потеря атома H (M – 1) углерода, следующего за группой CN, вследствие резонансной стабилизации. Перегруппировку Маклафферти можно наблюдать, когда они имеют более длинные цепи. [6]

Нитросоединения
[ редактировать ]Алифатические нитросоединения обычно демонстрируют слабые пики молекулярных ионов, тогда как ароматические нитросоединения дают сильный пик. Распространенным способом деградации является потеря NO. + и НЕТ 2+ . [6]

Электрораспыление и химическая ионизация при атмосферном давлении
[ редактировать ]Электрораспыление и химическая ионизация при атмосферном давлении имеют разные правила интерпретации спектра из-за разных механизмов ионизации. [16]
См. также
[ редактировать ]- Алгоритм обнаружения компонентов (CODA), алгоритм, используемый при анализе данных масс-спектрометрии.
- Список программного обеспечения для масс-спектрометрии
Ссылки
[ редактировать ]- ^ Терренс А. Ли (4 февраля 1998 г.). Руководство для начинающих по масс-спектральной интерпретации . Джон Уайли и сыновья . ISBN 978-0-471-97629-5 .
- ^ Перейти обратно: а б с д и ж г Фред В. Маклафферти (1 января 1993 г.). Интерпретация масс-спектров . Университетские научные книги. ISBN 978-0-935702-25-5 .
- ^ Спектрометрическая идентификация органических соединений Сильверстайн, Басслер, Моррилл, 4-е изд.
- ^ Органическая спектроскопия Уильям Кемп 2-е изд. ISBN 0-333-42171-X
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Интернет-исправленная версия: (2006–) « Электронная ионизация ». doi : 10.1351/goldbook.E01999
- ^ Перейти обратно: а б с д и ж г час Павиа, Дональд Л. Введение в спектроскопию . п. 141. ИСБН 1-285-46012-Х .
- ^ Перейти обратно: а б с Туречек, Франтишек; Маклафферти, Фред В. (1993). Интерпретация масс-спектров . Саусалито, Калифорния: Университетские научные книги. стр. 37–38. ISBN 0-935702-25-3 .
- ^ Дэвид О. Спаркман (2007). Справочник по масс-спектрометрии . Питтсбург: паб Global View. п. 64. ИСБН 0-9660813-9-0 .
- ^ Карни, Мириам; Мандельбаум, Ашер (1980). «Правило четных электронов» . Органическая масс-спектрометрия . 15 (2): 53–64. дои : 10.1002/oms.1210150202 . ISSN 0030-493X .
- ^ Брайт, Дж. В.; Чен, ECM (1983). «Масс-спектральная интерпретация с использованием «правила '13'»». Журнал химического образования . 60 (7): 557. Бибкод : 1983ЖЧЭд..60..557Б . дои : 10.1021/ed060p557 . ISSN 0021-9584 .
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п д р с т Дасс, Чхабил (2007). Основы современной масс-спектрометрии . Wiley-interscience. стр. 219–232. ISBN 978-0-471-68229-5 .
- ^ Ф. В. Маклафферти (1959). «Масс-спектрометрический анализ. Молекулярные перегруппировки». Анальный. хим. 31 (1): 82–87. дои : 10.1021/ac60145a015 .
- ^ Гросс ML (2004). «Фокус в честь Фреда Маклафферти, лауреата премии 2003 года за выдающийся вклад за открытие «перегруппировки Маклафферти» » . Дж. Ам. Соц. Масс-спектр . 15 (7): 951–5. дои : 10.1016/j.jasms.2004.05.009 . ПМИД 15234352 .
- ^ Нибберинг Н.М. (2004). «Перегруппировка Маклафферти: личные воспоминания» . Дж. Ам. Соц. Масс-спектр . 15 (7): 956–8. дои : 10.1016/j.jasms.2004.04.025 . ПМИД 15234353 .
- ^ Кингстон, Дэвид Г. (1974). «Внутримолекулярный перенос водорода в масс-спектрах. II. Перегруппировка Маклафферти и родственные реакции». Химические обзоры . 74 : 216–242. дои : 10.1021/cr60288a004 .
- ^ Холчапек, Михал; Хираско, Роберт; Лиза, Мирослав (2010). «Основные правила интерпретации масс-спектров ионизации малых молекул при атмосферном давлении». Журнал хроматографии А. 1217 (25): 3908–3921. дои : 10.1016/j.chroma.2010.02.049 . ISSN 0021-9673 . ПМИД 20303090 .





