Карборановая кислота
 | |
| Идентификаторы | |
|---|---|
3D model ( JSmol )
|
|
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
Карборановые кислоты H(CXB
11 лет
5 З
6 ) (X, Y, Z = H, Alk, F, Cl, Br, CF 3 ) — класс суперкислот , [ 1 ] некоторые из них, по оценкам, по крайней мере в один миллион раз сильнее , чем 100% чистая серная кислота, с точки зрения значений функции кислотности Гаммета ( H 0 ≤ –18) и имеют расчетные значения p K a значительно ниже –20, что устанавливает их как некоторые из самых сильных известных кислот Бренстеда. [ 2 ] [ 3 ] [ 4 ] Наиболее изученным примером является сильнохлорированное производное H(CHB
11 кл
11 ) . Кислотность H(CHB
11 кл
11 ) значительно превосходит трифликовую кислоту , CF
3 ТАК
3 H и бистрифлимид CF (
3 ТАК
2 )
2 NH , соединения, ранее считавшиеся наиболее сильными изолируемыми кислотами.
Их высокая кислотность обусловлена обширной делокализацией сопряженных с ними оснований, карборат-анионов (CXB 11 Y 5 Z 6 − ), которые обычно дополнительно стабилизируются электроотрицательными группами, такими как Cl, F и CF 3 . Из-за отсутствия окислительных свойств, а также исключительно низкой нуклеофильности и высокой стабильности сопряженных с ними оснований они являются единственными известными суперкислотами, которые протонируют C 60 фуллерен без его разложения. [ 5 ] [ 6 ] Кроме того, они образуют стабильные, изолируемые соли с протонированным бензолом C 6 H 7. + , исходное соединение промежуточных продуктов Уиланда, встречающееся в реакциях электрофильного ароматического замещения .
Фторкарборановая кислота H(CHB
11 Ф
11 ) даже сильнее, чем хлоркарборановая кислота. Она способна протонировать бутан с образованием трет -бутильного катиона при комнатной температуре и является единственной известной кислотой, которая протонирует диоксид углерода с образованием мостикового катиона [H (CO)
2 )
2 ] +
, что делает ее, возможно, самой сильной из известных кислот. В частности, CO 2 не подвергается заметному протонированию при обработке смешанными суперкислотами HF-SbF 5 или HSO 3 F-SbF 5 . [ 7 ] [ 8 ] [ 9 ]
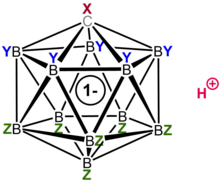
Как класс карборановые кислоты образуют наиболее кислую группу из хорошо определенных известных изолируемых веществ, гораздо более кислых, чем ранее известные однокомпонентные сильные кислоты, такие как трифликовая кислота или хлорная кислота . В некоторых случаях, как и в случае с почти пергалогенированными производными, упомянутыми выше, их кислотность конкурирует (и, возможно, превосходит) с кислотностью традиционных смешанных суперкислот Льюиса-Бренстеда, таких как волшебная кислота и фторсурьмяная кислота . (Однако прямое сравнение до сих пор было невозможно из-за отсутствия меры кислотности, подходящей для обоих классов кислот: значения p K a плохо определены для химически сложных смесей кислот, тогда как Значения H 0 не могут быть измерены для карборановых кислот с очень высокой температурой плавления).
Кислотность
[ редактировать ]
11 кл
11 ) было показано, что он мономерен в газовой фазе, при этом кислый протон (показан красным ) связан с Cl(12) и вторично связан с Cl(7). Мономерная форма метастабильна при конденсации, но в конечном итоге полимеризуется с образованием структуры с кислотными протонами, соединяющими карборановые звенья. [ 10 ] ( Примечание : линии между атомами углерода и бора карборанового ядра показывают связь, но не должны интерпретироваться как одинарные связи. Порядки связей меньше единицы из-за дефицита электронов.)
Сила кислоты Бренстеда-Лоури соответствует ее способности выделять ион водорода. Одной из распространенных мер силы кислоты для концентрированных сверхкислотных жидких сред является функция кислотности Гаммета, H 0 . На основе способности количественно протонировать бензол хлоркарборановая кислота H (CHB
11 кл
11 ), согласно консервативным оценкам, имеет значение H 0 на уровне -18 или ниже, что приводит к общему утверждению, что карборановые кислоты по крайней мере в миллион раз сильнее, чем 100% серная кислота ( H 0 = -12). [ 11 ] [ 12 ] Однако поскольку величина H 0 измеряет протонирующую способность жидкой среды, кристаллическая и тугоплавкая природа этих кислот не позволяет проводить прямое измерение этого параметра. Что касается p K a , несколько иной меры кислотности, определяемой как способность данного растворенного вещества подвергаться ионизации в растворителе, карборановые кислоты, по оценкам, имеют значения p K a ниже -20, даже без электроноакцепторных заместителей на атомы бора (например, H(CHB
11 ч.
11 ) имеет ap K a, равный -24), [ 13 ] с (пока неизвестным) полностью фторированным аналогом H(CB
11 Ф
12 ), имеющий расчетное значение p K a, равное -46. [ 4 ] Известная кислота H(CHB
11 Ф
11 ) с на один фтор меньше, как ожидается, будет лишь немного слабее (p K a < −40).
В газовой фазе H(CHB
11 Ф
11 ) имеет расчетную кислотность 216 ккал/моль по сравнению с экспериментально определенной кислотностью 241 ккал/моль (в разумном соответствии с расчетным значением 230 ккал/моль) для H(CHB
11 кл
11 ) . Напротив, HSbF 6 (упрощенная модель донора протонов во фторсурьмяной кислоте ) имеет расчетную кислотность газовой фазы 255 ккал/моль, в то время как предыдущим экспериментально установленным рекордсменом был (C 4 F 9 SO 2 ) 2 NH, аналог бистрифлимида , 291 ккал/моль. Таким образом, H(CHB
11 Ф
11 ) , вероятно, является самым кислым веществом, синтезированным до сих пор в массе, с точки зрения кислотности газовой фазы. Учитывая его уникальную реакционную способность, он также является сильным претендентом на звание самого кислого вещества в конденсированной фазе (см. выше). Были предсказаны некоторые даже более сильнокислотные производные с кислотностью газовой фазы <200 ккал/моль. [ 14 ] [ 15 ]
Карборановые кислоты отличаются от классических суперкислот тем, что представляют собой четко определенные однокомпонентные вещества. Напротив, классические суперкислоты часто представляют собой смеси кислот Бренстеда и кислот Льюиса (например, HF/SbF 5 ). [ 6 ] Несмотря на то, что карборановые кислоты на основе бора являются самой сильной кислотой, они описываются как «мягкие», чисто протонирующие слабоосновные вещества без дальнейших побочных реакций. [ 16 ] В то время как обычные суперкислоты разлагают фуллерены из-за их сильно окисляющего кислотного компонента Льюиса, карборановая кислота обладает способностью протонировать фуллерены при комнатной температуре с образованием изолируемой соли. [ 17 ] [ 6 ] Кроме того, анион, образующийся в результате переноса протона, практически полностью инертен. Именно это свойство делает карборановые кислоты единственными веществами, сравнимыми по кислотности со смешанными суперкислотами, которые также можно хранить в стеклянной бутылке, поскольку в них отсутствуют или не образуются различные вещества, отдающие фторид (которые разъедают стекло). [ 18 ] [ 17 ]
История
[ редактировать ]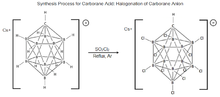
Карборановая кислота была впервые обнаружена и синтезирована профессором Кристофером Ридом и его коллегами в 2004 году в Калифорнийском университете в Риверсайде. [ 6 ] Исходная молекула, из которой образуется карборановая кислота, икосаэдрический карборат-анион, ГХБ.
11 ч. −
11 , был впервые синтезирован в компании DuPont в 1967 году Уолтером Нотом. Исследования свойств этой молекулы были приостановлены до середины 1980-х годов, когда чешская группа ученых-бористов Плешек, Штибр и Хержманек усовершенствовала процесс галогенирования молекул карборана. Эти результаты сыграли важную роль в разработке современной методики синтеза карборановой кислоты. [ 17 ] [ 19 ] Процесс заключается в обработке Cs + [HCB 11 Ч 11 ] − с ТАК
2 кл.
2 , кипячение в сухом аргоне для полного хлорирования молекулы с образованием карборановой кислоты, но было показано, что полное хлорирование происходит только при определенных условиях. [ 20 ] [ 17 ] [ 21 ]
В 2010 году Рид опубликовал руководство с подробным описанием процедур синтеза карборановых кислот и их производных. [ 22 ] Тем не менее, синтез карборановых кислот остается длительным и трудным и требует наличия перчаточного бокса в хорошем состоянии и специального оборудования. Исходным материалом является коммерчески доступный декаборан(14) , высокотоксичное вещество. Наиболее изученная карборановая кислота H(CHB
11 кл
11 ) готовится в 13 этапов. Последние несколько этапов особенно чувствительны и требуют перчаточного бокса при концентрации < 1 ppm H 2 O без каких-либо паров слабоосновных растворителей, поскольку такие слабые основания, как бензол или дихлорметан, будут реагировать с электрофилами на основе карборана и кислотами Бренстеда. Заключительной стадией синтеза является метатезис карборатной соли μ-гидридодисилилия с избыточной жидкостью, безводным хлористым водородом, предположительно обусловленный образованием прочных связей Si–Cl и H–H в летучих побочных продуктах:
- [Et 3 Si–H–SiEt 3 ] + [HCB 11 Cl 11 ] − + 2HCl → H(CHB
11 кл
11 ) + 2Et3SiCl + H2
- [Et 3 Si–H–SiEt 3 ] + [HCB 11 Cl 11 ] − + 2HCl → H(CHB
Продукт выделяли выпариванием побочных продуктов и характеризовали его ИК-спектрометрию (ν CH = 3023 см- 1). −1 ) и ядерного магнитного резонанса (δ 4,55 (с, 1H, CH), 20,4 (с, 1H, H + ) в спектрах жидкого SO 2 ) (обратите внимание на чрезвычайно слабый химический сдвиг кислого протона). [ 22 ] Хотя реакции, используемые при синтезе, аналогичны, получение чистого образца более кислого H(CHB
11 Ф
11 ) оказался еще более сложным, потребовавшим чрезвычайно строгих процедур по исключению следов слабоосновных примесей. [ 7 ]
Структура
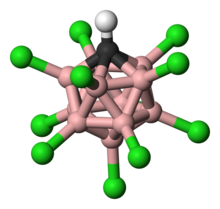
[ редактировать ]Карборановая кислота состоит из 11 атомов бора; каждый атом бора связан с атомом хлора. Атомы хлора повышают кислотность и действуют как щит от атак извне из-за стерических препятствий, которые они образуют вокруг кластера. Кластер, состоящий из 11 боров, 11 хлоров и одного атома углерода, соединен с атомом водорода, связанным с атомом углерода. Атомам бора и углерода разрешено образовывать шесть связей из-за способности бора образовывать трехцентровые двухэлектронные связи. [ 19 ]

Бор обладает способностью образовывать «трехцентровую двухэлектронную связь». На фото показаны резонансные структуры связи 3c-2e в диборане.
Хотя структура карборановой кислоты сильно отличается от структуры обычных кислот, они распределяют заряд и стабильность одинаково. Карборанат-анион распределяет свой заряд путем делокализации электронов по 12 атомам клетки. [ 23 ] Это было показано в исследовании рентгеновской дифракции монокристалла, обнаруживающем укорочение длин связей в гетероциклической части кольца, что указывает на электронную делокализацию. [ 24 ]
Хлорированный карбаклозо - додекаборат-анион ГХБ
11 кл −
11 представляет собой чрезвычайно стабильный анион с тем, что ранее было описано как «замещающе инертные» вершины B – Cl.
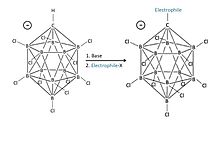
дескриптора Закрытие указывает на то, что молекула формально получена (путем B-to-C + замена) из борана стехиометрии и заряда [B n H n ] 2− ( n = 12 для известных карборановых кислот). [ 25 ] Каркасная структура, образованная 11 атомами бора и 1 атомом углерода, позволяет электронам сильно делокализоваться через трехмерную клетку (специальная стабилизация карборановой системы получила название «σ-ароматичности»), а также высокая энергия, необходимая для разрушения Часть кластера бора в молекуле — это то, что придает аниону его замечательную стабильность. [ 25 ] Поскольку анион чрезвычайно стабилен, он не будет вести себя как нуклеофил по отношению к протонированному субстрату, а сама кислота совершенно не окисляется, в отличие от кислотных компонентов Льюиса многих суперкислот, таких как пентафторид сурьмы. Следовательно, чувствительные молекулы, такие как C 60, могут быть протонированы без разложения. [ 26 ] [ 27 ]
Использование
[ редактировать ]Существует множество предлагаемых применений карборановых кислот на основе бора. Например, они были предложены в качестве катализаторов крекинга углеводородов и изомеризации н- алканов с образованием разветвленных изоалканов (например, изооктана). Карборановые кислоты также можно использовать в качестве сильных селективных кислот Бренстеда для тонкого химического синтеза, где низкая нуклеофильность противоаниона может быть выгодной. В механистической органической химии их можно использовать при изучении реакционноспособных катионных промежуточных продуктов. [ 28 ] В неорганическом синтезе их беспрецедентная кислотность может позволить выделить экзотические виды, такие как соли протонированного ксенона. [ 18 ] [ 19 ] [ 29 ]
Ссылки
[ редактировать ]- ^ Обратите внимание, что изображение кислого протона - это не тот, который связан с карбораном, а противоион, который не отображается.
- ^ О, Джорджия; Пракаш, ГКС; Соммер, Дж.; Мольнар, А. (2009). Химия суперкислот (2-е изд.). Уайли. п. 41. ИСБН 978-0-471-59668-4 .
- ^ То есть, если бы она была жидкой, протонирующая способность чистого образца карборановой суперкислоты, измеренная по активности H + будет в миллион раз выше, чем у 100% серной кислоты .
- ^ Перейти обратно: а б Липпинг, Лаури; Лейто, Иво; Коппель, Ивар; Кроссинг, Инго; Химмель, Даниэль; Коппель, Ильмар А. (14 января 2015 г.). «Сверхкислотность кислот Бренстеда на основе клозо-додекабората: исследование DFT». Журнал физической химии А. 119 (4): 735–743. Бибкод : 2015JPCA..119..735L . дои : 10.1021/jp506485x . ПМИД 25513897 .
- ^ Юхас, М.; Хоффманн, С.; Стоянов Е.; Ким, К.-К.; Рид, Калифорния (2004). «Самая сильная изолируемая кислота». Angewandte Chemie, международное издание . 43 (40): 5352–5355. дои : 10.1002/anie.200460005 . ПМИД 15468064 .
- ^ Перейти обратно: а б с д Рид, Калифорния (2005). «Карборановые кислоты. «Новые «сильные, но мягкие» кислоты для органической и неорганической химии» . Chemical Communications . 2005 (13): 1669–1677. doi : 10.1039/b415425h . PMID 15791295 .
- ^ Перейти обратно: а б Нава Мэтью (2013). «Самая сильная кислота Бренстеда: протонирование алканов H (CHB 11 F 11 ) при комнатной температуре» . Angewandte Chemie, международное издание . 53 (4): 1131–1134. дои : 10.1002/anie.201308586 . ПМЦ 4993161 . ПМИД 24339386 .
- ^ Рид, Кристогер А. (2013). «Мифы о протоне. Природа H + в конденсированных средах» . Отчеты о химических исследованиях . 46 (11): 2567–75. : 10.1021 /ar400064q . PMC 3833890. . PMID 23875729 doi
- ^ Каммингс, Стивен; Грачиан, Грант П.; Рид, Кристофер А. (22 января 2016 г.). «Самая сильная кислота: протонирование углекислого газа» . Angewandte Chemie, международное издание . 55 (4): 1382–1386. дои : 10.1002/anie.201509425 . ISSN 1521-3773 . ПМИД 26663640 . S2CID 2409194 .
- ^ Стоянов Евгений С.; Хоффманн, Стефан П.; Юхас, Марк; Рид, Кристофер А. (март 2006 г.). «Структура самой сильной кислоты Бренстеда: карборановая кислота H (CHB 11 Cl 11 )» . Журнал Американского химического общества . 128 (10): 3160–3161. дои : 10.1021/ja058581l . ISSN 0002-7863 . ПМИД 16522093 . S2CID 39848943 .
- ^ Рид, Калифорния (октябрь 2011 г.). «Самая сильная кислота». хим. Новая Зеландия . 75 : 174–179. дои : 10.1002/chin.201210266 . S2CID 6226748 .
- ^ Ола, Джорджия; Пракаш, ГКС; Соммер, Дж.; Мольнар, А. (2009). Химия суперкислот (2-е изд.). Уайли. п. 41. ISBN 978-0-471-59668-4 .
- ^ Значения p K a рассчитаны для 1,2-дихлорэтана в качестве растворителя, при этом для удобства p K a пикриновой кислоты «привязано» к 0. Поскольку водное значение pKa пикриновой кислоты равно 0,4, эти расчетные значения дают приблизительную оценку pKa карборанов в воде.
- ^ Мейер, Мэтью М.; Ван, Сюэ-Бин; Рид, Кристофер А.; Ван, Лай-Шэн; Касс, Стивен Р. (23 декабря 2009 г.). «Исследование слабых для оценки сильных: экспериментальное определение энергии связи электронов карборан-анионов и кислотности газовой фазы карборановых кислот» . Журнал Американского химического общества . 131 (50): 18050–18051. дои : 10.1021/ja908964h . ISSN 1520-5126 . ПМИД 19950932 . S2CID 30532320 .
- ^ Липпинг, Лаури; Лейто, Иво; Коппель, Ивар; Коппель, Ильмар А. (19 ноября 2009 г.). «Газовая фаза Бренстедовской сверхкислотности некоторых производных монокарба-клозо-боратов: вычислительное исследование». Журнал физической химии А. 113 (46): 12972–12978. Бибкод : 2009JPCA..11312972L . дои : 10.1021/jp905449k . ISSN 1089-5639 . ПМИД 19807147 .
- ^ Рид, Кристофер А. (октябрь 2011 г.). «Самая сильная кислота» (PDF) . Химия в Новой Зеландии . 75 (4): 174–179 . Проверено 13 февраля 2015 г.
- ^ Перейти обратно: а б с д Юхас М.; Хоффманн С.; Стоянов Е.; Ким К.-Ц.; Рид, Калифорния (2004). «Самая сильная изолируемая кислота». Angewandte Chemie, международное издание . 43 (40): 5352–5355. дои : 10.1002/anie.200460005 . ПМИД 15468064 .
- ^ Перейти обратно: а б Хопкин, М. (1 ноября 2004 г.). Создана самая сильная кислота в мире. Получено 3 марта 2015 г. с http://www.nature.com/news/2004/041115/full/news041115-5.html.
- ^ Перейти обратно: а б с Сато, Кентаро. «Самая сильная кислота в мире» . Музей органической химии: искусство и история молекулярного мира . Архивировано из оригинала 9 марта 2019 года . Проверено 13 февраля 2015 г.
- ^ «Обратное дело». Химические коммуникации . 46 (48): 9259. 28 декабря 2010 г. дои : 10.1039/C0CC90142C . ISSN 1364-548X .
- ^ Гу, Вэйсин; Маккалок, Билли Дж.; Рейбенспис, Джозеф Х.; Озеров, Олег В. (2010). Усовершенствованные методы галогенирования [ 11 H ГХБ « − анион». Chemical Communications . 46 (16). Королевское химическое общество (RSC): 2820–2822. doi : 10.1039/c001555e . PMID 20369194 .
- ^ Перейти обратно: а б Рид, Кристофер А. (19 января 2010 г.). "ЧАС + , СН 3 + , и R 3 Si + Карборановые реагенты: когда трифлаты терпят неудачу» . Отчеты о химических исследованиях . 43 (1): 121–128. : 10.1021 /ar900159e . ISSN 0001-4842 . PMC 2808449. . PMID 19736934 doi
- ^ Эль-Хеллани А.; Лавалло В. (2014). «Слияние N-гетероциклических карбенов с карборан-анионами». Энджью. хим. Межд. Эд . 53 (17): 4489–4493. дои : 10.1002/anie.201402445 . ПМИД 24664969 .
- ^ Чан, Аллен Л.; Фахардо, Хавьер младший; Райт, Джеймс Х. II; Асай, Мэтью; Лавалло, Винсент (2013). «Наблюдение за комнатной температурой активации B – Cl HCB 11 Cl 11». − Анион и выделение стабильного анионного карборанилфосфазида». Неорганическая химия . 52 (21): 12308–12310. doi : 10.1021/ic402436w . PMID 24138749 .
- ^ Перейти обратно: а б Рид, Кристофер А. (1998). «Карбораны: новый класс слабокоординирующих анионов для сильных электрофилов, окислителей и суперкислот». Отчеты о химических исследованиях . 31 (3): 133–139. дои : 10.1021/ar970230r .
- ^ Рамирес-Контрерас Родриго (2012). «Удобное C-алкилирование [HCB 11 Cl 11 ] − карборан-анион». Dalton Trans . 41 (26): 7842–7844. doi : 10.1039/C2DT12431A . PMID 22705934 .
- ^ Кин, Сэм (2011). Исчезающая ложка: и другие правдивые истории о безумии, любви и мировой истории из периодической таблицы элементов . Книга Бэк Бэй. ISBN 978-0-316-05163-7 .
- ^ Лавкин Крис. «Сильная, но нежная, непокрытая кислота». Калифорнийский университет, Риверсайд. (ноябрь 2004 г.). По состоянию на 13 февраля 2015 г.
- ^ Стайлз, Д. (1 сентября 2007 г.). «Колонка: Обезьянка-скамейка» . Проверено 3 марта 2015 г.
