Волшебная кислота
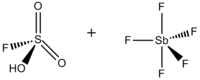 Фторсерная кислота-пентафторид сурьмы 1:1 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Серофтористоводородная кислота — пентафторстиборан (1:1) | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.041.727 |
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| HSbF6SOHSbF6SO3 | |
| Молярная масса | 316.82 g/mol |
| Появление | Жидкость |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Чрезвычайно коррозионный, токсичный, бурный гидролиз, окислитель. |
| СГС Маркировка : | |
      | |
| Опасность | |
| H240 , H271 , H290 , H302 , H314 , H335 , H350 , H402 , H410 , H411 , H441 | |
| P234 , P261 , P264 , P270 , P271 , P273 , P280 , P284 , P301+P310 , P301+P330+P331 , P303+P361+P353 , P304+P340+P310 , P305+P351+P338+P 310 , П363 , П390 , П403+П233 , П405 , П501 | |
| NFPA 704 (огненный алмаз) | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Волшебная кислота ( FSO 3 H·SbF 5 ) представляет собой суперкислоту , состоящую из смеси, чаще всего в молярном соотношении 1:1, фторсерной кислоты (HSO 3 F) и пентафторида сурьмы (SbF 5 ). Эта сопряженная суперкислотная система Бренстеда - Льюиса была разработана в 1960-х годах лабораторией Джорджа Олаха в Университете Кейс Вестерн Резерв и использовалась для стабилизации карбокатионов и гиперкоординированных ионов карбония в жидких средах. Волшебная кислота и другие суперкислоты также используются для катализа изомеризации насыщенных углеводородов и, как было показано, протонируют даже слабые основания, включая метан , ксенон , галогены и молекулярный водород . [1]
История
[ редактировать ]Термин «суперкислота» впервые был использован в 1927 году, когда Джеймс Брайант Конант обнаружил, что хлорная кислота может протонировать кетоны и альдегиды с образованием солей в неводном растворе. [1] Сам термин был придуман Р. Дж. Гиллеспи позже, после того как Конант объединил серную кислоту с фторсерной кислотой и обнаружил, что раствор в несколько миллионов раз более кислый, чем сама серная кислота. [2] Система волшебных кислот была разработана в 1960-х годах Джорджем Олахом и должна была использоваться для изучения стабильных карбокатионов. Гиллеспи также использовал кислотную систему для создания неорганических катионов с дефицитом электронов. Название возникло после рождественской вечеринки в 1966 году, когда сотрудник лаборатории Ола поместил парафиновую свечу в кислоту и обнаружил, что она растворяется довольно быстро. Проверка решения с помощью 1 H-ЯМР показал наличие трет -бутильного катиона, что позволяет предположить, что парафиновая цепь, образующая воск, была расщеплена, а затем изомеризована в относительно стабильный третичный карбокатион. [3] Это имя появилось в статье, опубликованной лабораторией Ола.
Характеристики
[ редактировать ]Структура
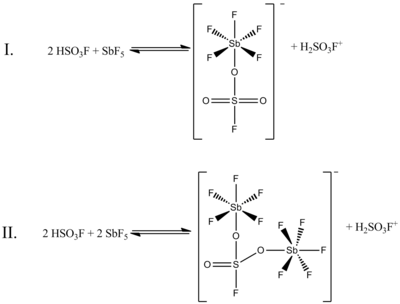
[ редактировать ]Хотя молярное соотношение HSO 3 F и SbF 5 1:1 лучше всего генерирует ионы карбония, также были документированы эффекты системы при других молярных соотношениях. Когда соотношение SbF 5 :HSO 3 F меньше 0,2, следующие два равновесия, определяемые формулой 19 F ЯМР-спектроскопии наиболее заметны в растворе:
(В обеих этих структурах сера имеет тетраэдрическую, а не плоскую координацию. Двойные связи между серой и кислородом правильнее представить как одинарные связи с формальными отрицательными зарядами на атомах кислорода и формальным зарядом плюс два на сере. Атомы сурьмы также будут иметь формальный заряд минус единица.)
На приведенном выше рисунке на «Равновесие I» приходится 80% данных ЯМР, а на «Равновесие II» — около 20%. При увеличении соотношения двух соединений от 0,4–1,4 появляются новые сигналы ЯМР, интенсивность которых увеличивается с увеличением концентрации SbF 5 . Разрешение сигналов также снижается из-за увеличения вязкости жидкой системы. [4]
Сила
[ редактировать ]Все протонобразующие кислоты сильнее 100% серной кислоты считаются суперкислотами и характеризуются низкими значениями функции кислотности Гаммета . Например, серная кислота H 2 SO 4 имеет кислотную функцию Гаммета H 0 , равную -12, хлорная кислота HClO 4 имеет кислотную функцию Гаммета, равную -13, и функцию волшебной кислоты 1:1. , HSO 3 F·SbF 5 , составляет -23. Считается, что фторантимоновая кислота , самая сильная из известных суперкислот, достигает экстраполированных значений H 0 до -28.
Использование
[ редактировать ]Наблюдения за стабильными карбокатионами
[ редактировать ]Волшебная кислота имеет низкую нуклеофильность, что позволяет повысить стабильность карбокатионов в растворе. «Классический» трехвалентный карбокатион можно наблюдать в кислой среде. Было обнаружено, что он является плоским и sp. 2 -гибридизированный. Поскольку атом углерода окружен всего шестью валентными электронами, он обладает сильным электронодефицитом и электрофилом. Он легко описывается точечными структурами Льюиса , поскольку содержит только двухэлектронные одинарные связи с соседними атомами углерода. Многие третичные циклоалкильные катионы могут образовываться и в сверхкислотных растворах. Одним из таких примеров является 1-метил-1-циклопентильный катион, который образуется как из предшественника циклопентана, так и из предшественника циклогексана. В случае циклогексана циклопентильный катион образуется в результате изомеризации вторичного карбокатиона в третичный, более стабильный карбокатион. Также наблюдались ионы циклопропилкарбения, алкенильные катионы и катионы арения.
Однако по мере того, как использование системы Magic acid стало более распространенным, стали наблюдаться карбокатионы более высокой координации. Пентакоординационные карбокатионы, также называемые неклассическими ионами , не могут быть изображены с использованием только двухэлектронных двухцентровых связей и вместо этого требуют двухэлектронных трех (или более) центральных связей. В этих ионах два электрона делокализованы на более чем двух атомах, что делает эти центры связи настолько дефицитными по электронам, что они позволяют насыщенным алканам участвовать в электрофильных реакциях. [1] Открытие гиперкоординированных карбокатионов вызвало споры о неклассических ионах в 1950-х и 60-х годах. В связи с медленными сроками 1 H-ЯМР, быстро уравновешивающие положительные заряды на атомах водорода, вероятно, останутся незамеченными. Однако ИК-спектроскопия , рамановская спектроскопия и 13 С ЯМР использовался для исследования мостиковых карбокатионных систем. Один спорный катион, норборнил-катион, наблюдался в нескольких средах, в том числе в Magic acid. [5]
Мостиковый атом углерода метилена является пятикоординированным, с тремя двухэлектронными двухцентровыми связями и одной двухэлектронной трехцентровой связью с оставшейся sp. 3 орбитальный. Квантово-механические расчеты также показали, что классическая модель не является минимумом энергии. [5]
Реакции с алканами
[ редактировать ]Волшебная кислота способна протонировать алканы . Например, метан реагирует с образованием CH +
5 при 140 °C и атмосферном давлении, хотя в качестве побочных продуктов также образуются некоторые ионы углеводородов с большей молекулярной массой. Водород является еще одним побочным продуктом реакции.
в присутствии FSO 3 D, а не FSO 3 Было показано, что H, метан заменяет атомы водорода на атомы дейтерия, и выделяется HD, а не H 2 . Это позволяет предположить, что в этих реакциях метан действительно является основанием и может принимать протон из кислой среды с образованием CH. +
5 . Затем этот ион депротонируется, что объясняет водородный обмен, или теряет молекулу водорода с образованием CH. +
3 – ион карбония. Этот вид весьма реакционноспособен и может давать несколько новых карбокатионов, как показано ниже. [6]
Более крупные алканы, такие как этан, также реагируют с волшебной кислотой: они обменивают атомы водорода и конденсируются с образованием более крупных карбокатионов, таких как протонированный неопентан. Затем этот ион расщепляется при более высоких температурах и реагирует с выделением газообразного водорода и образует т-амил-катион при более низких температурах.
Именно на этой ноте Джордж Ола предлагает нам больше не воспринимать названия «алкан» и «парафин» как синонимы. Слово «парафин» происходит от латинского «parum affinis», что означает «лишенный сродства». Он говорит: «Однако мы даем эту рекомендацию с некоторой ностальгией, поскольку «инертные газы», по крайней мере, сохранили свое «благородство», поскольку их химическая активность стала очевидной, но ссылка на «благородные углеводороды» кажется неуместной. " [6]
Катализ гидропероксидами
[ редактировать ]Волшебная кислота катализирует реакции расщепления-перегруппировки третичных гидропероксидов и третичных спиртов. Характер экспериментов, использованных для определения механизма, а именно тот факт, что они проводились в сверхкислой среде, позволил наблюдать образующиеся карбокатионные интермедиаты. Установлено, что механизм зависит от количества использованной волшебной кислоты. Вблизи молярной эквивалентности наблюдается только расщепление O–O, но с увеличением избытка волшебной кислоты расщепление C–O конкурирует с расщеплением O–O. Избыток кислоты, вероятно, дезактивирует перекись водорода, образующуюся при гетеролизе C–O. [7]
Волшебная кислота также катализирует электрофильное гидроксилирование ароматических соединений перекисью водорода, что приводит к получению моногидроксилированных продуктов с высоким выходом. Фенолы существуют в виде полностью протонированных частиц в растворах суперкислот и, образуясь в реакции, затем дезактивируются для дальнейшей электрофильной атаки. Протонированная перекись водорода является активным гидроксилирующим агентом. [8]
Катализ озоном
[ редактировать ]Оксигенацию алканов можно катализировать раствором волшебной кислоты – SO 2 ClF в присутствии озона . Механизм аналогичен механизму протолиза алканов с электрофильным внедрением в одинарные σ-связи алкана. Переходное состояние комплекса углеводород-озон имеет форму пентакоординированного иона. [9]
Спирты, кетоны и альдегиды также насыщаются кислородом за счет электрофильного внедрения. [10]
Безопасность
[ редактировать ]Как и в случае со всеми сильными кислотами, и особенно с суперкислотами, следует использовать соответствующие средства индивидуальной защиты. Помимо обязательных перчаток и очков, рекомендуется также использовать защитную маску и респиратор, закрывающий все лицо. Как и следовало ожидать, волшебная кислота очень токсична при проглатывании и вдыхании, вызывает серьезные ожоги кожи и глаз и токсична для водных организмов.
См. также
[ редактировать ]- Фторантимоновая кислота , самая сильная из известных суперкислот.
Ссылки
[ редактировать ]- ^ Jump up to: а б с Ола, Джорджия (2005). «Пересечение условных границ за полвека исследований». Журнал органической химии . 70 (7): 2413–2429. дои : 10.1021/jo040285o . ПМИД 15787527 .
- ^ Лесни, MS (март 2003 г.). «Основная история кислоты — от Аристотеля до Арнольда» (PDF) . Сегодняшний химик за работой : 47–48.
- ^ Ола, Джорджия; Пракаш, С.; Мольнар, А.; Соммер, Дж. (2009). Химия суперкислот (2-е изд.). Нью-Йорк: Джон Уайли и сыновья. п. 49. ИСБН 978-0-471-59668-4 .
- ^ Коммейрас, А.; Ола, Джорджия (1969). «Химия суперкислот. II. Ядерный магнитный резонанс и лазерная рамановская спектроскопия. Исследование системы растворителей пентафторид сурьмы-фторсерная кислота (диоксид серы) («волшебная кислота»). Влияние добавленных галогенидов, воды, спиртов и карбоновых кислот. Исследование иона гидроксония». Журнал Американского химического общества . 91 (11): 2929–2941. дои : 10.1021/ja01039a019 .
- ^ Jump up to: а б Ола, Джорджия (1973). «Карбокатионы и электрофильные реакции». Angewandte Chemie, международное издание . 12 (3): 173–254. дои : 10.1002/anie.197301731 .
- ^ Jump up to: а б Ола, Джорджия; Шлосберг, Р.Х. (1968). «Химия в суперкислотах. I. Водородный обмен и поликонденсация метана и алканов в растворе FSO 3 H-SbF 5 («Волшебная кислота»). Протонирование алканов и промежуточное соединение CH +
5 и родственные ионы углеводородов. Высокая химическая активность «парафинов» в реакциях ионных растворов». Журнал Американского химического общества . 90 (10): 2726–2727. doi : 10.1021/ja01012a066 . - ^ Ола, Джорджия; Паркер, Д.Г.; Йонеда, Ю.; Пелицца, Ф. (1976). «Оксифункционализация углеводородов. 1. Реакции протолитического расщепления-перегруппировки третичных алкилгидропероксидов с волшебной кислотой». Журнал Американского химического общества . 98 (8): 2245–2250. дои : 10.1021/ja00424a038 .
- ^ Ола, Джорджия; Ониши, Р. (1978). «Оксифункционализация углеводородов. 8. Электрофильное гидроксилирование бензола, алкилбензолов и галогенбензолов пероксидом водорода в суперкислотах». Журнал органической химии . 43 (5): 865–867. дои : 10.1021/jo00399a014 .
- ^ Ола, Джорджия; Йонена, Н.; Ониши, Р. (1976). «Оксифункционализация углеводородов. 6. Электрофильное оксигенирование алифатических спиртов, кетонов и альдегидов озоном в суперкислотах. Получение бифункциональных производных». Журнал Американского химического общества . 98 (23): 7341–7345. дои : 10.1021/ja00439a038 .
- ^ Ола, Джорджия; Йонеда, Н.; Паркер, Д.Г. (1976). «Оксифункционализация углеводородов. 3. Суперкислотная катализируемая оксигенация алканов озоном с участием протонированного озона, O 3 H + ". Журнал Американского химического общества . 98 (17): 5261–5268. doi : 10.1021/ja00433a035 .