Нитрозилсерная кислота
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Нитрозилсерная кислота | |
| Другие имена нитрозония бисульфат, камерные кристаллы | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.058 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| HSO 4 НЕТ | |
| Молярная масса | 127.08 g/mol |
| Появление | Бледно-желтые кристаллы [1] |
| Плотность | 1,865 г/мл в 40% раствор серной кислоты [2] |
| Температура плавления | 70 ° C (158 ° F; 343 К) [1] |
| Точка кипения | Разлагается |
| Разлагается | |
| Растворимость | Растворим в H 2 SO 4 [1] |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Окислитель |
| Родственные соединения | |
Другие анионы | NOCl |
Другие катионы | NaHSO 4 |
Родственные соединения | НОБФ 4 |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Нитрозилсерная кислота — химическое соединение формулы HSO 4 НЕТ . Это бесцветное твердое вещество, которое используется в промышленности при производстве капролактама . [3] и ранее был частью свинцово-камерного процесса производства серной кислоты . Соединение представляет собой смесь ангидридов серной и азотистой кислот .
В органической химии применяется как реагент для нитрозирования , как диазотирующий агент , как окислитель . [1]
Синтез и реакции
[ редактировать ]Типичная процедура предполагает растворение нитрита натрия в холодной серной кислоте: [4] [5]
- HNO 2 + H 2 SO 4 → HSO 4 NO + H 2 O
Его также можно получить реакцией азотной кислоты и диоксида серы . [6]
HSO 4 NO применяется в органической химии для получения солей диазония из аминов , например в реакции Зандмейера . Родственные реагенты для доставки NO включают тетрафторборат нитрозония. [НЕТ] + [БФ 4 ] − и нитрозилхлорид .
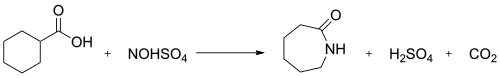
В промышленности реакцию нитрозодекарбоксилирования между нитрозилсерной кислотой и циклогексанкарбоновой кислотой используют для получения капролактама: [3]
Безопасность
[ редактировать ]Нитрозилсерная кислота является опасным материалом, поэтому следует принять меры предосторожности. [1]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д и Джордж А. Ола, Г. К. Сурья Пракаш, Ци Ван, Син-Я Ли (2001). «Нитрозилсерная кислота». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rn060 . ISBN 978-0471936237 .
{{cite book}}:|journal=игнорируется ( справка ) CS1 maint: несколько имен: список авторов ( ссылка ) - ^ «Раствор нитрозилсерной кислоты» . Мерк.
- ^ Jump up to: а б Ритц, Дж.; Фукс, Х.; Кечка, Х.; Моран, WC (2002). «Капролактам». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a05_031 . ISBN 978-3527306732 .
- ^ Ходжсон, Х.Х.; Махадеван, AP; Уорд, скорая помощь (1955). «1,4-Динитронафталин» . Органические синтезы ; Сборник томов , т. 3, с. 341 . (диазодирование с последующей обработкой нитритом)
- ^ Сандин, РБ; Кэрнс, TL (1943). «1,2,3-Триодо-5-нитробензол» . Органические синтезы ; Сборник томов , т. 2, с. 604 . (диазодирование с последующей обработкой йодидом)
- ^ Коулман, Г.Х.; Лиллис, Джорджия; Гохин, GE (1939). «Нитрозилхлорид». Неорганические синтезы . Том. 1. С. 55–59. дои : 10.1002/9780470132326.ch20 . ISBN 9780470132326 . Эта процедура генерирует нитрозилсерную кислоту в качестве промежуточного продукта на пути к NOCl.