Кремниевая кислота
Эта статья нуждается в дополнительных цитатах для проверки . ( июль 2022 г. ) |
В химии ( кремниевая кислота / s ɪ ˈ l ɪ s ɪ k / ) — любое химическое соединение , содержащее элемент кремний, присоединенный к оксиду ( =O ) и гидроксил ( −OH ) группы с общей формулой [H 2 x SiO x +2 ] n или, что то же самое, [SiO x (OH) 4-2 x ] n . [1] [2] Ортокремниевая кислота является характерным примером. Кремниевые кислоты редко наблюдаются изолированно, но считается, что они существуют в водных растворах , включая морскую воду , и играют роль в биоминерализации . [3] Обычно это бесцветные слабые кислоты, плохо растворимые в воде. Подобно силикатным анионам, которые являются их более известными сопряженными основаниями , кремниевые кислоты предположительно являются олигомерными или полимерными . кремниевая кислота так и не Простая была идентифицирована, поскольку эти виды представляют прежде всего теоретический интерес.
В зависимости от числа присутствующих атомов кремния различают моно- и поликремниевые (ди-, три-, тетракремниевые и др.) кислоты. Точно определенные кремниевые кислоты не были получены в форме, охарактеризованной рентгеновской кристаллографией .
Примеры
[ редактировать ]| Формула | Имя | Вычисленная структура |
|---|---|---|
| ЧАС 4 SiO 4 или Si(OH) 4 | ортокремниевая кислота |  |
| ЧАС 2 СиО 3 или SiO(OH) 2 | метакремниевая кислота |  |
| ЧАС 6 Си 22О 7 или O(Si(OH) 3 ) 2 | пиросиликатная кислота | 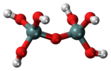 |
| ЧАС 2 Си 22О 5 или Си 22О 3 (О) 2 | дискремниевая кислота |  |
Реакции
[ редактировать ]Кремниевые кислоты можно рассматривать как гидратированные формы кремнезема, а именно 2 ЧАС 2 х SiO х +2 = SiO 2 ·(H 2 O) x . Действительно, в концентрированных растворах кремниевые кислоты обычно полимеризуются и конденсируются и в конечном итоге разлагаются до диоксида кремния и воды . Промежуточные стадии могут представлять собой очень густые жидкости или гелеобразные твердые вещества. [4] [5] [6] В результате обезвоживания последнего образуется твердая полупрозрачная форма кремнезема с порами атомного масштаба, называемая силикагелем , которая широко используется в качестве водопоглотителя и осушителя .
Кремнезем очень умеренно растворяется в воде. [ нужна ссылка ] и присутствует в морской воде в концентрациях ниже 100 частей на миллион . Предполагается, что в таких разбавленных растворах кремнезем существует в виде ортокремниевой кислоты. Теоретические расчеты показывают, что растворение кремнезема в воде происходит через образование SiO 2 ·2H 2 O , а затем ортокремниевая кислота. Комплекс [7]
Двойная связь кремний-кислород метакремниевой кислоты, подразумеваемая формулой H 2 SiO 3 является гипотетическим или крайне нестабильным. Такие двойные связи могут гидратироваться до пары гидроксилов ( −OH ) группы: [4]
Например,
или
Альтернативно, метакремниевая кислота способна образовывать циклические полимеры. [-SiO(OH) 2 -] n , который при гидратации может расщепляться до цепных полимеров. HO[-SiO(OH) 2 -] n H . Аналогичным образом, дискремниевая кислота способна образовывать сложные полимеры с четырехвалентным звеном. [=Si 2 O 3 (OH) 2 =] n . И наоборот, олигомерные и полимерные кислоты могут деполимеризоваться за гидролиза счет Мосты Si-O-Si или такие мосты могут быть созданы путем конденсации :
Как и органические силанолы , кремниевые кислоты являются слабыми кислотами. Для ортокремниевой кислоты рассчитаны потенциалы диссоциации p K a 1 = 9,84, p K a 2 = 13,2 при 25 °C.
Кремниевые кислоты и силикаты в растворе реагируют с молибдат- анионами, образуя желтые силикомолибдатные комплексы. Эту реакцию использовали для титрования содержания кремния в водных растворах и определения их природы. Было обнаружено , что при типичном приготовлении мономерная ортокремниевая кислота полностью реагирует за 75 секунд, димерная пирокремниевая кислота - за 10 минут, а высшие олигомеры - за значительно более длительное время. Реакция не наблюдается с коллоидным кремнеземом . [8]
Степень полимеризации кремниевых кислот в водном растворе можно определить по ее влиянию на температуру замерзания раствора ( криоскопия ). [8]
История
[ редактировать ]Кремниевая кислота была использована Йенсом Якобом Берцелиусом в начале 19 века для объяснения растворения диоксида кремния (кремнезема, кварца) в воде, а именно посредством реакции гидратации :
Основываясь на давления паров кривых силикагеля , Рейнаут Виллем Ван Беммелен утверждал, что гидратов кремнезема не существует, а есть только силикагель. С другой стороны, Густав Чермак фон Зейсенегг считал, что он наблюдал различные кремниевые кислоты как продукты разложения природных силикатных гелей. [9]
Первая кристаллическая кремниевая кислота была получена из слоистого силиката натросилита ( Na 2 Si 2 O 5 ) в 1924 году. Известно более 15 кристаллических кислот, включающих не менее шести модификаций Н 2 Si 2 O 5 . Некоторые кислоты могут адсорбировать и интеркалировать органические молекулы и поэтому являются интересной альтернативой кремнезему. [10]
Подготовка
[ редактировать ]Кристаллические кремниевые кислоты можно получить удалением катионов натрия из растворов силикатов натрия или ионообменной смолой обработкой силикатов натрия концентрированной серной кислотой . [10]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гринвуд, штат Нью-Йорк; Эрншоу, А. (2012). Химия элементов . Эльзевир Наука. п. 346. ИСБН 978-0-08-050109-3 . Проверено 27 июля 2022 г.
- ^ Илер, РК (1979). Химия кремнезема . Нью-Йорк: Уайли. ISBN 0-471-02404-Х .
- ^ Фрэнк Вигглсворт Кларк (1914). «Кремниевые кислоты» (PDF) . Строение природных силикатов . стр. 10–19.
- ^ Перейти обратно: а б WE Gye и WJ Purdy (1922): «Ядовитые свойства коллоидного кремнезема. I: Эффекты парентерального введения больших доз». Британский журнал экспериментальной патологии , том 3, выпуск 2, страницы 75–85. ПМК 2047780 .
- ^ Кацуми Гото (1956): «Влияние pH на полимеризацию кремниевой кислоты». Журнал физической химии , том 60, выпуск 7, страницы 1007–1008. два : 10.1021/j150541a046 .
- ^ Ханс Рамберг (1952): «Химические связи и распределение катионов в силикатах». Геологический журнал , том 60, выпуск 4, страницы 331–355. дои : 10.1086/625982 .
- ^ Бхаскар Мондал, Дипанвита Гош и Абхиджит К. Дас (2009): «Термохимия реакции образования кремниевой кислоты: прогноз нового пути реакции». Письма по химической физике , том 478, выпуски 4–6, страницы 115–119. дои : 10.1016/j.cplett.2009.07.063 .
- ^ Перейти обратно: а б ГБ Александр (1953): «Реакция низкомолекулярных кремниевых кислот с молибденовой кислотой». Журнал Американского химического общества , том 75, выпуск 22, страницы 5655–5657. два : 10.1021/ja01118a054 .
- ^ Роберт Блэк; Эрнст Меннер (1924), «О познании кремнеземов», Бер. Немецкий. Chem. Ges. (на немецком языке), 57 (8): 1477–1481, номер документа : 10.1002/cber.19240570850 .
- ^ Перейти обратно: а б «Силикаты», Энциклопедия промышленной химии Ульмана (7-е изд.), 2007, doi : 10.1002/14356007.a23_661 .




