Мышьяковая кислота
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Арсоровая кислота [1] | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.001 |
| Номер ЕС |
|
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 1553, 1554 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
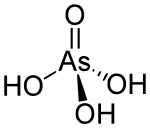
| H3AsOH3AsO4 | |
| Молярная масса | 141.942 g·mol −1 |
| Появление | Белые полупрозрачные или бесцветные кристаллы, гигроскопичны. |
| Плотность | 2,5 г/см 3 |
| Температура плавления | 35,5 ° C (95,9 ° F; 308,6 К) |
| Точка кипения | 120 ° C (248 ° F; 393 К) разлагается. |
| 16,7 г/(100 мл) | |
| Растворимость | растворим в этаноле |
| Давление пара | 55 гПа (50 °С) |
| Кислотность ( pKa ) | р К а1 = 2,19 р К а2 = 6,94 р К а3 = 11,5 [2] |
| Сопряженная база | Арсенат |
| Структура | |
| Тетраэдрический мышьяка атом | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Чрезвычайно токсично, канцерогенно, коррозионно. |
| СГС Маркировка : | |
     | |
| Опасность | |
| Х301 , Х312 , Х314 , Х331 , Х350 , Х361 , Х410 | |
| P201 , P202 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+P310 , P301+P330+P331 , P302+P352 , P303+P361+P353 , P304+P340 , П305+П351+П338 , P308+P313 , P310 , P311 , P312 , P321 , P322 , P330 , P363 , P391 , P403+P233 , P405 , P501 | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 48 мг/кг (крыса, перорально) 6 мг/кг (кролик, перорально) |
| Родственные соединения | |
Другие катионы | Арсенат натрия |
Родственные соединения | |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |

Мышьяковая кислота или арсоровая кислота представляет собой химическое соединение с формулой Н 3 АсО 4 . Более описательно написано как AsO(OH) 3 , эта бесцветная кислота является мышьяковистым аналогом фосфорной кислоты . Соли арсената и фосфата ведут себя очень похоже. Мышьяковая кислота как таковая не выделена, а встречается только в растворе, где она в значительной степени ионизирована. Его полугидратная форма ( 2H 3 AsO 4 ·H 2 O ) образует стабильные кристаллы. Кристаллические образцы дегидратируются с конденсацией при 100 °С. [3]
Характеристики
[ редактировать ]Это тетраэдрическая разновидность идеализированной симметрии C 3v с длинами связей As–O от 1,66 до 1,71 Å. [4]
Будучи трипротонной кислотой, ее кислотность описывается тремя состояниями равновесия:
- H 3 AsO 4 + H 2 O ⇌ H 2 AsO − 4 + [H 3 O] + , p K a1 = 2,19
- H 2 AsO − 4 + H 2 O ⇌ HAsO 2− 4 + [H 3 O] + , п К а2 = 6,94
- HAsO 2− 4 + H 2 O ⇌ AsO 3− 4 + [H 3 O] + , п К а3 = 11,5
Эти близки значения pKa фосфорной к значениям для кислоты . Высокоосновный арсенат-ион ( AsO 3−
4 ) — продукт третьей ионизации. В отличие от фосфорной кислоты, мышьяковая кислота является окислителем, о чем свидетельствует ее способность превращать йодид в йод .
Подготовка
[ редактировать ]Мышьяковую кислоту получают обработкой триоксида мышьяка концентрированной азотной кислотой . Триоксид азота производится как побочный продукт. [5]
- As 2 O 3 + 2 HNO 3 + 2 H 2 O → 2 H 3 AsO 4 + N 2 O 3
Полученный раствор охлаждают с образованием бесцветных кристаллов полугидрата . H 3 AsO 4 ·0,5H 2 O (или 2H 3 AsO 4 ·H 2 O ), хотя дигидрат H 3 AsO 4 ·2H 2 O образуется, когда кристаллизация происходит при более низких температурах. [5]
Другие методы
[ редактировать ]Мышьяковистая кислота медленно образуется при пятиокиси мышьяка растворении в воде, а также при мета- или пиромышьяковой кислоте ( H 4 As 2 O 7 ) обрабатывают холодной водой. Мышьяковую кислоту можно получить и непосредственно из элементарного мышьяка, увлажнив его и обработав озоном .
- 2As 3H2O 5O3 → 2H3AsO4 5O2 + + +
Приложения
[ редактировать ]Коммерческое применение мышьяковой кислоты ограничено ее токсичностью. Это предшественник различных пестицидов. Время от времени он находил применение в качестве консерванта для древесины широкого спектра действия , биоцида , отделочного средства для стекла и металла, а также реагента при синтезе некоторых красителей и органических соединений мышьяка. [6]
Безопасность
[ редактировать ]Мышьяковая кислота чрезвычайно токсична и канцерогенна, как и все соединения мышьяка. Это также коррозионно . ЛД для кроликов составляет 6 мг/кг ( 50 0,006 г/кг). [7]
Ссылки
[ редактировать ]- ^ «Мышьяковая кислота» .
- ^ Перрин, Д.Д., изд. (1982) [1969]. Константы ионизации неорганических кислот и оснований в водных растворах . Химические данные ИЮПАК (2-е изд.). Оксфорд: Пергамон (опубликовано в 1984 г.). Запись 11. ISBN 0-08-029214-3 . LCCN 82-16524 .
- ^ Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 0-12-352651-5 .
- ^ Ли, К.; Харрисон, WTA (2007). «Дигидрогенарсенат тетраэтиламмония-бис (мышьяковая кислота) и 1,4-диазониабицикло[2.2.2]октан-бис(дигидрогенарсенат) мышьяковая кислота: сети с водородными связями, содержащие анионы дигидрогенарсената и молекулы нейтральной мышьяковой кислоты». Акта Кристаллографика C. 63 (Пт 7): м308–м311. дои : 10.1107/S0108270107023967 . ПМИД 17609552 .
- ^ Jump up to: а б Г. Брауэр, изд. (1963). «Мышьяковая кислота». Справочник по препаративной неорганической химии . Том. 1 (2-е изд.). Нью-Йорк: Академическая пресса. п. 601.
- ^ Ежегодник полезных ископаемых, 2008, Т. 1, Металлы и полезные ископаемые . Государственная типография. 2010. стр. 6–. ISBN 978-1-4113-3015-3 .
- ^ Грунд, Сабина К.; Хануш, Куниберт; Вольф, Ханс Уве (2008). «Мышьяк и мышьяковые соединения». Энциклопедия промышленной химии Ульмана . дои : 10.1002/14356007.a03_113.pub2 . ISBN 978-3527306732 .
