Арсенат
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Арсенат | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
ПабХим CID | |||
| НЕКОТОРЫЙ | |||
| Характеристики | |||
| AsO3−AsO3−4 | |||
| Молярная масса | 138.918 g·mol −1 | ||
| Конъюгатная кислота | Мышьяковая кислота | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Чрезвычайно токсичен, канцерогенен. | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
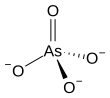
Арсенат представляет собой ион с химической формулой AsO3−4 4. [1] Связь в арсенате состоит из центрального атома мышьяка со степенью окисления +5, двойной связи с одним атомом кислорода и одинарной связи с еще тремя атомами кислорода . [2] Четыре атома кислорода ориентируются вокруг атома мышьяка в тетраэдрической геометрии . [2] Резонанс распределяет заряд -3 иона по всем четырем атомам кислорода.
Арсенат легко реагирует с металлами с образованием арсенатных соединений металлов . [2] [3] Арсенат — умеренный окислитель и акцептор электронов , с электродным потенциалом +0,56 В для восстановления его до арсенита . [4] Из-за того, что мышьяк имеет ту же валентность и атомный радиус , что и фосфор , арсенат имеет аналогичную геометрию и реакционную способность с фосфатом . [5] Арсенат может заменять фосфат в биохимических реакциях и токсичен для большинства организмов . [5] [6]
Естественное явление
[ редактировать ]
Арсенаты встречаются в природе в гидратированной и безводной форме в различных минералах . Примеры арсенатсодержащих минералов включают адамит , аларсит , аннабергит , эритрит и леграндит . [7] Когда два иона арсената уравновешивают заряд в формуле, ее называют диарсенатом, например диарсенатом цинка. Zn 3 (AsO 4 ) 2 .
Использование
[ редактировать ]на основе арсената, Пестициды такие как арсенат свинца, широко использовались до их замены более новыми пестицидами, такими как ДДТ , и последующего запрета несколькими регулирующими органами из-за проблем со здоровьем. [8] [9]
Соединения арсената переходного металла часто имеют яркую окраску и используются для изготовления пигментов . Арсенат меди был второстепенным соединением, используемым в египетском синем пигменте, используемом древними египтянами и римлянами . [10] Пигмент кобальтово-фиолетовый был изготовлен из арсената кобальта до того, как его токсичность привела к замене его фосфатом кобальта . [11] [12] [13]
Хромированный арсенат меди (CCA) широко используется в качестве консерванта для древесины с 1930-х годов. [14] Проблемы безопасности привели к постепенному отказу от использования древесины, обработанной CCA, для жилищных проектов во многих странах. [14] CCA остается распространенным и экономичным вариантом обработки для нежилых помещений, таких как сельское хозяйство . [14] [15]
Видообразование
[ редактировать ]
В зависимости от pH арсенат может находиться в виде тригидрогенарсената (то есть мышьяковой кислоты). H 3 AsO 4 ), дигидроарсенат ( H 2 AsO − 4 ), арсенат водорода ( HAsO 2− 4 ), или арсенат ( AsO3−4 . ) [18] Тригидрогенарсенат также известен как мышьяковая кислота . При данном pH распределение этих видов арсената можно определить по их соответствующим константам кислотной диссоциации . [17]
- H 3 AsO 4 + H 2 O ⇌ H 2 AsO − 4 + [H 3 O] + (р К а1 = 2,19)
- H 2 AsO − 4 + H 2 O ⇌ HAsO 2− 4 + [H 3 O] + (р К а2 = 6,94)
- HAsO 2− 4 + H 2 O ⇌ AsO 3− 4 + [H 3 O] + (р К а3 = 11,5)
Эти значения аналогичны значениям фосфорной кислоты . Арсенат водорода и арсенат дигидрогена преобладают в водном растворе с pH, близким к нейтральному. [17]
Восстановительный потенциал (pe) раствора также влияет на образование арсената. В природных водах содержание растворенного кислорода является основным фактором, влияющим на восстановительный потенциал. Арсенаты встречаются в кислородсодержащих водах с высоким значением PE, тогда как арсениты являются основной формой мышьяка в бескислородных водах с низким значением PE. [16]
Диаграмма Пурбе показывает совместное влияние pH и PE на образование арсената.
Загрязнение
[ редактировать ]Арсенаты, наряду с арсенитами, являются значительным источником загрязнения некоторых природных источников воды и могут привести к отравлению мышьяком при неоднократном воздействии. [19] [20] Страны с высоким содержанием минералов мышьяка в отложениях и горных породах, такие как Бангладеш , особенно подвержены риску загрязнения мышьяком. [21] [20]
Отравление арсенатом
[ редактировать ]Арсенат вреден для человека и животных , так как нарушает нормальное функционирование гликолиза и цикла Кребса . Арсенат заменяет неорганический фосфат на стадии гликолиза образуется 1,3-бисфосфоглицерат , в результате которого из глицеральдегид-3-фосфата . Вместо этого образуется 1-арсено-3-фосфоглицерат , который нестабилен и быстро гидролизуется , образуя следующий промежуточный продукт на пути — 3-фосфоглицерат . Таким образом, гликолиз продолжается, но молекула АТФ , которая могла бы образоваться из 1,3-бисфосфоглицерата теряется – арсенат является разобщителем гликолиза, что объясняет его токсичность. [22] [23]
Как и другие соединения мышьяка, арсенат связывается с липоевой кислотой , ингибируя превращение пирувата в ацетил-КоА , блокируя цикл Кребса и, следовательно, приводя к дальнейшей потере АТФ. [23]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ ПабХим. «Арсенат-ион» . pubchem.ncbi.nlm.nih.gov . Проверено 2 апреля 2023 г.
- ^ Jump up to: а б с «Арсенат-минерал | Британика» . www.britanica.com . Проверено 2 апреля 2023 г.
- ^ Ваалкес, Майкл П. (2019), Баан, Роберт А.; Стюарт, Бернард В.; Стрейф, Курт (ред.), «Мышьяк и металлы» , Согласование локализации опухоли и механизмы канцерогенеза , Научные публикации IARC, Лион (Франция): Международное агентство по исследованию рака, ISBN 978-92-832-2217-0 , PMID 33979075 , получено 2 апреля 2023 г.
- ^ «P1: Стандартные потенциалы восстановления по элементам» . Химия LibreTexts . 2 декабря 2013 года . Проверено 29 марта 2023 г.
- ^ Jump up to: а б Загрязнители, Комитет Национального исследовательского совета (США) по медицинскому и биологическому воздействию окружающей среды (1977). Химия мышьяка . Издательство национальных академий (США).
- ^ Элиас, Микаэль; Веллнер, Алон; Голдин-Азулай, Корина; Шабриер, Эрик; Ворхольт, Джулия А.; Эрб, Тобиас Дж.; Тауфик, Дэн С. (2012). «Молекулярная основа дискриминации фосфатов в средах, богатых арсенатом» . Природа . 491 (7422): 134–137. Бибкод : 2012Natur.491..134E . дои : 10.1038/nature11517 . ISSN 1476-4687 . ПМИД 23034649 . S2CID 99851438 .
- ^ «Минералогия мышьяка» . Mindat.org .
- ^ «Эволюция химических пестицидов» . www.fishersci.ca . Проверено 2 апреля 2023 г.
- ^ «Глобальная проблема пестицида арсената свинца» . Lead.org.au. Проверено 2 апреля 2023 г.
- ^ Дарис, Петра; Шмид, Томас (28 мая 2021 г.). «Следовые соединения в египетском синем цвете раннего средневековья несут информацию о происхождении, производстве, применении и старении» . Научные отчеты . 11 (1): 11296. Бибкод : 2021NatSR..1111296D . дои : 10.1038/s41598-021-90759-6 . ISSN 2045-2322 . ПМЦ 8163881 . ПМИД 34050218 .
- ^ Корбей, Мари-Клод; Шарланд, Жан-Пьер; Моффатт, Элизабет А. (2002). «Характеристика кобальтово-фиолетовых пигментов» . Исследования в области консервации . 47 (4): 237–249. дои : 10.2307/1506784 . ISSN 0039-3630 . JSTOR 1506784 .
- ^ «Кобальт фиолетовый» . КолорЛекс . Проверено 10 апреля 2023 г.
- ^ "Арсенат Кобальта - КАМЕЯ" . www.cameo.mfa.org . Проверено 10 апреля 2023 г.
- ^ Jump up to: а б с Бартон, К. (1 января 2014 г.), «Древесина, обработанная CCA» , в Векслере, Филиппе (редактор), Энциклопедия токсикологии (третье издание) , Оксфорд: Academic Press, стр. 751–752, ISBN 978-0-12-386455-0 , получено 10 апреля 2023 г.
- ^ Ликар, М; Шауэр, П; Япель, М; Глобокар, М; Оклобдия, М; Повсе, А; Сунич, В. (1 января 1970 г.). «Синтез и противомикробная активность некоторых теноиламидов» . Журнал медицинской химии . 13 (1): 159–161. дои : 10.1021/jm00295a053 . ISSN 1520-4804 . ПМИД 5412102 .
- ^ Jump up to: а б Мариньо, Белиса А.; Кристовао, Ракель О.; Боавентура, Руй АР; Вилар, Витор Дж. П. (1 января 2019 г.). «Удаление оксианионов As (III) и Cr (VI) из воды с помощью усовершенствованных процессов окисления / восстановления - обзор» . Наука об окружающей среде и исследования загрязнения . 26 (3): 2203–2227. дои : 10.1007/s11356-018-3595-5 . ISSN 1614-7499 . ПМИД 30474808 . S2CID 53783178 .
- ^ Jump up to: а б с Джекель, М.; Эми, GL (1 января 2006 г.), Ньюкомб, Гейл; Диксон, Дэвид (ред.), «Глава 11. Удаление мышьяка при очистке питьевой воды» , «Наука и технология взаимодействия» , «Наука о взаимодействии в очистке питьевой воды», том. 10, Elsevier, стр. 193–206 , получено 15 апреля 2023 г.
- ^ Загрязнители, Комитет Национального исследовательского совета (США) по медицинскому и биологическому воздействию окружающей среды (1977). Химия мышьяка . Издательство национальных академий (США).
- ^ Санчес-Родас, Даниэль; Луис Гомес-Ариса, Хосе; Хиральдес, Инмакулада; Веласко, Альфредо; Моралес, Эмилио (1 июня 2005 г.). «Видообразование мышьяка в речных и устьевых водах юго-западной Испании» . Наука об общей окружающей среде . 345 (1–3): 207–217. Бибкод : 2005ScTEn.345..207S . doi : 10.1016/j.scitotenv.2004.10.029 . ISSN 0048-9697 . ПМИД 15919540 .
- ^ Jump up to: а б «Мышьяк» . www.who.int . Проверено 15 апреля 2023 г.
- ^ ЛЧ (10 мая 2022 г.). «Снижение воздействия на население мышьяка в грунтовых водах в Бангладеш» . UCL Науки о Земле . Проверено 15 апреля 2023 г.
- ^ «Как мышьяк убивает?» . www.livscience.com . Проверено 31 марта 2023 г.
- ^ Jump up to: а б Хьюз, Майкл Ф. (7 июля 2002 г.). «Токсичность мышьяка и потенциальные механизмы действия» . Письма по токсикологии . 133 (1): 1–16. дои : 10.1016/s0378-4274(02)00084-x . ISSN 0378-4274 . ПМИД 12076506 .