Видообразование ионов
Видообразование ионов изменению концентрации различных форм иона при изменении pH раствора относится к . [1]
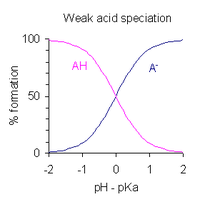
pH раствора монопротонной слабой кислоты можно выразить через степень диссоциации. После перестановки выражения, определяющего константу диссоциации кислоты , и помещения pH = -log 10 [H + ], получаем
- pH = p K a – log ( [AH]/[A − ] )
Это разновидность уравнения Хендерсона-Хассельбаха . Из этого выражения можно сделать вывод, что
- когда кислота диссоциирована на 1 %, то есть когда [AH]/[A − ] = 100, pH = p K a − 2
- когда кислота диссоциирована на 50 %, т. е. когда [AH]/[A − ] = 1, pH = p K а
- когда кислота диссоциирована на 99 %, то есть когда [AH]/[A − ] = 0,01, pH = p K a + 2
Отсюда следует, что диапазон pH, в котором происходит частичная диссоциация кислоты, составляет около p K a ± 2. Это показано графически справа.
Практическое применение этих результатов состоит в том, что диапазон перехода pH индикатора pH составляет примерно p K a ± 1; цвет индикатора в кислотной форме отличается от цвета сопряженной основной формы. В переходном диапазоне обе формы находятся в равновесии, поэтому цвет является промежуточным. За пределами переходного диапазона концентрация кислоты или сопряженного основания составляет менее 10 %, а цвет основных частиц доминирует.

может Слабая кислота быть определена как кислота с p K a больше примерно -2. Кислота с p K a = −2 будет диссоциировать на 99 % при pH 0, то есть в 1 М растворе HCl. Любая кислота с ap K a меньше примерно -2 называется сильной кислотой . Говорят, что сильные кислоты полностью диссоциированы. Не существует точного pKa, значения позволяющего различать сильные и слабые кислоты, поскольку сильные кислоты, такие как серная кислота , связаны в очень концентрированном растворе.
Расчет концентраций видов полипротонной кислоты более сложен, если значения p K не разделены на четыре или более, поскольку три или более видов могут сосуществовать при данном pH. Пример лимонной кислоты показан справа. Области pH, в которых существуют виды, сильно перекрываются, поскольку разница между последовательными значениями p K a невелика. Опубликовано большое количество компьютерных программ для расчета равновесных концентраций веществ. Большинство из них могут поддерживать гораздо более сложные равновесия, чем кислотно-основные равновесия в растворе. Подробную информацию о программах общего назначения см. в компьютерных программах для расчета концентрации веществ в химическом равновесии .
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Батлер, Джеймс Н. (1998). Ионное равновесие . Нью-Йорк: Уайли. ISBN 0-471-58526-2 .