Сульфат калия
 Арканит | |
 | |
| Имена | |
|---|---|
| Другие имена Сульфат калия | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.029.013 |
| Номер ЕС |
|
| номер Е | E515(i) (регуляторы кислотности, ...) |
| КЕГГ | |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
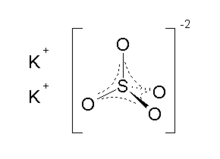
| К 2 СО 4 | |
| Молярная масса | 174.259 g/mol |
| Появление | Белый твердый |
| Запах | без запаха |
| Плотность | 2,66 г/см 3 [1] |
| Температура плавления | 1,069 [2] ° C (1956 ° F; 1342 К) |
| Точка кипения | 1689 ° C (3072 ° F; 1962 К) |
| 111 г/л (20 °С) 120 г/л (25 °С) 240 г/л (100 °С) | |
Произведение растворимости ( K sp ) | 1,32 (120 г/л) |
| Растворимость | мало растворим в глицерине нерастворим в ацетоне , спирте , CS 2 |
| −67.0·10 −6 см 3 /моль | |
Показатель преломления ( n D ) | 1.495 |
| Структура | |
| орторомбический | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Раздражающий |
| СГС Маркировка : | |
 | |
| Предупреждение | |
| H318 | |
| П280 , П305+П351+П338 , П310 | |
| точка возгорания | Невоспламеняющийся |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 6600 мг/кг (перорально, крыса) [3] |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Другие анионы | Селенат калия Теллурат калия |
Другие катионы | Сульфат лития Сульфат натрия Сульфат рубидия Сульфат цезия |
Родственные соединения | Гидросульфат калия Сульфит калия Бисульфит калия Персульфат калия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Сульфат калия (США) или сульфат калия (Великобритания), также называемый сульфатом калия (SOP), арканитом или архаичным поташем серы , представляет собой неорганическое соединение с формулой K 2 SO 4 , белое водорастворимое твердое вещество. Он обычно используется в удобрениях , обеспечивая как калий , так и серу .
История
[ редактировать ]Сульфат калия (K 2 SO 4 ) известен с начала 14 века. Его изучали Глаубер , Бойль и Тачениус . В 17 веке его назвали аркануни или сал дупликатум , так как он представлял собой комбинацию кислой соли и щелочной соли. Он был также известен как купоросный винный камень и соль Глейзера или соль полихрестум Глазери в честь химика-фармацевта Кристофера Глейзера , который приготовил его и использовал в медицинских целях. [4] [5]
Известный как arcanum duplicatum («двойной секрет») или panacea duplicata в досовременной медицине , он был приготовлен из остатков ( caput mortuum ), оставшихся от производства aqua fortis (азотная кислота, HNO 3 ) из селитры (нитрата калия, KNO 3 ) и купоросное масло (серная кислота, H 2 SO 4 ) по Глаубера способу :
- 2 KNO 3 + H 2 SO 4 → 2 HNO 3 + K 2 SO 4
Остаток растворяли в горячей воде, фильтровали и упаривали до кутикулы. Затем его оставили кристаллизоваться. Его использовали как мочегонное и потогонное средство . [6]
Согласно «Циклопедии Чемберса» , рецепт был приобретен за пятьсот талеров Чарльзом Фредериком, герцогом Гольштейн-Готторпским . Шредер, врач герцога, описал чудеса его великого применения в ипохондрических случаях, длительной и перемежающейся лихорадке , камнях, цинге и многом другом. [6]
Природные ресурсы
[ редактировать ]Минеральная форма сульфата калия — арканит — встречается относительно редко. Природными ресурсами сульфата калия являются минералы, которыми богата Штассфуртская соль . Это сокристаллизации сульфата калия и сульфатов магния , кальция и натрия .
Соответствующие минералы:
- Каинит , KMg(SO 4 )·Cl·3H 2 O
- Шёнит (теперь известный как пикромерит), K 2 SO 4 ·MgSO 4 ·6H 2 O
- Леонит , K 2 SO 4 ·MgSO 4 ·4H 2 O
- Лангбейнит , К 2 Mg 2 (SO 4 ) 3
- Афтиталит (ранее известный как глазерит), K 3 Na(SO 4 ) 2
- Polyhalite , K 2 SO 4 ·MgSO 4 ·2CaSO 4 ·2H 2 O
Сульфат калия можно отделить от некоторых из этих минералов, например каинита, поскольку соответствующая соль менее растворима в воде.
Кизерит MgSO 4 ·H 2 O можно соединить с раствором хлорида калия для получения сульфата калия.
Производство
[ редактировать ]В 1985 году было произведено около 1,5 миллионов тонн, обычно путем реакции хлорида калия с серной кислотой , аналогичной Мангеймскому процессу производства сульфата натрия. [7] Процесс включает промежуточное образование бисульфата калия — экзотермическую реакцию, происходящую при комнатной температуре:
- KCl + H 2 SO 4 → HCl + KHSO 4
Второй этап процесса является эндотермическим и требует затрат энергии:
- KCl + KHSO 4 → HCl + K 2 SO 4
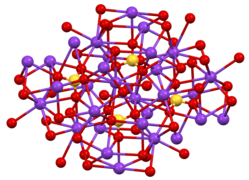
Структура и свойства
[ редактировать ]Известны две кристаллические формы. Орторомбическая β-K 2 SO 4 является распространенной формой, но она превращается в α-K 2 SO 4 при температуре выше 583 °C. [7] Эти структуры сложны, хотя сульфат принимает типичную тетраэдрическую геометрию. [8]
- Структура β-K 2 SO 4 .
- Координационная сфера одного из двух типов К + сайт.
- Среда SO4 в β-K 2 SO 4 .
Он не образует гидрата, в отличие от сульфата натрия . Соль кристаллизуется в виде двойных шестигранных пирамид, классифицируемых как ромбические. Они прозрачные, очень твердые, имеют горько-соленый вкус. Соль растворима в воде, но нерастворима в растворах гидроксида калия ( упр. гр. 1,35) или абсолютном этаноле .
Использование
[ редактировать ]Сульфат калия преимущественно используется в качестве удобрения . K 2 SO 4 не содержит хлоридов, которые могут быть вредны для некоторых культур. Сульфат калия предпочтителен для этих культур, к которым относятся табак и некоторые фрукты и овощи. Менее чувствительным культурам все равно может потребоваться сульфат калия для оптимального роста, если почва накапливает хлориды из поливной воды. [9]
Сырая соль также иногда используется при производстве стекла. Сульфат калия также используется в качестве погасителя пламени в артиллерийских метательных зарядах. Это уменьшает дульную вспышку , вспышку и избыточное давление взрыва.
Иногда его используют в качестве альтернативного средства для струйной обработки, аналогичного соде при струйной очистке , поскольку он более твердый и так же растворим в воде. [10]
Сульфат калия также можно использовать в пиротехнике в сочетании с нитратом калия для создания фиолетового пламени .
5% раствор сульфата калия использовался в начале 20 века как местное средство от комаров. [ нужна ссылка ]
Реакции
[ редактировать ]Подкисление
[ редактировать ]Гидросульфат калия (также известный как бисульфат калия), KHSO 4 , легко получают путем реакции K 2 SO 4 с серной кислотой . Он образует ромбические пирамиды , которые плавятся при температуре 197 °C (387 °F). Он растворяется в трех частях воды при температуре 0 ° C (32 ° F). Раствор ведет себя так, как если бы два его родственных соединения , K 2 SO 4 и H 2 SO 4 , присутствовали рядом друг с другом в несвязанном виде; избыток этанола осаждает нормальный сульфат (с небольшим количеством бисульфата) с оставшимся избытком кислоты.
Аналогично ведет себя плавленая сухая соль при нагревании до нескольких сотен градусов; он действует на силикаты , титанаты и т. д. так же, как действует серная кислота , нагретая выше температуры естественного кипения. Поэтому его часто используют в аналитической химии в качестве разрыхлителя. Информацию о других солях, содержащих сульфат, см. в разделе «сульфат» .
Ссылки
[ редактировать ]- ^ Патнаик, Прадьот (2002). Справочник неорганических химикатов . МакГроу-Хилл. ISBN 978-0-07-049439-8 .
- ^ Виндхольц, М; Будавари С., ред. (1983). Индекс Мерк . Рэуэй, Нью-Джерси: Merck & Co.
- ^ Чемберс, Майкл. «Калий сернокислый РН: 7778-80-5» . ХимИДплюс . Национальная медицинская библиотека США.
- ^ Де Милт, Клара (1942). «Кристофер Глейзер». Журнал химического образования . 19 (2): 53. Бибкод : 1942ЖЧЭд..19...53Д . дои : 10.1021/ed019p53 .
- ^ ван Клоостер, HS (1959). «Три столетия сешельской соли». Журнал химического образования . 36 (7): 314. Бибкод : 1959ЖЧЭд..36..314К . дои : 10.1021/ed036p314 .
- ^ Перейти обратно: а б
 Чемберс, Эфраим , изд. (1728). «Арканум дубликатум» . Циклопедия, или Универсальный словарь искусств и наук . Том. 1 (1-е изд.). Джеймс и Джон Кнаптон и др. п. *125.
Чемберс, Эфраим , изд. (1728). «Арканум дубликатум» . Циклопедия, или Универсальный словарь искусств и наук . Том. 1 (1-е изд.). Джеймс и Джон Кнаптон и др. п. *125. - ^ Перейти обратно: а б Шульц, Х.; Бауэр, Г.; Шахль, Э.; Хагедорн, Ф.; Шмиттингер, П. (2005). «Соединения калия». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_039 . ISBN 3527306730 .
- ^ Готье, М.; Паннетье, Г. (1968). сульфата калия структура «низкотемпературной» β- формы « Кристаллическая ». Бюллетень Химического общества Франции (на французском языке). 1 :105–112.
- ^ Организация Объединенных Наций по промышленному развитию ; Международный центр разработки удобрений (1998). Руководство по удобрениям (3-е изд.). Дордрехт, Нидерланды: Kluwer Academic. ISBN 978-0-7923-5032-3 .
- ^ «Супер К (Сульфат калия)» . Американская подготовка поверхности. Архивировано из оригинала 9 декабря 2014 года . Проверено 7 декабря 2014 г.