Калия бисульфат
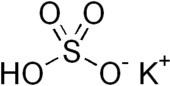 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гидросульфат калия | |
| Другие имена Калия кислый сернокислый | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.028.722 |
| Номер ЕС |
|
| номер Е | E515(ii) (регуляторы кислотности, ...) |
ПабХим CID | |
| номер РТЭКС |
|
| НЕКОТОРЫЙ | |
| Число | 2509 |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| ХСО 4 | |
| Молярная масса | 136.169 g/mol |
| Появление | бесцветное твердое вещество |
| Запах | без запаха |
| Плотность | 2,245 г/см 3 |
| Температура плавления | 197 ° С (387 ° F; 470 К) |
| Точка кипения | 300 ° C (572 ° F; 573 К) (разлагается с образованием пиросульфата калия и воды) |
| 36,6 г/100 мл (0 °С) 49 г/100 мл (20 °С) 121,6 г/100 мл (100 °С) | |
| Растворимость | растворим в ацетоне , этаноле . |
| −49.8·10 −6 см 3 /моль | |
| Термохимия | |
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -1163,3 кДж/моль |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х314 , Х335 | |
| P260 , P261 , P264 , P271 , P280 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P310 , P312 , P321 , P363 , P403+P233 , П405 , П501 | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 2340 мг*кг −1 |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
| Родственные соединения | |
Родственные соединения | Сульфат калия Бисульфат натрия |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гидросульфат калия ( бисульфат калия ) — неорганическое соединение с химической формулой KHSO 4 и представляет собой калиевую соль серной кислоты . Это белое водорастворимое твердое вещество.
Подготовка
[ редактировать ]было произведено более 1 миллиона тонн В 1985 году на начальном этапе Мангеймского процесса производства сульфата калия . Соответствующим превращением является экзотермическая реакция хлорида калия и серной кислоты: [1] [2]
- KCl + H 2 SO 4 → HCl + KHSO 4
Бисульфат калия является побочным продуктом при производстве азотной кислоты из нитрата калия и серной кислоты: [3]
- KNO 3 + H 2 SO 4 → KHSO 4 + HNO 3
Химические свойства
[ редактировать ]При термическом разложении бисульфата калия образуется пиросульфат калия : [1]
- 2 KHSO 4 → K 2 S 2 O 7 + H 2 O
При температуре выше 600 °C пиросульфат калия превращается в сульфат калия и триоксид серы : [4]
- К 2 С 2 О 7 → К 2 ТАК 4 + ТАК 3
Использование
[ редактировать ]Бисульфат калия обычно используется для приготовления битартрата калия для виноделия . [5] Бисульфат калия также используется в качестве разрыхлителя в аналитической химии или в качестве прекурсора для получения персульфата калия — мощного окислителя . [6]
Возникновение
[ редактировать ]Меркаллит , минералогическая форма бисульфата калия, встречается очень редко. [7] Мизенит – еще одна более сложная форма бисульфата калия с формулой K 8 H 6 (SO 4 ) 7 .
Ссылки
[ редактировать ]- ^ Перейти обратно: а б Вашингтон Уайли, Харви (1895). Принципы и практика сельскохозяйственного анализа: удобрения . Истон, Пенсильвания: Chemical Publishing Co., с. 218 . Проверено 31 декабря 2015 г.
Дисульфат калия.
- ^ Х. Шульц; Г. Бауэр; Э. Шахль; Ф. Хагедорн; П. Шмиттингер (2005). «Соединения калия». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. дои : 10.1002/14356007.a22_039 . ISBN 978-3-527-30673-2 .
- ^ Прадьот, Патнаик (2003). Справочник неорганических химикатов . Нью-Йорк: МакГроу-Хилл. п. 636. ИСБН 978-0-07-049439-8 .
- ^ Иределл Диллард Хиндс, Джон (1908). Неорганическая химия: с элементами физической и теоретической химии . Нью-Йорк: Джон Уайли и сыновья. п. 547 . Проверено 31 декабря 2015 г.
Дисульфат калия.
- ^ Вайсблатт, Джейн; Монтни, Чарльз Б. (2006). Химические соединения . ISBN 978-1-4144-0453-0 .
- ^ Брауэр, Георг (1963). Справочник по препаративной неорганической химии Том. 1, 2-е изд . Нью-Йорк: Академическая пресса. п. 392. ИСБН 978-0-12-126601-1 .
- ^ «Меркаллит: Информация о минералах, данные и местонахождение» . Mindat.org . Проверено 8 мая 2019 г.