Тетрафторид серы
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фторид серы(IV) | |||
| Другие имена Тетрафторид серы | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ЧЭБИ | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.029.103 | ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 2418 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| СФ 4 | |||
| Молярная масса | 108.07 g/mol | ||
| Появление | бесцветный газ | ||
| Плотность | 1,95 г/см 3 , −78 °С | ||
| Температура плавления | −121,0 °С | ||
| Точка кипения | −38 °С | ||
| реагирует | |||
| Давление пара | 10,5 атм (22 °С) [1] | ||
| Структура | |||
| Качели ( C 2 v ) | |||
| 0,632 Д [2] | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | высокореактивный и токсичный газ | ||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | никто [1] | ||
РЕЛ (рекомендуется) | C 0,1 ppm (0,4 мг/м 3 ) [1] | ||
IDLH (Непосредственная опасность) | без даты [1] | ||
| Паспорт безопасности (SDS) | КМГС 1456 | ||
| Родственные соединения | |||
Другие анионы | Дихлорид серы дисульфура дибромид Трифторид серы | ||
Другие катионы | Дифторид кислорода Тетрафторид селена Тетрафторид теллура | ||
Родственные фториды серы | дифторид дисульфура Дифторид серы Декафторид дисеры Гексафторид серы | ||
Родственные соединения | Тионил фторид | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
Тетрафторид серы собой химическое соединение формулы SF представляет 4 . Это бесцветный агрессивный газ, который выделяет опасный фтористый водород при контакте с водой или влагой. Тетрафторид серы — полезный реагент для получения фторорганических соединений . [3] некоторые из них важны для фармацевтической и специальной химической промышленности.
Структура
[ редактировать ]Сера в SF 4 находится в степени окисления +4 с одной неподеленной парой электронов. Атомы SF 4 расположены в форме качелей с атомом серы в центре. Одну из трех экваториальных позиций занимает несвязывающая неподеленная пара электронов. Следовательно, молекула имеет два различных типа F-лигандов: два аксиальных и два экваториальных. Соответствующие расстояния связи составляют S – F ax = 164,3 пм и S – F eq = 154,2 пм. молекулах аксиальные лиганды обычно В гипервалентных связаны менее прочно.
The 19 F Спектр ЯМР SF 4 обнаруживает только один сигнал, который указывает на то, что аксиальные и экваториальные положения атома F быстро взаимопревращаются посредством псевдовращения . [4]

Синтез и производство
[ редактировать ]В лабораторных масштабах тетрафторид серы получают из элементарной серы и фторида кобальта. [5]
- С + 4КоФ 3 → СФ 4 + 4КоФ 2
SF 4 промышленно производится реакцией SCl 2 и NaF с ацетонитрилом в качестве катализатора. [6]
- 3 SCl 2 + 4 NaF → SF 4 + S 2 Cl 2 + 4 NaCl
При более высоких температурах (например, 225–450 °C) растворитель излишен. Кроме того, дихлорид серы можно заменить элементарной серой (S) и хлором (Cl 2 ) . [7] [8]
В низкотемпературной (например, 20–86 °C) альтернативе описанному выше процессу хлорирования используется жидкий бром (Br 2 ) в качестве окислителя и растворителя: [9]
- S(т) + 2 Br 2 (л; избыток) + 4KF(т) → SF 4 ↑ + 4 KBr(бром)
Использование в синтезе фторорганических соединений.
[ редактировать ]В органическом синтезе SF 4 используется для превращения групп COH и C=O в CF и CF 2 соответственно. группы [10] Эффективность этих преобразований сильно варьируется.
В лаборатории использование SF 4 было заменено более безопасным и простым в обращении трифторидом диэтиламиносеры (C 2 H 5 ) 2 NSF 3 , «DAST»: [11] Этот реагент готовят из SF 4 : [12]
- SF 4 + (CH 3 ) 3 SiN(C 2 H 5 ) 2 → (C 2 H 5 ) 2 NSF 3 + (CH 3 ) 3 SiF
Другие реакции
[ редактировать ]Пентафторид хлорида серы ( SF
5 Cl ), полезный источник группы SF 5 , получают из SF 4 . [13]
- SF 4 + Cl 2 + CsF → SF 5 Cl + CsCl
Гидролиз SF 4 дает диоксид серы : [14]
- SF4 → + 2H2O SO2 + 4HF
Эта реакция протекает при посредничестве тионилфторида , который обычно не мешает использованию SF 4 в качестве реагента. [6]
При обработке аминов SF 4 и основанием образуются дифториды аминосеры. [15]
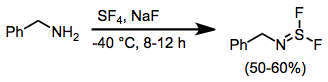
Токсичность
[ редактировать ]Сан-Франциско
4 реагирует внутри легких с влагой, образуя диоксид серы и фторид водорода , которые образуют высокотоксичную и едкую плавиковую кислоту. [16]
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Карманный справочник NIOSH по химическим опасностям. «#0580» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Толлес, ВМ; В.М. Гвинн, WD (1962). «Структура и дипольный момент SF 4 ». Дж. Хим. Физ. 36 (5): 1119–1121. Бибкод : 1962ЖЧФ..36.1119Т . дои : 10.1063/1.1732702 .
- ^ Ван, C.-LJ (2004). «Тетрафторид серы». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X . hdl : 10261/236866 . ISBN 9780471936237 .
- ^ Холлеман, А.Ф.; Виберг, Э. (2001). Неорганическая химия . Сан-Диего: Академическая пресса. ISBN 0-12-352651-5 .
- ^ Квасник, В. (1963). «Соединения фтора: Тетрафторид серы» . Брауэр, Георг (ред.). Справочник по препаративной неорганической химии . Том. 1. Перевод Райли, Рида Ф. (2-е изд.). Нью-Йорк, Нью-Йорк: Академическая пресса. п. 168. LCCN 63-14307 – через Интернет-архив.
- ^ Jump up to: а б Фосетт, Ф.С.; Таллок, CW (1963). «Фторид серы (IV)» (PDF) . Неорганические синтезы . Том. 7. С. 119–124. дои : 10.1002/9780470132388.ch33 . ISBN 978-0-470-13166-4 .
- ^ Таллок, CW; Фосетт, Ф.С.; Смит, WC; Коффман, Д.Д. (1960). «Химия тетрафторида серы. I. Синтез тетрафторида серы». Дж. Ам. хим. Соц . 82 (3): 539–542. дои : 10.1021/ja01488a011 .
- ^ US 2992073 , Таллок, CW, «Синтез тетрафторида серы», выдан в 1961 г.
- ^ Зима, RW; Кук П.В. (2010). «Упрощенный и эффективный метод получения SF 4 с использованием брома ». J. Фтор Химия. 131: 780-783. дои : 10.1016/j.jfluchem.2010.03.016
- ^ Гашек, WR (1961). «1,1,1-Трифторгептан» . Органические синтезы . 41 : 104. дои : 10.15227/orgsyn.041.0104 .
- ^ Фаук, АХ (2004). « N , N -Диэтиламиносера трифторид». В Пакетте, Л. (ред.). Энциклопедия реагентов для органического синтеза . Нью-Йорк: Дж. Уайли и сыновья. дои : 10.1002/047084289X . hdl : 10261/236866 . ISBN 9780471936237 . .
- ^ У. Дж. Миддлтон; Э. М. Бингхэм (1977). «Трифторид диэтиламиносеры» . Органические синтезы . 57 : 440. дои : 10.15227/orgsyn.057.0050 .
- ^ Найман, Ф.; Робертс, Х.Л.; Ситон, Т. (1966). «Пентафторид хлорида серы» (PDF) . Неорганические синтезы . Том. 8. МакГроу-Хилл. п. 160. дои : 10.1002/9780470132395.ch42 . ISBN 9780470132395 .
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Грюнвелл, Джон Р.; Дай, Сандра Л. (1975). «Новое поколение бензонитрил-N-сульфида». Буквы тетраэдра . 16 (21): 1739–1740. дои : 10.1016/s0040-4039(00)72247-7 . ISSN 0040-4039 .
- ^ Джонстон, Х. (2003). Мост не подвергся нападению: гражданские исследования химической войны во время Второй мировой войны . Всемирная научная. стр. 33–36. ISBN 981-238-153-8 .


