Гептафторотанталат калия
 | |
| Имена | |
|---|---|
| Название ИЮПАК Гептафторотанталат дикалия | |
| Систематическое название ИЮПАК Дикалий гептафторотантал(2-) | |
| Другие имена Potassium heptafluorotantalate(V) Калия фторотанталат | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.037.245 |
| Номер ЕС |
|
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
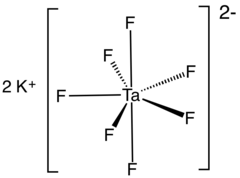
| К 2 [ТаФ 7 ] | |
| Молярная масса | 392.13 g/mol |
| Появление | белое твердое вещество |
| Плотность | 4,56 г/мл при 25 °C |
| Температура плавления | От 630 до 820 ° C (от 1166 до 1508 ° F; от 903 до 1093 К) |
0,5 г/100 мл (15 °С) [1]
| |
| Опасности | |
| СГС Маркировка : | |
  | |
| Опасность | |
| Х301 , Х315 , Х319 , Х331 , Х335 | |
| P261 , P264 , P270 , P271 , P280 , P301+P310 , P302+P352 , P304+P340 , P305+P351+P338 , P311 , P312 , P321 , P330 , P332+P313 , P337+P313 , П362 , П403+П233 , П405 , П501 | |
| Летальная доза или концентрация (LD, LC): | |
ЛД 50 ( средняя доза ) | 110 мг/кг (перорально: крыса) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Гептафторотанталат калия представляет собой неорганическое соединение формулы K 2 [TaF 7 ]. Это калиевая соль гептафторотанталат- аниона [TaF 7 ] 2− . Это белое водорастворимое твердое вещество является промежуточным продуктом при очистке тантала из его руд и предшественником металла. [2]
Подготовка
[ редактировать ]Промышленный
[ редактировать ]Гептафторотанталат калия является полупродуктом в промышленном производстве металлического тантала. Его производство включает выщелачивание танталовых руд, таких как колумбит и танталит , плавиковой и серной кислотами для получения водорастворимого гептафторотанталата водорода. [2]
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
Этот раствор подвергается ряду стадий жидкостно-жидкостной экстракции для удаления металлических примесей (особенно ниобия ) перед обработкой фторидом калия для получения K 2 [TaF 7 ].
Лабораторный масштаб
[ редактировать ]Плавиковая кислота одновременно коррозионна и токсична, что делает работу с ней непривлекательной; поэтому для мелкомасштабного синтеза был разработан ряд альтернативных процессов. Гептафторотанталат калия может быть получен как безводным, так и мокрым способами. Безводный метод включает реакцию оксида тантала с бифторидом калия или бифторидом аммония по следующему уравнению: [1] [3]
- Ta 2 O 5 + 4 KHF 2 + 6 HF → 2 K 2 [TaF 7 ] + 5 H 2 O
Первоначально метод был описан Берцелиусом . [4]
K 2 [TaF 7 ] также можно осаждать из растворов плавиковой кислоты при условии, что концентрация HF ниже примерно 42%. Растворы с более высокими концентрациями HF дают гексафторотанталат калия [KTaF 6 ]. К-соль можно также осадить из раствора плавиковой кислоте в пентахлорида тантала :
- 5 HF + 2 KF + TaCl 5 → K 2 [TaF 7 ] + 5 HCl
Структура
[ редактировать ]Гептафторотанталат калия существует по крайней мере в двух полиморфных модификациях . α-K 2 [TaF 7 ] является наиболее распространенной формой и кристаллизуется в моноклинной P 2 1 /c пространственной группе . Структура состоит из [TaF 7 ] 2− звенья, связанные между собой ионами калия. [ТаФ 7 ] 2− Многогранники можно описать как одношапочные тригональные призмы с замыкающим атомом, расположенным на одной из прямоугольных граней. Атомы калия имеют 9-координацию и могут рассматриваться как искаженные квадратные призмы с одной вершиной . По координационной сфере тяжелого металла гептафторониобат калия аналогичен соли тантала. [5]
При температуре выше 230°C он превращается в β-K 2 [TaF 7 ], который является ромбическим (пр. группа: P nma). Эта структура также состоит из ионов калия и комплексного аниона [TaF 7 ] 2− . Строение 7-координатного [TaF 7 ] 2− единицы практически не изменились. Однако атомы калия теперь существуют в двух средах, где они координируются либо с 11, либо с 8 атомами фтора. [6] [7]
Реакции
[ редактировать ]K 2 [TaF 7 в основном используется для получения металлического тантала восстановлением натрием ] . Это происходит при температуре примерно 800 °C в расплавленной соли и протекает несколькими возможными путями. [8]
K 2 [TaF 7 ] подвержен гидролизу. Например, при кипячении водного раствора K 2 [TaF 7 ] образуется оксифторотанталат калия (K 2 Ta 2 O 3 F 6 ), известный как « соль Мариньяка ». Для предотвращения гидролиза и соосаждения оксифторотанталата калия к раствору добавляют небольшой избыток HF.
Ссылки
[ редактировать ]- ^ Перейти обратно: а б В. Квасник (1963). «Гептафторотанталат калия (V)». В Г. Брауэре (ред.). Справочник по препаративной неорганической химии, 2-е изд . Том. 2 страницы = 256. Нью-Йорк, Нью-Йорк: Академическая пресса.
- ^ Перейти обратно: а б Энтони Агулянски (2004). «Химия фтора при переработке тантала и ниобия». В Анатолии Агулянском (ред.). Химия соединений фторидов тантала и ниобия (1-е изд.). Берлингтон: Эльзевир. ISBN 9780080529028 .
- ^ Агулянский, А. «Фторотанталат калия в твердом, растворенном и расплавленном состояниях» J. Fluorine Chemistry 2003, 155-161. два : 10.1016/S0022-1139(03)00190-8
- ^ Дж. Дж. Берцелиус Погг. Энн. 4, 6 (1825#.
- ^ Торарди, CC; Брикснер, Л.Х.; Бласс, Г. (1987). «Структура и люминесценция K 2 TaF 7 и K 2 NbF 7 ». Журнал химии твердого тела . 67 (1): 21–25. дои : 10.1016/0022-459687)90333-1 .
- ^ Лангер, В. Смрчок, Л. Боча, М. «Гептафторотанталат дикалия#V#, β-K 2 TaF 7 , при 509 К» Acta Crystallographica Раздел E 2006, E62, i91-i93. дои : 10.1107/S1600536806009147
- ^ Смрчок, Любомир; Брунелли, Микела; Боча, Мирослав; Кучарик, Мариан (8 апреля 2008 г.). «Структура K 2 TaF 7 при 993 К: комбинированное использование данных синхротронного порошка и твердотельных расчетов методом DFT». Журнал прикладной кристаллографии . 41 (3): 634–636. дои : 10.1107/S0021889808005876 .
- ^ Окабе, Тору Х.; Садовей, Дональд Р. (1998). «Металлотермическое восстановление как электронно-опосредованная реакция». Журнал исследования материалов . 13 (12): 3372–3377. Бибкод : 1998JMatR..13.3372O . дои : 10.1557/JMR.1998.0459 .