Трифторид мышьяка
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Мышьяк(III) фторид | |||
| Другие имена Трифторид мышьяка, трифторарсан, TL-156 | |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.029.145 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| AsFAsF3 | |||
| Молярная масса | 131.9168 g/mol | ||
| Появление | бесцветная маслянистая жидкость | ||
| Плотность | 2,666 г/см 3 (0 °С) [1] | ||
| Температура плавления | -8,5 ° C (16,7 ° F; 264,6 К) | ||
| Точка кипения | 60,4 ° C (140,7 ° F; 333,5 К) | ||
| разлагается | |||
| Растворимость | растворим в спирте , эфире , бензоле и аммиака. растворе | ||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Токсичный, коррозионный | ||
| СГС Маркировка : | |||
 | |||
| Опасность | |||
| Х301 , Х311 , Х331 | |||
| P261 , P264 , P270 , P271 , P280 , P301+P310 , P302+P352 , P304+P340 , P311 , P312 , P321 , P322 , P330 , P361 , P363 , P403+P233 , P405 , P 501 | |||
| NIOSH (пределы воздействия на здоровье в США): | |||
ПЭЛ (допустимо) | [1910.1018] СВВ 0,010 мг/м 3 [2] | ||
РЕЛ (рекомендуется) | Са С 0,002 мг/м 3 [15 минут] [2] | ||
IDLH (Непосредственная опасность) | Са [5 мг/м 3 (как как)] [2] | ||
| Термохимия | |||
Стандартная энтальпия образование (Δ f H ⦵ 298 ) | -821,3 кДж/моль | ||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
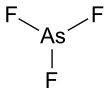
Трифторид мышьяка представляет собой соединение мышьяка 3 и фтора с химической формулой AsF химическое . Это бесцветная жидкость, легко реагирующая с водой. [3]
Приготовление и свойства
[ редактировать ]Его можно получить реакцией фтористого водорода HF с триоксидом мышьяка : [3]
- 6HF + As 2 O 3 → 2AsF 3 + 3H 2 O
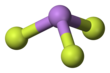
Он имеет пирамидальную молекулярную структуру в газовой фазе, которая также присутствует в твердом состоянии. [3] В газовой фазе длина связи As-F составляет 170,6 пм, а валентный угол F-As-F 96,2°. [4]
Трифторид мышьяка применяется в качестве фторирующего агента для превращения хлоридов неметаллов во фториды, в этом отношении он менее реакционноспособен, чем SbF 3 . [3]
Соли, содержащие AsF 4 − анион можно получить, например, CsAsF 4 . [5] калиевая соль KAs 2 F 7, полученная из KF и AsF 3, содержит AsF 4 − и молекулы AsF 3 с признаками взаимодействия молекулы AsF 3 с анионом. [6]
AsF 3 реагирует с SbF 5 . Полученный продукт можно охарактеризовать как ионное соединение AsF 2 + СбФ 6 − . Однако авторы приходят к выводу, что образовавшийся продукт нельзя рассматривать ни только как ионное соединение, ни целиком как нейтральный аддукт AsF 3 SbF 5 . Кристаллическая структура демонстрирует характеристики как ионной пары, так и нейтрального аддукта, занимая золотую середину между обеими моделями. [7]
Ссылки
[ редактировать ]- ^ Прадьот Патнаик. Справочник неорганических химикатов . МакГроу-Хилл, 2002 г., ISBN 0-07-049439-8
- ^ Jump up to: а б с Карманный справочник NIOSH по химическим опасностям. «#0038» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Jump up to: а б с д Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8 .
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия, 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ Новые тетрафторарсенаты (III) щелочных металлов и тетраметиламмония, их колебательные спектры и кристаллическая структура тетрафторарсената цезия (III) Клампфер П., Бенкич П., Лесар А., Волавшек Б., Пониквар М., Йесих А., Сборник. Чешский. хим. Коммун. 2004, 69, 339-350 два : 10.1135/cccc20040339
- ^ Гептафтордиарсенаты щелочных металлов (III): их получение и кристаллическая структура калиевой соли, Эдвардс А.Дж., Патель С.Н., J. Chem. Soc., Dalton Trans., 1980, 1630-1632, дои : 10.1039/DT9800001630
- ^ Кристаллические структуры фторида. Часть XV. Трифторид мышьяка-пентафторид сурьмы, Edwards AJ, Sills RJCJ Chem. Соц. А, 1971, 942 – 945, дои : 10.1039/J19710000942