Карбонилфторид
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название ИЮПАК Карбонилдифторид | |||
Другие имена
| |||
| Идентификаторы | |||
3D model ( JSmol ) | |||
| ХимическийПаук | |||
| Информационная карта ECHA | 100.005.941 | ||
| Номер ЕС |
| ||
ПабХим CID | |||
| номер РТЭКС |
| ||
| НЕКОТОРЫЙ | |||
| Число | 2417 | ||
Панель управления CompTox ( EPA ) | |||
| Характеристики | |||
| КОФ 2 | |||
| Молярная масса | 66.007 g·mol −1 | ||
| Появление | Бесцветный газ | ||
| Запах | Острый и очень раздражающий [1] | ||
| Плотность | 2,698 г/л (газ), 1,139 г/см 3 (жидкость при температуре плавления) | ||
| Температура плавления | -111,26 ° C (-168,27 ° F; 161,89 К) | ||
| Точка кипения | -84,57 ° C (-120,23 ° F; 188,58 К) | ||
| Реагирует [2] | |||
| Давление пара | 55,4 атм (20°С) [2] | ||
| Структура | |||
| С 2 в | |||
| 0,95 Д | |||
| Опасности | |||
| Безопасность и гигиена труда (OHS/OSH): | |||
Основные опасности | Очень токсичен, реагирует с водой с выделением HF. | ||
| СГС Маркировка : | |||
    | |||
| Опасность | |||
| Х280 , Х290 , Х314 , Х330 , Х331 , Х370 | |||
| P234 , P260 , P261 , P264 , P270 , P271 , P280 , P284 , P301+P330+P331 , P303+P361+P353 , P304+P340 , P305+P351+P338 , P307+P311 , P310 , П311 , П320 , П321 , P363 , P390 , P403+P233 , P404 , P405 , P410+P403 , P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Невоспламеняющийся | ||
| NIOSH (пределы воздействия на здоровье в США): | |||
МЕХ (Допускается) | никто [2] | ||
РЕЛ (рекомендуется) | TWA 2 ppm (5 мг/м 3 ) ST 5 ppm (15 мг/м 3 ) [2] | ||
IDLH (Непосредственная опасность) | без даты [2] | ||
| Родственные соединения | |||
Родственные соединения | |||
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |||
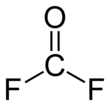
Карбонилфторид — химическое формулы соединение КО Ф 2 . Это оксогалогенид углерода . Этот газ, как и его аналог фосген , бесцветен и очень токсичен. Молекула плоская , имеет C2v 1,174 Å (C=O) и симметрию , длины связей 1,312 Å (C–F) и валентный угол F–C–F 108,0°. [3]
Приготовление и свойства
[ редактировать ]Карбонилфторид обычно получают как продукт разложения фторированных углеводородов при их термическом разложении, например, из трифторметанола или тетрафторметана в присутствии воды:
- CF 4 + H 2 O → COF 2 + 2 HF
Карбонилфторид также можно получить реакцией фосгена с фтористым водородом и фторированием монооксида углерода , хотя последнее имеет тенденцию приводить к чрезмерному фторированию до тетрафторида углерода . Фторирование угарного газа дифторидом серебра удобно:
- CO + 2 AgF 2 → COF 2 + 2 AgF
Карбонилфторид нестабилен в присутствии воды, гидролизуясь до углекислого газа и фтороводорода : [4]
- COF 2 + H 2 O → CO 2 + 2 HF
Безопасность
[ редактировать ]Карбонилфторид очень токсичен, рекомендуемый предел воздействия составляет 2 ppm при средневзвешенном значении за 8 часов и 5 ppm при кратковременном (в среднем за 15 минут) воздействии, где 1 ppm = 2,70 мг карбонилфторида на 1 м2. 3 воздуха. [1]
Ссылки
[ редактировать ]- ^ Jump up to: а б «Карбонилфторид» . Карманный справочник NIOSH по химическим опасностям . Центры CDC по контролю и профилактике заболеваний . Проверено 10 сентября 2013 г.
- ^ Jump up to: а б с д и Карманный справочник NIOSH по химическим опасностям. «#0108» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . стр. 304–305. ISBN 978-0-08-037941-8 .
- ^ М.В. Фарлоу; ЭХ Человек; К.В. Таллок (1960). «Карбонилфторид». Неорганические синтезы . Неорганические синтезы. Том. 6. С. 155–158. дои : 10.1002/9780470132371.ch48 . ISBN 9780470132371 .