Фторирование тетрафторидом серы
Фторирование тетрафторидом серы дает фторорганические соединения из кислородсодержащих органических функциональных групп с использованием тетрафторида серы . Реакция имеет широкую область применения, а SF 4 является недорогим реагентом. Однако это опасный газ, для обращения с которым требуется специальное оборудование. [ 1 ] [ 2 ] Таким образом, для многих лабораторных фторирований трифторид диэтиламиносеры («ДАСТ»). вместо этого используется [ 3 ]
Преобразования основных функциональных групп
[ редактировать ]Карбоновые кислоты, амиды, сложные эфиры и соли карбоксилатов превращаются в трифторметильные производные, хотя условия сильно различаются:
- СФ 4 + RCO 2 H → SO 2 + RCF 3 + HF
Для карбоновых кислот на первом этапе образуются ацилфториды, что соответствует склонности SF 4 фторировать кислотные гидроксильные группы:
- СФ 4 + RCO 2 H → SOF 2 + RC(O)F + HF
Аналогичным образом SF 4 превращает сульфоновые кислоты в сульфонилфториды :
- СФ 4 + РСО 3 Ч → СФ 2 + РСО 2 Ф + ВЧ
Альдегиды и кетоны превращаются в геминальные дифториды:
- СФ 4 + Р 2 СО → СФ 2 О + Р 2 CF 2
Спирты превращаются в алкилфториды, хотя лучше всего это преобразование происходит с кислыми спиртами, такими как фторированные спирты: [ 4 ]
- SF 4 + R 3 COH → SF 2 O + R 3 CF + HF
Механизм
[ редактировать ]механизм фторирования SF 4 Предполагается, что аналогичен хлорированию пентахлоридом фосфора . [ 1 ] Фтороводород , полезный растворитель для этих реакций, активирует SF 4 :
- СФ 4 + ВФ ⇌ СФ + 3 + ВФ − 2
Виды типа ROSF 3 часто называют промежуточными. Считается, что в случае альдегидов и кетонов SF4 первоначально присоединяется по двойной связи с образованием R2CFOSF 3 . [ 4 ]
Примеры
[ редактировать ]Раствор тетрафторида серы во фтороводороде превращает гидроксисодержащие аминокислоты во фтораминокислоты: [ 5 ]

При соединении вицинальных диолов с SF 4 происходит дифторирование с инверсией конфигурации только у одного из спиртов. Это было продемонстрировано при синтезе мезо -дифторсукцината из (L)-тартрата и синтезе (D)- и (L)-дифторсукцината из мезо -тартрата. [ 6 ]

Карбонильные соединения обычно реагируют с SF 4 с образованием геминальных дифторидов. Время реакции обычно составляет порядка нескольких часов, а выходы умеренные. [ 7 ] Фторирование лактонов может привести к образованию гетероциклических фторидов, хотя раскрытие кольца наблюдалось для γ-бутиролактона. Шестичленный лактид не подвергается раскрытию кольца. [ 8 ]

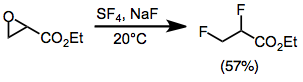
Фторирование открывает эпоксиды с образованием в большинстве случаев геминальных или вицинальных дифторидов. Моноарилэпоксиды дают геминальные продукты с миграцией арильной группы. Выходы пространственно затрудненных ди- и тризамещенных эпоксидов низкие. Эпоксиды, замещенные сложноэфирной группой, дают вицинальные дифториды через промежуточное соединение трифторида алкоксисеры. [ 9 ]
Карбоновые кислоты реагируют с SF 4 с образованием трифторметильных соединений: [ 10 ]
- C 6 H 13 CO 2 H + 2 SF 4 → C 6 H 13 CF 3 + 2 SOF 2 + HF
Образование трифторметильного производного иногда конкурирует с образованием тетрафторалкиловых эфиров, образующихся в результате реакции дифторметильного катиона с ацилфторидом. [ 11 ] [ 12 ]
Тетрафторид серы можно использовать для эффективного фторирования полимеров. Это часто оказывает глубокое влияние на свойства полимеров: например, фторирование поливинилового спирта повышает его устойчивость к сильным кислотам и основаниям. [ 13 ]
Простагландин, несущий трифторметильную группу при С-16, получают с использованием тетрафторида серы. [ 14 ]

Сопутствующие реагенты
[ редактировать ]Для мелкомасштабных реакций SF 4 может оказаться неудобным, поскольку это газ и требуются реакционные сосуды из нержавеющей стали. Многие превращения требуют повышенных температур. В результате реакции образуется фтористый водород . Эти опасения привели к интересу к альтернативным фторирующим реагентам. [ 1 ] Тетрафторид селена , жидкость при комнатной температуре, ведет себя аналогично SF 4 . Трифторид диэтиламиносеры (DAST) представляет собой производное SF 4 , с которым легче обращаться, хотя и он дороже. [ 3 ]
Ссылки
[ редактировать ]- ^ Jump up to: а б с Смит, Майкл Б.; Марч, Джерри (2007), Продвинутая органическая химия: реакции, механизмы и структура (6-е изд.), Нью-Йорк: Wiley-Interscience, стр. 1299, ISBN 978-0-471-72091-1
- ^ Ван, Чиа-Лин Дж. (1985). «Фторирование тетрафторидом серы». Органические реакции . стр. 319–400. дои : 10.1002/0471264180.или034.02 . ISBN 978-0-471-26418-7 .
- ^ Jump up to: а б Фаук, Абдул Х.; Сингх, Раджендра П.; Мешри, Даял Т. (2006). «Диэтиламиносульфуртрифторид». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rd175.pub2 . ISBN 0-471-93623-5 .
- ^ Jump up to: а б Босуэлл, Джорджия; Рипка, туалет; Скрибнер, Р.М.; Таллок, CW (2011). «Фторирование тетрафторидом серы». Органические реакции . стр. 1–124. дои : 10.1002/0471264180.или 021.01 . ISBN 978-0-471-26418-7 .
- ^ Коллонич, Дж.; Марбург, С.; Перкинс, Лерой (1975). «Селективное фторирование гидроксиаминов и гидроксиаминокислот тетрафторидом серы в жидком фтористом водороде». Журнал органической химии . 40 (25): 3808–3809. дои : 10.1021/jo00913a900 .
- ^ Белл, М.; Хадлики, M.J. Fluorine Chem. 1980 , 15 , 191.
- ^ Моббс, HJ Fluorine Chem. 1971 , 1 , 361.
- ^ Muratov, N.; Burmakov, I.; Kunshenko, V.; Alekseeva, A.; Yagupol'skii, M. J. Org. Chem. USSR (Engl. Transl.) 1982 , 18 , 1220.
- ^ Yagupol'skii, M.; Golikov, I.; Alekseeva, A.; Aleksandrov, M. J. Org. Chem. USSR (Engl. Transl.) 1971 , 7 , 737.
- ^ Гашек, WR (1961). «1,1,1-Трифторгептан». Органические синтезы . 41 : 104. дои : 10.15227/orgsyn.041.0104 .
- ^ Дмовский, В.; Колинский, А. Роч. хим. 1974 , 48 , 1697.
- ^ Дмовский, В.; Колинский, А. Пол. Дж. Хим. 1978 , 52 , 547.
- ^ Bezsolitsen, P.; Gorbunov, N.; Nazarov, A.; Khardin, P. Vysokomol. Soedin., Ser. A 1972 , 14 , 950 [C.A., 77, 75710e (1972)].
- ^ Голландия, GW; Джерноу, Дж.Л.; Розен, PUS Pat. 4256911 (1981) [CA, 89, 146500x (1978)].