Молекулярная геометрия качелей
| Молекулярная геометрия качелей | |
|---|---|
 | |
| Примеры | СФ 4 |
| Группа точек | С 2В |
| Координационный номер | 4 |
| Угол(а) связи | Идеальный топор-экв 180°, экв-экв 120°, топор-экв 90° SF 4 ось-ось 173,1°, экв-экв 101,6° |
| μ (полярность) | >0 |
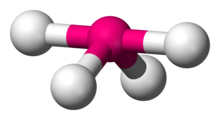
Дисфеноидальный или качели (также известный как козла [1] ) — тип молекулярной геометрии , в котором имеется четыре связи с центральным атомом с общей C2v молекулярной симметрией . Название «качели» происходит от наблюдения, что они похожи на качели на детской площадке . Чаще всего четыре связи с центральным атомом приводят к тетраэдрической или, реже, плоско-квадратной геометрии .
Геометрия качелей возникает, когда молекула имеет стерическое число 5, при этом центральный атом связан с 4 другими атомами и 1 неподеленной парой (AX 4 E 1 в обозначении AX ). Атом, связанный с пятью другими атомами (и не имеющими неподеленных пар), образует тригональную бипирамиду с двумя осевыми и тремя экваториальными положениями, но в геометрии качелей один из атомов заменяется неподеленной парой электронов, которая всегда находится в экваториальном положении. . Это верно, поскольку неподеленная пара занимает больше места возле центрального атома (А), чем связывающая пара электронов. Экваториальная неподеленная пара отталкивается только двумя парами связей под углом 90°, тогда как гипотетическая аксиальная неподеленная пара будет отталкиваться тремя парами связей под углом 90°, что сделает ее стабильной. Отталкивание связывающих пар под углом 120° гораздо меньше и менее важно. [2] [1]
Структура
[ редактировать ]Соединения с дисфеноидальной (качелиной) геометрией имеют два типа лигандов : аксиальные и экваториальные. Осевая пара лежит вдоль общей оси связи и связана валентным углом 180°. Экваториальная пара лигандов расположена в плоскости, ортогональной оси аксиальной пары. Обычно расстояние связи с аксиальными лигандами больше, чем с экваториальными лигандами. Идеальный угол между аксиальными лигандами и экваториальными лигандами составляет 90°; тогда как идеальный угол между самими двумя экваториальными лигандами составляет 120 °.
Дисфеноидальные молекулы, как и тригонально-бипирамидальные, подвержены псевдовращению Берри , при котором аксиальные лиганды перемещаются в экваториальные положения и наоборот. Этот обмен позициями приводит к созданию одинаковой усредненной по времени среды для двух типов лигандов. Таким образом, 19 Спектр ЯМР F SF 4 (как и у PF 5 ) состоит из одиночного резонанса вблизи комнатной температуры. [3] Четыре движущихся атома действуют как рычаг вокруг центрального атома; например, четыре атома фтора тетрафторида серы вращаются вокруг атома серы. [4]
Примеры
[ редактировать ]Тетрафторид серы является ярким примером молекулы с дисфеноидальной молекулярной геометрией (см. изображение вверху справа). Следующие соединения и ионы имеют дисфеноидальную геометрию: [5]
- СФ 4
- СеФ 4
- ЕСЛИ
22О −
2 - ИОФ 3
- КФ +
4 - ТЭФ 4
- КсеО 2 F 2
- СЦл 4
- АсФ −
4
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Перейти обратно: а б Шилдс, Шон П. «Геометрия тригональной бипирамиды (SN = 5) (VSEPR, часть 4)» (PDF) . Химия . Проверено 3 апреля 2022 г.
SN = 5 с одной одинокой парой. Молекулярная форма: козла или качели.
- ^ Мисслер, Гэри Л.; Тарр, Дональд А. (1999). Неорганическая химия (2-е изд.). Прентис-Холл. стр. 58–59. ISBN 0-13-841891-8 .
- ^ Клемперер, Уолтер Г.; Кригер, Жанна К.; МакКрири, Майкл Д.; Муэттертис, Эль; Трафиканте, Дэниел Д.; Уайтсайдс, Джордж М. (1975). «Исследование обмена фтора в жидком тетрафториде серы методом динамического ядерного магнитного резонанса». Дж. Ам. хим. Соц . 97 (24): 7023–7030. дои : 10.1021/ja00857a012 .
- ^ Касс, Мэрион Э.; Привет, король Куок (Мими); Рзепа, Генри С. (1 февраля 2006 г.). «Механизмы, которые обменивают осевые и экваториальные атомы местами в флюксионных процессах: иллюстрация псевдовращения Берри, турникета и рычажных механизмов посредством анимации нормальных колебательных режимов переходного состояния» . Журнал химического образования . 83 (2): 336. Бибкод : 2006JChEd..83..336C . дои : 10.1021/ed083p336.2 .
Рукопись представлена в Журнал химического образования 21 апреля 2005 г.
- ↑ Seesaw Molecular Geometry, AX4E1, 25 декабря 2007 г. Архивировано 3 ноября 2014 г., в Wayback Machine.