Оксид кюрия(IV)
 | |
| Имена | |
|---|---|
| Другие имена Диоксид кюрия | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.031.453 |
| Номер ЕС |
|
ПабХим CID |
|
| Характеристики | |
| См О 2 | |
| Молярная масса | 279 g·mol −1 |
| Появление | черные кристаллы |
| нерастворимый | |
| Родственные соединения | |
Другие катионы | Оксид америция(IV) Оксид берклия(IV) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Оксид кюрия(IV) представляет собой неорганическое химическое соединение кюрия и кислорода химической формулы СмО 2 . Поскольку все изотопы кюрия созданы человеком, это соединение не встречается в природе.
Синтез
[ редактировать ]- Оксид кюрия(IV) можно получить непосредственно из элементов. Металлический кюрий отжигают на воздухе или в атмосфере кислорода: [1]
- См + О 2 → CmO 2
- гидроксид кюрия (III) и оксалат кюрия (III): Для этой цели также обычно используются
- Cm(OH) 4 → CmO 2 + 2H 2 O
- Cm(C 2 O 4 ) 2 → CmO 2 + 2CO 2 + 2CO
- Другой путь — реакция оксида кюрия(III) в атмосфере кислорода при 650 °С: [2]
- 2Cm2O3 O3 + O2 → 4CmO2
Физические свойства
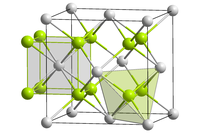
[ редактировать ]Оксид кюрия(IV) образует черные кристаллы. [3] Нерастворим в воде. Кристаллы соединения имеют кубическую кристаллическую систему , структуру флюорита в пространственной группе Fm 3 m .
Химические свойства
[ редактировать ]Соединение реагирует с минеральными кислотами с образованием растворов солей кюрия(III). [4]
Использование
[ редактировать ]Соединение используется для изготовления изотопных источников тока, а также в качестве мишеней для синтеза транскуриевых элементов.
Ссылки
[ редактировать ]- ^ Эспри, LB; Эллингер, Ф.Х.; Фрид, С.; Захариасен, WH (март 1955 г.). «ДОКАЗАТЕЛЬСТВА ЧЕТЫРЕХВАЛЕНТНОГО КЮРИЯ: РЕНТГЕНОВСКИЕ ДАННЫЕ ПО ОКСИДАМ КУРИЯ 1 Американского Журнал химического общества . 77 (6): 1707–1708. doi : 10.1021/ja01611a108 . ISSN 0002-7863 . Проверено 29 июня 2023 г.
- ^ Ноэ, М.; Фугер, Дж. (1 мая 1971 г.). «Влияние самоизлучения на параметр решетки 244CmO2» . Письма по неорганической и ядерной химии . 7 (5): 421–430. дои : 10.1016/0020-1650(71)80177-0 . ISSN 0020-1650 . Проверено 29 июня 2023 г.
- ^ Конингс, RJM (1 октября 2001 г.). «Термохимические и теплофизические свойства кюрия и его оксидов» . Журнал ядерных материалов . 298 (3): 255–268. Бибкод : 2001JNuM..298..255K . дои : 10.1016/S0022-3115(01)00652-3 . ISSN 0022-3115 . Проверено 29 июня 2023 г.
- ^ Люметта, Грегг Дж.; Томпсон, майор К.; Пеннеман, Роберт А.; Эллер, П. Гэри (2006). «Курий» . Химия актинидных и трансактинидных элементов . Спрингер Нидерланды: 1397–1443 гг. дои : 10.1007/1-4020-3598-5_9 . ISBN 978-1-4020-3555-5 . Проверено 29 июня 2023 г.