Оксид плутония(IV)
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Оксид плутония(IV) | |
| Систематическое название ИЮПАК Оксид плутония(4+) | |
| Другие имена Диоксид плутония | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.031.840 |
| Номер ЕС |
|
ПабХим CID | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| О 2 Пу | |
| Молярная масса | 276 g·mol −1 |
| Появление | Темно-желтые кристаллы |
| Плотность | 11,5 г см −3 |
| Температура плавления | 2744 ° C (4971 ° F; 3017 К) |
| Точка кипения | 2800 ° C (5070 ° F; 3070 К) |
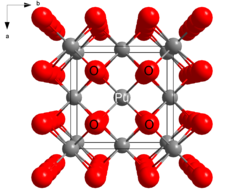
| Структура | |
| Флюорит (кубический), cF12 | |
| Фм 3 м, №225 | |
а = 17:39,5 [1] | |
| Тетраэдрический (О 2− ); кубический (Pu IV ) | |
| Опасности | |
| Безопасность и гигиена труда (OHS/OSH): | |
Основные опасности | Радиоактивный |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | негорючий |
| Родственные соединения | |
Другие катионы | Оксид урана(IV) Оксид нептуния(IV) Оксид америция(IV) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Оксид плутония(IV) , или плутония , представляет собой химическое соединение с формулой Pu O 2 . Это твердое вещество с высокой температурой плавления является основным соединением плутония . Его цвет может варьироваться от желтого до оливково-зеленого, в зависимости от размера частиц, температуры и метода производства. [2]
Структура
[ редактировать ]PuO 2 кристаллизуется во флюоритовом мотиве, при этом Pu 4+ центры организованы в гранецентрированную кубическую решетку, а ионы оксида занимают тетраэдрические дырки. [3] PuO 2 обязан своим применением в качестве ядерного топлива тому факту, что вакансии в октаэдрических отверстиях оставляют место для продуктов деления. При ядерном делении один атом плутония распадается на два. Вакансия октаэдрических отверстий обеспечивает место для нового продукта и позволяет монолиту PuO 2 сохранять структурную целостность. [ нужна ссылка ]
Характеристики
[ редактировать ]Диоксид плутония представляет собой стабильный керамический материал с чрезвычайно низкой растворимостью в воде и высокой температурой плавления (2744 °C). В 2011 году температура плавления была повышена на несколько сотен градусов на основании данных исследований быстрого лазерного плавления, которые позволяют избежать загрязнения любым материалом контейнера. [4]
Из-за радиоактивного альфа-распада плутония PuO 2 теплый на ощупь. [ нужна ссылка ] Как и все соединения плутония , он подлежит контролю в соответствии с Договором о нераспространении ядерного оружия .
Синтез
[ редактировать ]Плутоний самопроизвольно окисляется до PuO 2 в атмосфере кислорода. Диоксид плутония в основном получают путем прокаливания оксалата плутония(IV) Pu(C 2 O 4 ) 2 ·6H 2 O при 300 °C. Оксалат плутония получают при переработке ядерного топлива при растворении плутония в растворе азотной и плавиковой кислоты . [5] Диоксид плутония также можно извлечь из реакторов-размножителей с расплавленной солью путем добавления карбоната натрия к топливной соли после удаления из соли оставшегося урана в виде его гексафторида.
Приложения
[ редактировать ]
PuO 2 наряду с UO 2 используется в МОКС-топливе для ядерных реакторов . Диоксид плутония-238 используется в качестве топлива для нескольких космических кораблей дальнего космоса, таких как зонды «Кассини» , «Вояджер» , «Галилео» и «Новые горизонты», а также в марсоходах «Кьюриосити» и «Настойчивость» на Марсе . Изотоп распадается с испусканием α-частиц, которые затем выделяют тепло (см. Радиоизотопный термоэлектрический генератор ). Были опасения, что случайное возвращение в атмосферу Земли с орбиты может привести к разрушению и/или сгоранию космического корабля, что приведет к рассеянию плутония либо на большом участке поверхности планеты, либо на большом участке поверхности планеты. внутри верхних слоев атмосферы. Однако, хотя по крайней мере два космических корабля с ритэгами PuO 2 повторно вошли в атмосферу Земли и сгорели ( «Нимбус B-1» в мае 1968 года и лунный модуль «Аполлон-13» в апреле 1970 года), [6] [7] РИТЭГи обоих космических кораблей пережили вход в атмосферу и удар в целости и сохранности, и ни в одном случае не было отмечено никакого загрязнения окружающей среды; Фактически, РТГ «Нимбус» был поднят в целости и сохранности со дна Тихого океана и запущен на борт «Нимбус-3» год спустя. В любом случае, ритэги с середины 1960-х годов проектировались так, чтобы оставаться неповрежденными в случае входа в атмосферу и удара после неудачного запуска Транзита 5-БН-3 в 1964 году (находившийся на борту плутониевый ритэг раннего поколения распался при входе в атмосферу и рассеялся) . радиоактивный материал в атмосферу к северу от Мадагаскара , что привело к изменению конструкции всех американских ритэгов, которые тогда использовались или находились в стадии разработки). [8]
Физик Питер Циммерман, развивая предложение Теда Тейлора малой мощности (1 килотонна ) , продемонстрировал, что ядерное оружие можно относительно легко изготовить из диоксида плутония. [9] Такая бомба потребовала бы значительно большей критической массы, чем бомба, изготовленная из элементарного плутония (почти в три раза больше, даже при максимальной кристаллической плотности диоксида; если бы диоксид находился в форме порошка, как это часто встречается, критическая масса была бы намного выше еще), что связано как с более низкой плотностью плутония в диоксиде по сравнению с элементарным плутонием, так и с добавлением инертной массы содержащегося воздуха. [10]
Токсикология
[ редактировать ]Поведение диоксида плутония в организме зависит от способа его приема. При проглатывании большая часть его довольно быстро выводится из организма с отходами организма. [11] но небольшая часть растворяется в ионы в кислом желудочном соке и пересекает гематобарьер, откладываясь в других химических формах в других органах, например, в фагоцитирующих клетках легких, костного мозга и печени. [12]
В виде частиц диоксид плутония с размером частиц менее 10 мкм. [13] радиотоксичен при вдыхании из-за сильного альфа-излучения . [14]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Кристин Гено; Ален Шартье; Пол Фоссати; Лоран Ван Брюцель; Филипп Мартен (2020). «Термодинамические и теплофизические свойства оксидов актинидов». Комплексные ядерные материалы 2-е изд . 7 : 111–154. дои : 10.1016/B978-0-12-803581-8.11786-2 . ISBN 9780081028667 .
- ^ «Азотнокислотная переработка» . Лос-Аламосская лаборатория.
- ^ Гринвуд, Норман Н .; Эрншоу, Алан (1984). Химия элементов . Оксфорд: Пергамон Пресс . п. 1471. ИСБН 978-0-08-022057-4 .
- ^ Де Брюйкер, Ф.; Боборидис, К.; Пёмль, П.; Элоирди, Р.; Конингс, RJM; Манара, Д. (2011). «Поведение диоксида плутония при плавлении: исследование лазерного нагрева». Журнал ядерных материалов . 416 (1–2): 166–172. Бибкод : 2011JNuM..416..166D . дои : 10.1016/j.jnucmat.2010.11.030 .
- ^ Джеффри А. Каталенич Майкл Р. Хартман Роберт С. О'Брайен Стивен Д. Хоу (февраль 2013 г.). «Изготовление микросфер оксида церия и оксида урана для применения в космической ядерной энергетике» (PDF) . Proceedings of Nuclear and Emerging Technologies for Space 2013 : 2. Архивировано из оригинала (PDF) 7 октября 2016 г. Проверено 27 июля 2016 г.
- ^ А. Анджело-младший и Д. Буден (1985). Космическая ядерная энергетика . Издательство Кригер. ISBN 0-89464-000-3 .
- ^ «Общие соображения безопасности» (PDF) . Институт термоядерных технологий, Университет Висконсин-Мэдисон . Весна 2000 г. Архивировано из оригинала (конспекты лекций в формате PDF) 15 сентября 2018 г. Проверено 20 октября 2017 г.
- ^ «Транзит» . Энциклопедия космонавтики. Архивировано из оригинала 24 июня 2002 года . Проверено 7 мая 2013 г.
- ^ Майкл Сингер; Дэвид Вейр и Барбара Ньюман Кэнфилд (26 ноября 1979 г.). «Ядерный кошмар: худшие опасения Америки сбываются». Журнал Нью-Йорк.
- ^ Субаренда, Кэри. «4.1 Элементы конструкции оружия деления» . Архив ядерного оружия . 4.1.7.1.2.1 Оксид плутония . Проверено 20 октября 2017 г.
Критическая масса реакторного плутония составляет около 13,9 кг (неотражённый), или 6,1 кг (10 см природного урана) при плотности 19,4. Таким образом, порошковая прессовка с плотностью 8 будет иметь критическую массу, которая в (19,4/8)^2 раза выше: 82 кг (неотраженная) и 36 кг (отраженная), не считая веса кислорода (который добавляет еще 14 кг). %). При сжатии до кристаллической плотности эти значения уменьшаются до 40 кг и 17,5 кг.
- ↑ Комиссия по ядерному регулированию США, информационный бюллетень о плутонии (по состоянию на 29 ноября 2013 г.)
- ^ Гуолтни-Брант, Шэрон М. (1 января 2013 г.), Хашек, Ванда М.; Руссо, Колин Г.; Уоллиг, Мэтью А. (ред.), «Глава 41 - Тяжелые металлы» , Справочник Хашека и Руссо по токсикологической патологии (третье издание) , Бостон: Academic Press, стр. 1315–1347, ISBN 978-0-12-415759-0 , получено 10 апреля 2022 г.
- ↑ Всемирное ядерное общество, Плутоний. Архивировано 18 августа 2015 г. в Wayback Machine (по состоянию на 29 ноября 2013 г.).
- ^ «Токсикологический профиль плутония» (PDF) . Министерство здравоохранения и социальных служб США. 27 сентября 2007 г. Проверено 23 апреля 2009 г.
