Диэтилазодикарбоксилат

| |
| |
| Имена | |
|---|---|
| Название ИЮПАК
Диэтилдиазендикарбоксилат
| |
| Систематическое название ИЮПАК
Этил N -этоксикарбонилиминокарбамат | |
Другие имена
| |
| Идентификаторы | |
3D model ( JSmol )
|
|
| ХимическийПаук | |
| Информационная карта ECHA | 100.016.202 |
| Номер ЕС |
|
ПабХим CID
|
|
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA )
|
|
| Характеристики | |
| С 6 Н 10 Н 2 О 4 | |
| Молярная масса | 174.156 g·mol −1 |
| Появление | Жидкость от оранжевого до красного или оранжевого цвета [ 2 ] |
| Плотность | 1,11 г/см 3 [ 3 ] |
| Температура плавления | 6 ° С (43 ° F; 279 К) [ 4 ] |
| Точка кипения | 104,5 ° C (220,1 ° F; 377,6 К) при 12 мм рт. ст. [ 3 ] |
Показатель преломления ( n D )
|
1,420 (20 °С) [ 3 ] |
| Опасности | |
| СГС Маркировка : | |
 
| |
| Опасность | |
| Х240 , Х302 , Х312 , Х315 , Х319 , Х332 , Х335 | |
| P210 , P220 , P234 , P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P312 , P304+P340 , P305+P351+P338 , P312 , P321 , П330 2 , П332 , +П313 , P337+P313 , P362 , P363 , P370+P378 , P370+P380+P375 , P403+P233 , P403+P235 , P405 , P411 , P420 , P501 | |
| точка возгорания | 85 ° C (185 ° F; 358 К) [ 5 ] |
| Паспорт безопасности (SDS) | Внешний паспорт безопасности материалов |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа).
| |
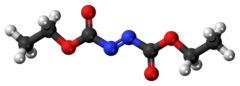
Диэтилазодикарбоксилат , условно обозначаемый как DEAD , а иногда и как DEADCAT . [ 6 ] [ 7 ] представляет собой органическое соединение со структурной формулой СН 3 СН 2 -O-C(=O)-N=N-C(=O)-O-СН 2 СН 3 . Его молекулярная структура состоит из центральной азофункциональной группы RN=NR, окруженной двумя группами этилового эфира . Эта оранжево-красная жидкость является ценным реагентом, но также весьма опасна и взрывается при нагревании. Поэтому коммерческая отправка чистого диэтилазодикарбоксилата в США запрещена и осуществляется либо в растворе, либо на полистирола частицах .
ДЭАД является азадиенофилом в и эффективным дегидрирующим агентом, превращающим спирты в альдегиды , тиолы в дисульфиды и гидразогруппы азогруппы ; это также хороший акцептор электронов. Хотя DEAD используется во многих химических реакциях, он в основном известен как ключевой компонент реакции Мицунобу , общей стратегии получения амина, азида, простого, тиоэфира или сложного эфира из соответствующего спирта. [ 8 ] Он используется в синтезе различных натуральных продуктов и фармацевтических препаратов, таких как зидовудин , лекарство от СПИДа ; FdUMP , мощный противоопухолевый агент; и прокарбазин , химиотерапевтический препарат.
Характеристики
[ редактировать ]DEAD представляет собой оранжево-красную жидкость, цвет которой при разбавлении или химической реакции становится желтым или бесцветным. Это изменение цвета обычно используют для визуального контроля синтеза. DEAD растворяется в большинстве распространенных органических растворителей, таких как толуол, хлороформ , этанол , [ 9 ] тетрагидрофуран и дихлорметан [ 3 ] [ 10 ] но имеет низкую растворимость в воде или четыреххлористом углероде ; растворимость в воде выше у родственного азосоединения диметилазодикарбоксилата . [ 4 ]
ДЭАД является сильным акцептором электронов и легко окисляет раствор йодида натрия в ледяной уксусной кислоте . Он также энергично реагирует с гидразингидратом с образованием диэтилгидразодикарбоксилата и выделением азота. Расчеты метода молекулярной орбитали линейной комбинации атомных орбиталей (LCAO-MO) предполагают, что молекула DEAD необычна тем, что имеет высоколежащую вакантную связывающую орбиталь и, следовательно, имеет тенденцию отводить атомы водорода от различных доноров водорода. Фотоассистированное удаление водорода с помощью DEAD было продемонстрировано для изопропилового спирта с образованием пинакола и тетраэтилтетразантетракарбоксилата, а также для ацетальдегида с образованием диацетила и диэтилгидразодикарбоксилата. Аналогичным образом, реакция DEAD с этанолом и циклогексанолом выделяет водород с образованием ацетальдегида и циклогексанона . Эти реакции также протекают без света, хотя и с гораздо меньшими выходами. [ 9 ] Таким образом, в целом ДЭАД является азадиенофилом и дегидрирующим агентом, превращающим спирты в альдегиды , тиолы в дисульфиды и гидразогруппы в азогруппы . [ 11 ] Он также вступает в перициклические реакции с алкенами и диенами по еновому механизму и механизму Дильса-Альдера . [ 12 ]
Подготовка
[ редактировать ]Хотя диэтилазодикарбоксилат доступен в продаже, его можно приготовить в свежем виде в лаборатории, особенно если требуется в чистой, неразбавленной форме. Двухстадийный синтез начинается с гидразина , сначала путем алкилирования этилхлорформиатом , с последующей обработкой полученного диэтилгидразодикарбоксилата хлором (барботируя через раствор), хлорноватистой кислотой концентрированной азотной кислотой или красной дымящей азотной кислотой . Реакцию проводят на ледяной бане, реагенты добавляют по каплям так, чтобы температура не поднималась выше 20 °С. Диэтилгидразодикарбоксилат представляет собой твердое вещество с температурой плавления 131–133 °C, которое собирают в виде остатка; он значительно более стабилен к нагреванию, чем DEAD, и его обычно сушат при температуре около 80 °C. [ 4 ] [ 13 ]
Приложения
[ редактировать ]Реакция Мицунобу
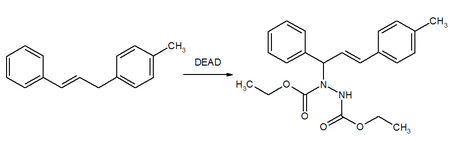
[ редактировать ]DEAD является реагентом реакции Мицунобу , где он образует аддукт с фосфинами (обычно трифенилфосфином ) и способствует синтезу сложных, простых эфиров, аминов и тиоэфиров из спиртов. Реакции обычно приводят к инверсии молекулярной симметрии.
DEAD использовался в оригинальной статье Ойо Мицунобу 1967 года : [ 14 ] а его обзор 1981 года по использованию диэтилазодикарбоксилата является самой цитируемой статьей по химии. [ 15 ] [ 16 ] Реакция Мицунобу имеет несколько применений в синтезе натуральных продуктов и фармацевтических препаратов.
В указанной выше реакции, которой способствуют либо DEAD, либо DIAD (диизопропилазодикарбоксилат), тимидин 1 превращается в производное 2 . Последний легко превращается в зидовудин 4 (также известный как азидотимидин или АЗТ), важный противовирусный препарат, используемый, среди прочего, при лечении СПИДа . [ 17 ] [ 18 ] [ 19 ] Другим примером фармацевтического применения реакции Мицунобу с помощью DEAD является синтез бис[(пивалоилокси)метила [PIVz] производного 2'-дезокси-5-фторуридин-5'-монофосфата (FdUMP), который является мощным противоопухолевым средством. [ 20 ]
Реакция Майкла
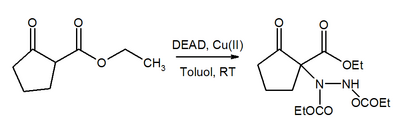
[ редактировать ]Азогруппа в DEAD является акцептором Михаила . В присутствии катализатора меди(II) ДЭАД способствует превращению β-кетоэфиров в соответствующие производные гидразина. [ 21 ]
Замещение эфиров бороновой кислоты протекает аналогично: [ 22 ]
Другие реакции
[ редактировать ]DEAD является эффективным компонентом в реакциях Дильса-Альдера и в клик-химии , например, в синтезе бицикло[2.1.0]пентана, созданного Отто Дильсом . [ 23 ] Его также использовали для получения аддуктов аза -Бейлиса-Хиллмана с акрилатами. [ 24 ]
ДЭАД может быть использован для синтеза гетероциклических соединений . Так, производные пиразолина превращаются путем конденсации в α,β-ненасыщенные кетоны : [ 25 ]
Другое применение - использование DEAD в качестве энофила в еновых реакциях:
Безопасность
[ редактировать ]DEAD токсичен, чувствителен к ударам и свету; он может сильно взорваться, когда его неразбавленная форма нагревается выше 100 ° C. [ 2 ] [ 3 ] [ 26 ] Перевозка по воздуху чистого диэтилазодикарбоксилата запрещена в США и осуществляется в растворе, обычно с концентрацией DEAD около 40% в толуоле. [ 27 ] Альтернативно, DEAD транспортируется и хранится на размером 100–300 меш частицах полистирола в концентрации около 1 ммоль /г. [ 3 ] Средневзвешенное по времени пороговое значение воздействия DEAD в течение типичной 40-часовой рабочей недели составляет 50 частей на миллион; то есть DEAD вдвое менее токсичен, чем, например, окись углерода . [ 28 ] Угрозы безопасности привели к быстрому сокращению использования DEAD и его замене на DIAD и другие подобные соединения.
Ссылки
[ редактировать ]- ^ Диэтилазодиформиат . Webbook.nist.gov (28 июля 1972 г.). Проверено 15 марта 2011 г.
- ^ Jump up to: а б Данные о безопасности (MSDS) диэтилазодикарбоксилата. Архивировано 9 декабря 2010 г. в Wayback Machine . Msds.chem.ox.ac.uk. Проверено 15 марта 2011 г.
- ^ Jump up to: а б с д и ж ВЛФ Армарего; Кристина Ли Линь Чай (22 мая 2009 г.). Очистка лабораторных химикатов . Баттерворт-Хайнеманн. стр. 124–. ISBN 978-1-85617-567-8 . Проверено 12 марта 2011 г.
- ^ Jump up to: а б с Кауэр, ООО «Диэтилазодикарбоксилат» . Органические синтезы ; Сборник томов , т. 4, с. 411 .
- ^ L19348 Диэтилазодикарбоксилат, 97% - Alfa Aesar - A Johnson Matthey Company . Альфа.com (28 июля 1972 г.). Проверено 15 марта 2011 г.
- ^ Кэролайн Купер (23 июля 2010 г.). Настольный справочник химика-органика . ЦРК Пресс. стр. 109–. ISBN 978-1-4398-1164-1 . Проверено 12 марта 2011 г.
- ^ DEAD иногда используется для обозначения другого химического вещества - диэтилацетилендикарбоксилата. П. Н. Престон (1980). Бензимидазолы и родственные им трициклические соединения . Джон Уайли и сыновья. стр. 475–. ISBN 978-0-471-08189-0 . Проверено 12 марта 2011 г.
- ^ Барбара., Чако (2009). Стратегическое применение названных реакций в органическом синтезе: предпосылки и подробные механизмы; 250 названных реакций . Эльзевир. ISBN 978-0-12-369483-6 . OCLC 634820219 .
- ^ Jump up to: а б Йонеда, Фумио; Сузуки, Кунио; Нитта, Ёсихиро (1967). «Новая реакция выделения водорода с диэтилазодикарбоксилатом». Журнал органической химии . 32 (3): 727–729. дои : 10.1021/jo01278a049 . ISSN 0022-3263 .
- ^ Келмара К. Келли (2009) Новые изотопные эффекты и механизмы органических реакций , докторская диссертация, Техасский университет A&M, стр. 81
- ^ Фумио Йонеда; Кунио Сузуки; Ёсихиро Нитта (1966). «Новая реакция удаления водорода с диэтилазодикарбоксилатом». Дж. Ам. хим. Соц . 88 (10): 2328. doi : 10.1021/ja00962a051 .
- ^ Эрик Дж. Стоунер; Эми К. Харт (2010). «Диэтилазодикарбоксилат». Энциклопедия реагентов для органического синтеза . дои : 10.1002/047084289X.rd176.pub2 . ISBN 978-0-471-93623-7 .
- ^ Рабджон, Н. (1948). «Диэтилазодикарбоксилат». Органические синтезы . 28 : 58. дои : 10.15227/orgsyn.028.0058 .
- ^ Мицунобу, О.; Ямада, Ю. (1967). «Получение эфиров карбоновой и фосфорной кислот через четвертичные фосфониевые соли». Бык. хим. Соц. Япония . 40 (10): 2380–2382. дои : 10.1246/bcsj.40.2380 .
- ^ Мицунобу, Ойо (1981). «Использование диэтилазодикарбоксилата и трифенилфосфина в синтезе и трансформации натуральных продуктов». Синтез . 1981 : 1–28. дои : 10.1055/s-1981-29317 .
- ^ Более 4300 цитирований к марту 2011 г. по данным Web of Science.
- ^ Чернецкий, Станислас и Валери, Жан-Марк «Способ получения AZT (3'-азидо-3'-дезокситимидин) и родственных соединений», патент США № 5 124 442, выданный 23 июня 1992 г.
- ^ Чернецкий, Станислав; Валери, Жан-Марк (1991). «Эффективный синтез 3'-азидо-3'-дезокситимидина (AZT)». Синтез . 1991 (3): 239. doi : 10.1055/s-1991-26434 .
- ^ Дюхольм, Ким Л.; Али, Юсеф Л.; Йоргенсен, Пер Т.; Эль-Барбари, Ахмед А.; Педерсен, Эрик Б.; Нильсен, Клаус (1993). «Конвергентный синтез 2',3'-дидезокси-3'-метилтио и 2',3'-дидезокси-3'-меркаптонуклеозидов и их дисульфидных аналогов. Потенциальные средства против ВИЧ». Monatshefte für Chemie - Ежемесячный химический журнал . 124 : 37–53. дои : 10.1007/BF00808508 . S2CID 93871095 .
- ^ Фаркуар, Дэвид; Хан, Саид; Шриваства, Девендра Н.; Сондерс, Присцилла П. (1994). «Синтез и противоопухолевая оценка бис[(пивалоилокси)метил] 2'-дезокси-5-фторуридин-5'-монофосфата (FdUMP): стратегия введения нуклеотидов в клетки». Журнал медицинской химии . 37 (23): 3902–9. дои : 10.1021/jm00049a009 . ПМИД 7966151 .
- ^ Комель, К.; и др. (2004). «Катализаторы присоединения Михаэля на основе ионной и ковалентной меди (II). Механизм». Дж. Орг. Хим . 69 (20): 6834–42. дои : 10.1021/jo049373z . ПМИД 15387609 .
- ^ Такеши Уэмура; Наото Чатани (2005). «Присоединение арилбороновых кислот к азодикарбоксилатам, катализируемое медной солью». Дж. Орг. Хим . 70 (21): 8631–8634. дои : 10.1021/jo051387x . ПМИД 16209627 .
- ^ Гассман П.Г., Мэнсфилд К.Т. (1969). «БИЦИКЛ[2.1.0]ПЕНТАН». Органические синтезы . 49 : 1. дои : 10.15227/orgsyn.049.0001 . ISSN 0078-6209 .
- ^ Ши, Мин; Чжао, Гуй-Лин (2004). «Реакции Аза-Бейлиса-Хиллмана диизопропилазодикарбоксилата или диэтилазодикарбоксилата с акрилатами и акрилонитрилом». Тетраэдр . 60 (9): 2083–2089. дои : 10.1016/j.tet.2003.12.059 .
- ^ Виджай Наир; Смита К. Мэтью; Аккатту Т. Биджу; Эрингатоди Суреш (2007). «Новая реакция «Цвиттериона Хьюсгена» с халконами и диенонами: эффективная стратегия синтеза производных пиразолина и пиразолопиридазина». Энджью. хим. Межд. Эд. 46 (12): 2070–2073. дои : 10.1002/anie.200604025 . ПМИД 17286329 .
- ^ Г. К. Барретт (1999). Производные аминокислот: практический подход . Издательство Оксфордского университета. стр. 119–. ISBN 978-0-19-855853-8 . Проверено 12 марта 2011 г.
- ^ Диэтилазодикарбоксилат в химическом синтезе . Sigmaaldrich.com. Проверено 15 марта 2011 г.
- ^ Ливи Котарка; Хайнер Экерт (2004). Фосгенации — справочник . Вайли ВЧ. п. 42. ИСБН 978-3-527-29823-5 . Проверено 12 марта 2011 г.