МГ132
Эта статья включает список общих ссылок , но в ней отсутствуют достаточные соответствующие встроенные цитаты . ( Ноябрь 2015 г. ) |
 | |
| Имена | |
|---|---|
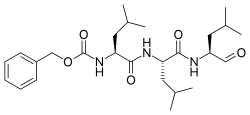
| Систематическое название ИЮПАК Бензил [(2 S )-4-метил-1-{[(2 S )-4-метил-1-{[(2 S )-4-метил-1-оксопентан-2-ил]амино}-1- оксопентан-2-ил]амино}-1-оксопентан-2-ил]карбамат | |
| Другие имена N -Бензилоксикарбонил- L -лейцил- L -лейцил- L -лейциналь Z-Лев-Лев-Лео-ал | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ХимическийПаук | |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 26 Н 41 Н 3 О 5 | |
| Молярная масса | 475.630 g·mol −1 |
| Появление | Белый твердый |
| Растворимость | 100 мМ в EtOH и ДМСО |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
MG132 является мощным, обратимым и проницаемым для клеток ингибитором протеасом. [1] ( К i = 4 нМ). Он относится к классу синтетических пептидных альдегидов. [2] [3] Он уменьшает деградацию конъюгированных с убиквитином белков в клетках млекопитающих и проницаемых штаммах дрожжей с помощью комплекса 26S, не влияя на их АТФазную или изопептидазную активность. MG132 активирует N-концевую киназу c-Jun (JNK1), которая инициирует апоптоз . MG132 также ингибирует активацию NF-κB с IC 50 3 мкМ и предотвращает расщепление β-секретазой .
Молекулярный механизм
[ редактировать ]Существует несколько ингибиторов, которые могут легко проникать в клетку и избирательно ингибировать путь деградации. В его состав входят пептидные альдегиды , такие как Cbz-лей-лей-лейциналь (MG132), Cbz-лей-лей-норвалинал ( MG115 ) и ацетил-лей-лей-норлейциналь ( ALLN ). [1] Это аналоги субстрата и мощные ингибиторы переходного состояния химотрипсина , подобные активности протеасомного механизма. [4] [5] Также известно, что пептидные альдегиды ингибируют некоторые лизосомальные цистеиновые протеазы и кальпаины , поэтому MG132 не может быть эксклюзивным ингибитором протеасомного пути. [4]
Ссылки
[ редактировать ]- ^ Jump up to: а б Ли, До Хи; Гольдберг, Альфред Л. (октябрь 1998 г.). «Ингибиторы протеасом: новые ценные инструменты для клеточных биологов». Тенденции в клеточной биологии . 8 (10): 397–403. дои : 10.1016/S0962-8924(98)01346-4 . ПМИД 9789328 .
- ^ Ито А., Такахаши Р., Муира С., Баба Ю. (1975). «Синтетическое исследование пептидоальдегидов» . Химико-фармацевтический вестник . 12 (23): 3106–3113. дои : 10.1248/cpb.23.3106 .
- ^ Хаяси М., Сайто Ю., Кавасима С. (31 января 1992 г.). «Активация кальпаина необходима для слияния мембран эритроцитов в присутствии экзогенного Ca2+». Биохимия Биофиз Рес Коммьюнити . 182 (2): 939–946. дои : 10.1016/0006-291x(92)91822-8 . ПМИД 1734892 .
- ^ Jump up to: а б Рок, Кеннет Л.; Грэм, Колетт; Ротштейн, Лиза; Кларк, Карен; Штейн, Росс; Дик, Лоуренс; Хван, Дэниел; Гольдберг, Альфред Л. (сентябрь 1994 г.). «Ингибиторы протеасом блокируют деградацию большинства клеточных белков и образование пептидов, представленных на молекулах MHC класса I». Клетка . 78 (5): 761–771. дои : 10.1016/s0092-8674(94)90462-6 . ISSN 0092-8674 . ПМИД 8087844 . S2CID 22262916 .
- ^ Ли, До Хи; Гольдберг, Альфред Л. (1 ноября 1996 г.). «Селективные ингибиторы протеасомозависимого и вакуолярного путей деградации белка у Saccharomyces cerevisiae» . Журнал биологической химии . 271 (44): 27280–27284. дои : 10.1074/jbc.271.44.27280 . ISSN 0021-9258 . ПМИД 8910302 . S2CID 40396862 .