Стереохимия

Стереохимия , раздел химии , включает в себя изучение относительного пространственного расположения атомов , образующих структуру молекул , и манипулирование ими. [1] Изучение стереохимии фокусируется на взаимоотношениях между стереоизомерами , которые по определению имеют одинаковую молекулярную формулу и последовательность связанных атомов (строение), но различаются геометрическим расположением атомов в пространстве. По этой причине ее также называют трехмерной химией — приставка «стерео-» означает «трехмерность». [2]
Стереохимия охватывает весь спектр органической , неорганической , биологической , физической и особенно супрамолекулярной химии . Стереохимия включает методы определения и описания этих связей; влияние на физические или биологические свойства, которые эти отношения придают рассматриваемым молекулам, и способ, которым эти отношения влияют на реакционную способность рассматриваемых молекул ( динамическая стереохимия ).
История
[ редактировать ]Стереохимические принципы были разработаны только после наблюдения некоторых молекулярных явлений. В 1815 году наблюдение оптической активности Жаном-Батистом Био положило начало истории органической стереохимии. Он заметил, что органические молекулы способны вращать плоскость поляризации света в растворе или в газовой фазе. [3] Несмотря на открытия Био, Луи Пастера обычно называют первым стереохимиком, который в 1842 году заметил, что соли винной кислоты, собранные из сосудов для производства вина , могут вращать плоскость поляризованного света , а соли из других источников - нет. Это свойство, единственное физическое свойство, по которому различались два типа тартратных солей, обусловлено оптической изомерией . В 1874 году Якобус Хенрикус ван 'т Хофф и Жозеф Ле Бель объяснили оптическую активность тетраэдрическим расположением атомов, связанных с углеродом. Кекуле использовал тетраэдрические модели ранее, в 1862 году, но никогда не публиковал их; Эмануэле Патерно, вероятно, знал о них, но был первым, кто нарисовал и обсудил трехмерные структуры, такие как 1,2-дибромэтан, в журнале Giornale di Scienze Naturali ed Economiche в 1869 году. [4] Термин «хиральный» был введен лордом Кельвином в 1904 году. Артур Робертсон Кушни , шотландский фармаколог, в 1908 году впервые предложил конкретный пример разницы в биологической активности между энантиомерами хиральной молекулы, а именно. (-)-Адреналин в два раза более эффективен, чем форма (±)-, как сосудосуживающее средство, и в 1926 году он заложил основу хиральной фармакологии / стереофармакологии. [5] [6] (биологические связи оптически изомерных веществ). Позже, в 1966 году, была разработана номенклатура Кана-Ингольда-Прелога или правило последовательности для присвоения абсолютной конфигурации стереогенному / хиральному центру (R- и S-нотации). [7] и расширен для применения через олефиновые связи (обозначения E и Z).
Значение
[ редактировать ]Правила приоритета Кана-Ингольда-Прелога являются частью системы описания стереохимии молекулы. Они стандартным образом ранжируют атомы вокруг стереоцентра, позволяя однозначно описать относительное положение этих атомов в молекуле. Проекция Фишера — это упрощенный способ изображения стереохимии вокруг стереоцентра.
Пример талидомида
[ редактировать ]
Стереохимия имеет важные применения в области медицины, особенно фармацевтики. Часто цитируемый пример важности стереохимии связан с катастрофой, связанной с талидомидом. Талидомид — фармацевтический препарат , впервые полученный в 1957 году в Германии, назначаемый для лечения утренней тошноты у беременных. Было обнаружено, что препарат тератогенен , вызывая серьезные генетические нарушения раннего эмбрионального роста и развития, что приводит к деформации конечностей у младенцев. Некоторые из нескольких предложенных механизмов тератогенности включают различные биологические функции энантиомеров ( R )- и ( S )-талидомида. [8] Однако в организме человека талидомид подвергается рацемизации : даже если в качестве лекарственного средства применяется только один из двух энантиомеров, другой энантиомер образуется в результате метаболизма. [9] Соответственно, неверно утверждать, что один стереоизомер безопасен, а другой тератогенен. [10] Талидомид в настоящее время используется для лечения других заболеваний, особенно рака и проказы . Строгие правила и контроль позволили избежать его использования беременными женщинами и предотвратить деформации развития. Эта катастрофа стала движущей силой, требующей строгого тестирования лекарств, прежде чем сделать их доступными для общественности.
Определения
[ редактировать ]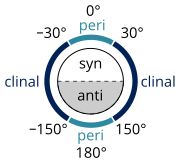
Существует множество определений, описывающих конкретный конформер ( Золотая книга ИЮПАК ), разработанных Уильямом Клайном и Владимиром Прелогом , составляющих их Клайна-Прелога систему номенклатуры :
- угол скручивания ±60° называется гош [11]
- угол скручивания от 0 ° до ± 90 ° называется Syn (s)
- угол скручивания между ±90° и 180° называется анти (а)
- угол скручивания между 30° и 150° или между -30° и -150° называется клинальным.
- угол скручивания от 0 ° до 30 ° или от 150 ° до 180 ° называется перипланарным (p)
- угол скручивания от 0 ° до 30 ° называется синперипланарной или син- или цис-конформацией (sp).
- угол скручивания от 30° до 90° и от -30° до -90° называется синклинальным , гош или скосом (sc) [12]
- угол закручивания от 90° до 150° и от -90° до -150° называется антиклиналью (ac).
- угол скручивания от ± 150 ° до 180 ° называется антиперипланарным , анти- или транс- (ap).
Деформация кручения возникает в результате сопротивления скручиванию вокруг связи.
Типы
[ редактировать ]- Атропоизомерия
Энергетическая форма осевой хиральности. Эта форма киральности возникает в результате дифференциального замещения связи, обычно между двумя sp²-гибридизированными атомами. [13] - Цис - транс- изомерия
Эти соединения, также называемые геометрическими изомерами, имеют разные конфигурации из-за негибкой структуры молекулы. Чтобы молекула имела цис-транс-изомерию, должны быть выполнены два требования: [14]
1. Вращение внутри молекулы должно быть ограничено.
2. На каждом атоме углерода с двойной связью должны находиться две неидентичные группы. - Конформационная изомерия
Эту форму изомерии также называют конформерами, ротамерами и ротамерами. Конформационная изомерия возникает в результате вращения вокруг одинарной связи . - Диастереомеры
Эти стереоизомеры не являются изображениями и неидентичны. Диастереомеры возникают, когда стереоизомеры соединения имеют разные конфигурации в соответствующих стереоцентрах. [15] - Энантиомеры
Стереоизомеры, которые не являются суперпозитивными, являются зеркальными отображениями. [16]
См. также
[ редактировать ]- Стереохимия алканов
- Хиральное разрешение , которое часто включает кристаллизацию.
- Хиральность (химия) ( R / S , д / л )
- Хиральный переключатель
- Скелетная формула # Стереохимия , которая описывает, как стереохимия обозначается в скелетных формулах.
- Химия твердого тела
- Теория ВСЕПР
- Ядерный эффект Оверхаузера — метод спектроскопии ядерного магнитного резонанса (ЯМР), используемый для выяснения стереохимии органических молекул.
Ссылки
[ редактировать ]- ^ Эрнеста Элиэля Основная органическая стереохимия , 2001 г. ISBN 0471374997 ; Бернард Теста и Джон Колдуэлл. Органическая стереохимия: руководящие принципы и биомедицинская значимость, 2014 г. ISBN 3906390691 ; Хуа-Цзе Чжу Органическая стереохимия: экспериментальные и вычислительные методы 2015 ISBN 3527338225 ; Ласло Поппе, Михай Ногради, Йожеф Надь, Габор Хорнянски, Золтан Борос Стереохимия и стереоселективный синтез: Введение 2016 ISBN 3527339019
- ^ "определение стерео-" . Словарь.com . Архивировано из оригинала 9 июня 2010 г.
- ^ Насипури, Д. (2021). Стереохимия органических соединений, принципы и применение (4-е изд.). Нью-Дели: Нью Эйдж Интернэшнл. п. 1. ISBN 978-93-89802-47-4 .
- ^ Патерно, Эмануэле (1869). «О действии перхлорида фосфора на хлорал» . Ежедневно Науч. Экон . 5 : 117–122.
- ^ Смит, Сайлас В. (4 мая 2009 г.). «Хиральная токсикология: это то же самое… только другое» . Токсикологические науки . 110 (1): 4–30. дои : 10.1093/toxsci/kfp097 . ISSN 1096-6080 . ПМИД 19414517 .
- ^ Паточка, Иржи; Дворжак, Алеш (31 июля 2004 г.). «Биомедицинские аспекты хиральных молекул» . Журнал прикладной биомедицины . 2 (2): 95–100. дои : 10.32725/jab.2004.011 .
- ^ Кан, РС; Ингольд, Кристофер; Прелог, В. (апрель 1966 г.). «Спецификация молекулярной хиральности». Angewandte Chemie International Edition на английском языке . 5 (4): 385–415. дои : 10.1002/anie.196603851 . ISSN 0570-0833 .
- ^ Стивенс Т.Д., Бунде С.Дж., Филлмор Б.Дж. (июнь 2000 г.). «Механизм действия талидомида при тератогенезе». Биохимическая фармакология . 59 (12): 1489–99. дои : 10.1016/S0006-2952(99)00388-3 . ПМИД 10799645 .
- ^ Тео С.К., Колберн В.А., Трейсуэлл В.Г., Кук К.А., Стирлинг Д.И., Яворски М.С., Шеффлер М.А., Томас С.Д., Ласкин О.Л. (2004). «Клиническая фармакокинетика талидомида». Клин. Фармакокинетика . 43 (5): 311–327. дои : 10.2165/00003088-200443050-00004 . ПМИД 15080764 . S2CID 37728304 .
- ^ Франкл, Мишель (2010). «Городские легенды химии». Природная химия . 2 (8): 600–601. Бибкод : 2010НатЧ...2..600Ф . дои : 10.1038/nchem.750 . ПМИД 20651711 .
- ^ Анслин, Эрик В. и Догерти, Деннис А. Современная физико-органическая химия . Университетская наука (2005), 1083 стр. ISBN 1-891389-31-9
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « Гош ». дои : 10.1351/goldbook.G02593
- ^ Тойджес, Шон Т; Густавсон, Джеффри Л. (февраль 2018 г.). «Атропоизомерия в медицинской химии: проблемы и возможности» . Будущая медицинская химия . 10 (4): 409–422. дои : 10.4155/fmc-2017-0152 . ISSN 1756-8919 . ПМЦ 5967358 . ПМИД 29380622 .
- ^ «13.2: Цис-транс-изомеры (геометрические изомеры)» . Химия LibreTexts . 17 июля 2014 г. Проверено 27 ноября 2022 г.
- ^ Гарретт, Реджинальд Х.; Гришэм, Чарльз М. (2005). Биохимия (3-е изд.). Бельмонт, Калифорния: Томсон Брукс/Коул. ISBN 0-534-49033-6 . OCLC 56058171 .
- ^ Кайе, Селин; Шовело-Моашон, Лоуренс; Монтаструк, Жан-Луи; Багери, Халех; Французская ассоциация региональных центров фармаконадзора (ноябрь 2012 г.). «Профиль безопасности энантиомеров по сравнению с рацемическими смесями: это одно и то же?: Краткий отчет» . Британский журнал клинической фармакологии . 74 (5): 886–889. дои : 10.1111/j.1365-2125.2012.04262.x . ПМЦ 3495153 . ПМИД 22404187 .