Аламетицин
 | |
| Имена | |
|---|---|
| Название ИЮПАК N -ацетил-2-метилаланил- L -пролил-2-метилаланил- L -аланил-2-метилаланил- L - аланил- L -глутаминил -2-метилаланил- L -валил-2-метилаланилглицил- L -лейцил-2- метилаланил- L -пролил- L -валил-2-метилаланил-2-метилаланил- L -α-глутамил- N 1 -[(1S ) -1-бензил-2-гидроксиэтил] -L- глутамид | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Информационная карта ECHA | 100.121.626 |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики | |
| С 92 Ч 150 Н 22 О 25 | |
| Молярная масса | 1964.31 g/mol |
| Появление | Кремово-белое твердое вещество |
| Температура плавления | От 255 до 270 ° C (от 491 до 518 ° F; от 528 до 543 К) |
| нерастворимый | |
| Растворимость в ДМСО , метаноле , этаноле | Растворимый |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Аламетицин — каналообразующий пептидный антибиотик , продуцируемый грибом Trichoderma viride . Он относится к пептайбола пептидам , которые содержат непротеиногенный аминокислотный остаток Aib ( 2-аминоизомасляная кислота ). Этот остаток сильно индуцирует образование альфа-спиральной структуры. Пептидная последовательность представляет собой
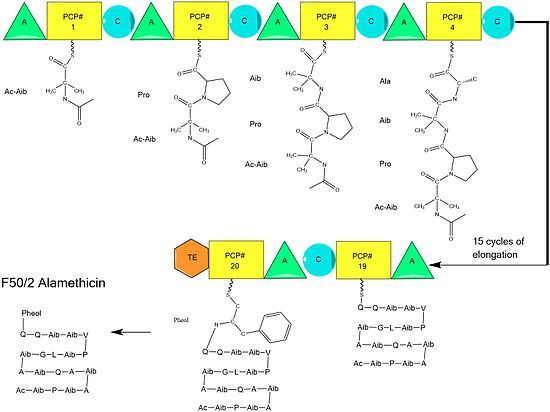
- Ак-Аиб-Про-Аиб-Ала-Аиб-Ала-Глн-Аиб-Вал-Аиб-Гли-Лей-Аиб-Про-Вал-Аиб-Аиб-Глу-Глн-Фл
где Ac = ацетил , Phl = фенилаланинол и Aib = 2-аминоизомасляная кислота .
В клеточных мембранах он образует потенциал -зависимые ионные каналы путем агрегации четырех-шести молекул .
Биосинтез
[ редактировать ]Предполагается, что биосинтез аламетицина катализируется аламетицинсинтазой , нерибосомальной пептидсинтазой (NRPS), впервые выделенной в 1975 году. [2] Хотя существует несколько принятых последовательностей пептида аламетицина, [3] данные свидетельствуют о том, что все они следуют общему механизму NRPS. [4] с небольшими вариациями в отдельных аминокислотах. [5] Начиная с ацилирования N-конца первой аминоизомасляной кислоты ферментом ALM-синтазы ацетил-КоА , [6] за этим следует последовательная конденсация аминокислот каждой модульной единицей синтетазы. [7] Аминокислоты первоначально аденилируются доменом « аденилирования » (А), а затем прикрепляются тиоэфирной связью к ациловому белку-переносчику, подобному пептидильному белку-переносчику. [8] Растущая цепь присоединяется к аминокислоте, несущей PCP, с помощью домена «конденсации» (C), после чего следует еще один раунд тех же реакций со стороны следующего модуля. [8]
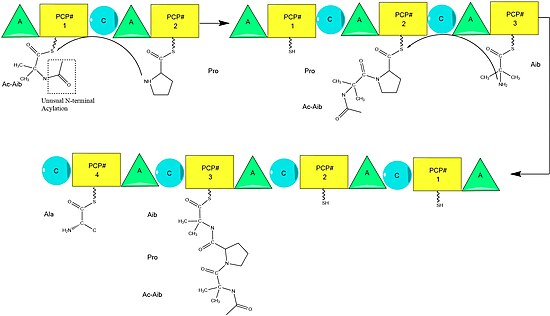
Сборка завершается добавлением фенилаланинола, необычного аминокислотоподобного субстрата. [9] После добавления фенилаланинола завершенная пептидная цепь расщепляется тиоэстеразным доменом, расщепляя тиоэфирную связь и оставляя спирт. [ нужна ссылка ]
Ссылки
[ редактировать ]- ^ Страница продукта аламетицина от Fermentek.
- ^ Говядина, Х.; Кляйнкауф, Х. (1 марта 1976 г.). «Биосинтез аламетицина» . Письма ФЭБС . 62 (3): 276–280. дои : 10.1016/0014-5793(76)80074-9 . ISSN 0014-5793 . ПМИД 945191 .
- ^ Киршбаум, Йохен; Краузе, Корина; Винцхаймер, Рут К.; Брюкнер, Ганс (ноябрь – декабрь 2003 г.). «Последовательности аламетицинов F30 и F50 пересмотрены и согласованы». Журнал пептидной науки . 9 (11–12): 799–809. дои : 10.1002/psc.535 . ISSN 1075-2617 . ПМИД 14658799 . S2CID 25076336 .
- ^ Марахиэль, Мохамед А.; Стахельхаус, Торстен; Моотц, Хеннинг Д. (1 ноября 1997 г.). «Модульные пептидсинтетазы, участвующие в синтезе нерибосомальных пептидов». Химические обзоры . 97 (7): 2651–2674. дои : 10.1021/cr960029e . ISSN 0009-2665 . ПМИД 11851476 .
- ^ Кляйнкауф, Х.; Риндфляйш, Х. (1975). «Нерибосомальный биосинтез циклического октадекапептида аламетицина». Acta Microbiologica Academiae Scientiarum Hungaricae . 22 (4): 411–418. ISSN 0001-6187 . ПМИД 1241650 .
- ^ Мор, Х.; Кляйнкауф, Х. (12 октября 1978 г.). «Биосинтез аламетицина: ацетилирование аминоконца и присоединение фенилаланинола». Biochimica et Biophysical Acta (BBA) - Энзимология . 526 (2): 375–386. дои : 10.1016/0005-2744(78)90129-8 . ISSN 0006-3002 . ПМИД 568941 .
- ^ Вебер, Томас; Марахил, Мохамед А. (январь 2001 г.). «Изучение доменной структуры модульных нерибосомальных пептидсинтетаз» . Структура . 9 (1): –3–R9. дои : 10.1016/S0969-2126(00)00560-8 . ISSN 0969-2126 . ПМИД 11342140 .
- ^ Jump up to: а б Фишбах, Майкл А.; Уолш, Кристофер Т. (август 2006 г.). «Конвейерная энзимология поликетидных и нерибосомальных пептидных антибиотиков: логика, техника и механизмы». Химические обзоры . 106 (8): 3468–3496. дои : 10.1021/cr0503097 . ISSN 0009-2665 . ПМИД 16895337 .
- ^ Тернер, С. Ричард; Войт, Бриджит И.; Мури, Томас Х. (1 августа 1993 г.). «Полностью ароматические сверхразветвленные полиэфиры с концевыми группами C-фенилаланинола и N-ацетата: синтез и характеристика». Макромолекулы . 26 (17): 4617–4623. Бибкод : 1993МаМол..26.4617Т . дои : 10.1021/ma00069a031 . ISSN 0024-9297 .
Дальнейшее чтение
[ редактировать ]- Джонс, ЛР; Мэддок, Юго-Запад; Беш, HR-младший (1980). «Демаскирующий эффект аламетицина на (Na +,K+)-АТФазу, аденилатциклазу, связанную с бета-адренергическими рецепторами, и цАМФ-зависимую протеинкиназную активность сердечных сарколеммальных везикул» . Ж. Биол. Хим . 255 (20): 9971–9980. дои : 10.1016/S0021-9258(18)43488-6 . ПМИД 6253461 .
- Изучите структуры аламетицина в банке данных белков.
- Аламетицин в Норине
- Из «Модели потенциалзависимого ионного канала, полученной на основе кристаллической структуры аламетицина с разрешением 1,5 А». Фокс-младший, Род-Айленд; Ричардс, FM (1982). «Модель потенциалзависимого ионного канала, полученная на основе кристаллической структуры аламетицина с разрешением 1,5 А». Природа . 300 (5890): 325–30. Бибкод : 1982Natur.300..325F . дои : 10.1038/300325a0 . ПМИД 6292726 . S2CID 4278453 .
- Лейтгеб, Балаж; Секереш, Андраш; Манцингер, Ласло; Вагвёлдьи, Чаба; Кредич, Ласло (1 июня 2007 г.). «История аламетицина: обзор наиболее изученного пептайбола». Химия и биоразнообразие . 4 (6): 1027–1051. дои : 10.1002/cbdv.200790095 . ISSN 1612-1880 . ПМИД 17589875 . S2CID 40886688 .