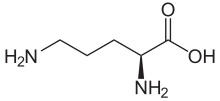
Орнитин
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК L -Орнитин | |
| Другие имена (+)-( S )-2,5-Диамиовалериановая кислота (+)-( S )-2,5-Диаминопентановая кислота | |
| Идентификаторы | |
3D model ( JSmol ) | |
| ЧЭБИ | |
| ЧЕМБЛ | |
| ХимическийПаук | |
| Лекарственный Банк | |
| Информационная карта ECHA | 100.000.665 |
| Номер ЕС |
|
| КЕГГ | |
| МеШ | Орнитин |
ПабХим CID | |
| НЕКОТОРЫЙ | |
Панель управления CompTox ( EPA ) | |
| Характеристики [1] | |
| C5H12N2OC5H12N2O2 | |
| Молярная масса | 132.16 g/mol |
| Температура плавления | 140 ° С (284 ° F; 413 К) |
| растворимый | |
| Растворимость | растворим в этаноле |
| Кислотность ( pKa ) | 1.94 |
Хиральное вращение ([α] D ) | +11,5 (Н 2 О, с = 6,5) |
Если не указано иное, данные приведены для материалов в стандартном состоянии (при 25 °C [77 °F], 100 кПа). | |
Орнитин — это непротеиногенная α-аминокислота, которая играет роль в цикле мочевины . Орнитин аномально накапливается в организме при дефиците орнитинтранскарбамилазы . Радикал — орнитил . [2]
Роль в цикле мочевины
[ редактировать ]L -Орнитин является одним из продуктов действия фермента аргиназы на L - аргинин , образующего мочевину . Таким образом, орнитин является центральной частью цикла мочевины, позволяющей избавиться от избытка азота . Орнитин перерабатывается и в некотором смысле является катализатором. Сначала аммиак превращается в карбамоилфосфат ( H
2 НЗ(О)ОПО 2−
3 ) карбамоилфосфатсинтетазой. Орнитинтранскарбамилаза катализирует реакцию между карбамоилфосфатом и орнитином с образованием цитруллина и фосфата (P i ). Другая аминогруппа добавляется из аспартата , образуя аргинин и деазотированный фумарат . Полученный аргинин ( соединение гуанидиния ) гидролизуется обратно до орнитина с образованием мочевины. Аминогруппы мочевины происходят из аммиака и аспартата, а азот в орнитине остается неизменным.

Орнитин не является аминокислотой, кодируемой ДНК , то есть не протеиногенной . Однако в непеченочных тканях млекопитающих основное использование цикла мочевины приходится на биосинтез аргинина, поэтому орнитин как промежуточный продукт метаболических процессов весьма важен. [4]
Другие реакции
[ редактировать ]Орнитин под действием орнитиндекарбоксилазы ( EC 4.1.1.17) является отправной точкой для синтеза полиаминов , таких как путресцин .
В бактериях, таких как E.coli , орнитин может синтезироваться из L -глутамата . [5]

Исследовать
[ редактировать ]Усталость от упражнений
[ редактировать ]Добавки L -орнитина снизили утомляемость у участников плацебо-контролируемого исследования с использованием велоэргометра. Результаты показали, что L -орнитин оказывает противоусталостное действие, повышая эффективность энергопотребления и способствуя выведению аммиака. [6] [7]
Добавка для тяжелой атлетики
[ редактировать ]Аминокислотные добавки, в том числе L -орнитин, часто продаются бодибилдерам и тяжелоатлетам с заявлениями о повышении уровня гормона роста человека (ГРЧ), мышечной массы и силы. Краткое 4-дневное клиническое исследование 1993 года показало, что L -орнитин в сочетании с L -аргинином и L -лизином в дозе 2 г/день каждый не увеличивает уровень гормона роста. [8] В обзоре 2002 года по этой теме сделан вывод: «Использование спортсменами определенных аминокислот для стимуляции высвобождения гормона роста не рекомендуется». [9]
цирроз печени
[ редактировать ]L -орнитин L -аспартат (LOLA), стабильная соль орнитина и аспарагиновой кислоты, используется при лечении цирроза печени. [10] и печеночная энцефалопатия. [11]
Ссылки
[ редактировать ]- ^ Уэст, Роберт С., изд. (1981). Справочник CRC по химии и физике (62-е изд.). Бока-Ратон, Флорида: CRC Press. п. С-408. ISBN 0-8493-0462-8 .
- ^ Сивашанмугам М (февраль 2017 г.). «Орнитин и его роль в метаболических заболеваниях: оценка». Биомед Фармакотер . 86 : 185–194. дои : 10.1016/j.biopha.2016.12.024 . ПМИД 27978498 .
- ^ Лэнгли Д.Б., Темплтон, доктор медицинских наук, Филдс, Б.А., Митчелл Р.Э., Коллайер, Калифорния (июнь 2000 г.). «Механизм инактивации орнитин-транскарбамоилазы Ndelta-(N'-сульфодиаминофосфинил)-L-орнитином, истинным аналогом переходного состояния? Кристаллическая структура и значение каталитического механизма» . Журнал биологической химии . 275 (26): 20012–9. дои : 10.1074/jbc.M000585200 . ПМИД 10747936 .
- ^ Вебер А.Л., Миллер С.Л. (1981). «Причины появления двадцати кодируемых в белке аминокислот» (PDF) . Журнал молекулярной эволюции . 17 (5): 273–84. Бибкод : 1981JMolE..17..273W . дои : 10.1007/BF01795749 . ПМИД 7277510 . S2CID 27957755 .
- ^ «Биосинтез орнитина» . Школа биологических и химических наук Королевы Марии, Лондонский университет. Архивировано из оригинала 14 апреля 2012 г. Проверено 17 августа 2007 г.
{{cite journal}}: Для цитирования журнала требуется|journal=( помощь ) - ^ Сугино Т., Шираи Т., Кадзимото Ю., Кадзимото О. (ноябрь 2008 г.). «Добавка L-орнитина снижает физическую усталость у здоровых добровольцев за счет модуляции метаболизма липидов и аминокислот». Исследования питания . 28 (11): 738–43. дои : 10.1016/j.nutres.2008.08.008 . ПМИД 19083482 .
- ^ Демура С., Ямада Т., Ямадзи С., Комацу М., Моришита К. (октябрь 2010 г.). «Влияние приема L-орнитина гидрохлорида на работоспособность во время дополнительных изнурительных упражнений на велоэргометре и метаболизм аммиака во время и после тренировки» . Европейский журнал клинического питания . 64 (10): 1166–71. дои : 10.1038/ejcn.2010.149 . hdl : 2297/25434 . ПМИД 20717126 .
- ^ Фогельхольм ГМ, Нявери ХК, Киилавуори К.Т., Харконен М.Х. (сентябрь 1993 г.). «Низкие дозы аминокислот: отсутствие влияния на гормон роста человека и инсулин в сыворотке крови у тяжелоатлетов-мужчин». Международный журнал спортивного питания . 3 (3): 290–7. дои : 10.1123/ijsn.3.3.290 . ПМИД 8220394 .
- ^ Хромиак Дж.А., Антонио Дж. (2002). «Использование аминокислот спортсменами в качестве агентов, высвобождающих гормон роста». Питание . 18 (7–8): 657–61. дои : 10.1016/s0899-9007(02)00807-9 . ПМИД 12093449 .
- ^ Сикорска Х., Чианчара Дж., Верциньска-Драпало А. (июнь 2010 г.). «[Физиологические функции L-орнитина и L-аспартата в организме и эффективность применения L-орнитина-L-аспартата в условиях относительной недостаточности]» . Польский Меркуриуш Лекарски . 28 (168): 490–5. ПМИД 20642112 .
- ^ Баттерворт Р., Макфейл М. (февраль 2019 г.). «L-орнитин L-аспартат (LOLA) при печеночной энцефалопатии при циррозе печени: результаты рандомизированных контролируемых исследований и метаанализов» . Наркотики . 79 (Приложение 1): 31–37. дои : 10.1007/s40265-018-1024-1 . ПМК 6416237 . ПМИД 30706425 .