Хлорамфениколацетилтрансфераза
| Хлорамфениколацетилтрансфераза | |||
|---|---|---|---|
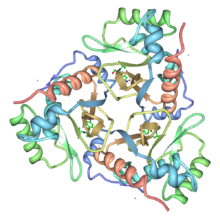 Ленточная диаграмма хлорамфениколацетилтрансферазы, тримера связанного с хлорамфениколом. Из PDB : 3CLA . | |||
| Идентификаторы | |||
| Символ | КОТ | ||
| Пфам | PF00302 | ||
| ИнтерПро | ИПР001707 | ||
| PROSITE | PDOC00093 | ||
| ОБЛАСТЬ ПРИМЕНЕНИЯ 2 | 3cla / SCOPe / СУПФАМ | ||
| |||
| Хлорамфениколацетилтрансфераза | |||
|---|---|---|---|
| Идентификаторы | |||
| Номер ЕС. | 2.3.1.28 | ||
| Номер CAS. | 9040-07-7 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| Генная онтология | АмиГО / QuickGO | ||
| |||
Хлорамфениколацетилтрансфераза (или CAT ) представляет собой бактериальный фермент ( EC 2.3.1.28 ). [ 1 ] который выводит токсины из антибиотика хлорамфеникола и отвечает за устойчивость бактерий к хлорамфениколу. [ 2 ] Этот фермент ковалентно присоединяет ацетильную группу ацетил-КоА к хлорамфениколу, что предотвращает связывание хлорамфеникола с рибосомами . Остаток гистидина, расположенный в С-концевой части фермента, играет центральную роль в его каталитическом механизме.
кристаллическая структура фермента III типа Escherichia coli Определена , связанного с хлорамфениколом. CAT представляет собой тример идентичных субъединиц (мономер Mr 25 000), а тримерная структура стабилизирована рядом водородных связей, некоторые из которых приводят к удлинению бета-листа через границу раздела субъединиц. Хлорамфеникол связывается в глубоком кармане, расположенном на границе между соседними субъединицами тримера, так что большинство остатков, образующих связывающий карман, принадлежат одной субъединице, а каталитически необходимый гистидин принадлежит соседней субъединице. His195 соответственно позиционируется как основной катализатор реакции, а необходимая таутомерная стабилизация обеспечивается необычным взаимодействием с карбонильным кислородом основной цепи. [ 3 ]
Приложение
[ редактировать ]CAT используется в качестве репортерной системы для измерения уровня промотора или его тканеспецифичной экспрессии. CAT-анализ включает мониторинг ацетилирования радиоактивно меченного хлорамфеникола на пластинке ТСХ ; Активность CAT определяют путем поиска ацетилированных форм хлорамфеникола, которые имеют значительно повышенную скорость миграции по сравнению с неацетилированной формой. [ 4 ]
Ссылки
[ редактировать ]- ^ Энгель Дж., Проккоп DJ (1991). «Складывание тройных спиралей коллагена, подобное застежке-молнии, и эффекты мутаций, разрушающих застежку-молнию». Анну. Преподобный Биофиз. Биофиз. Хим . 20 (1): 137–152. дои : 10.1146/annurev.bb.20.060191.001033 . ПМИД 1867713 .
- ^ Шоу В.В., Пакман Л.К., Берли Б.Д., Делл А., Моррис Х.Р., Хартли Б.С. (1979). «Первичная структура хлорамфениколацетилтрансферазы, определяемая R-плазмидами». Природа . 282 (5741): 870–2. Бибкод : 1979Natur.282..870S . дои : 10.1038/282870a0 . ПМИД 390404 . S2CID 2038024 .
- ^ Лесли А.Г. (1990). «Уточненная кристаллическая структура хлорамфениколацетилтрансферазы типа III с разрешением 1,75 А». Дж. Мол. Биол . 213 (1): 167–186. дои : 10.1016/S0022-2836(05)80129-9 . ПМИД 2187098 .
- ^ Горман, CM; Моффат Л.Ф.; Говард Б.Х. (1982). «Рекомбинантные геномы, экспрессирующие хлорамфениколацетилтрансферазу в клетках млекопитающих» . Мол. Клетка. Биол . 2 (9): 1044–1051. дои : 10.1128/MCB.2.9.1044 . ПМК 369897 . ПМИД 6960240 .