N-ацетилтрансфераза
| Ариламин-N-ацетилтрансфераза 2 | |||
|---|---|---|---|
 Трехмерное мультяшное изображение N-ацетилтрансферазы 2 человека. | |||
| Идентификаторы | |||
| Номер ЕС. | 2.3.1.5 | ||
| Базы данных | |||
| ИнтЭнк | вид IntEnz | ||
| БРЕНДА | БРЕНДА запись | ||
| Экспаси | Просмотр NiceZyme | ||
| КЕГГ | КЕГГ запись | ||
| МетаЦик | метаболический путь | ||
| ПРЯМОЙ | профиль | ||
| PDB Структуры | RCSB PDB PDBe PDBsum | ||
| |||
N -ацетилтрансфераза ( НАТ ) — фермент перенос , катализирующий ацетильных групп от ацетил-КоА к ариламинам , арилгидроксиламинам и арилгидразинам. [ 1 ] [ 2 ] [ 3 ] Они обладают широкой специфичностью к ароматическим аминам , особенно к серотонину , а также могут катализировать перенос ацетила между ариламинами без КоА. N -ацетилтрансферазы представляют собой цитозольные ферменты, обнаруженные в печени и многих тканях большинства видов млекопитающих, за исключением собаки и лисицы , которые не могут ацетилировать ксенобиотики . [ 4 ] Ацетильные группы играют важную роль в конъюгации метаболитов из печени, обеспечивая выведение побочных продуктов ( метаболизм фазы II ). Это особенно важно в метаболизме и выведении лекарственных препаратов ( метаболизм лекарств ).
Ферментативный механизм
[ редактировать ]Ферменты NAT отличаются наличием консервативной каталитической триады , которая отдает предпочтение ароматического амина и гидразина . субстратам [ 5 ] [ 6 ] NAT катализируют ацетилирование небольших молекул посредством реакции двойного замещения, называемой реакцией пинг-понга би-би. [ 5 ] Механизм . состоит из двух последовательных реакций [ 5 ] В реакции один ацетил-КоА первоначально связывается с ферментом и ацетилирует Cys. 68 . [ 5 ] Во второй реакции после ацетил-КоА акцептор ацетила взаимодействует с ацетилированным ферментом с образованием продукта. высвобождения [ 5 ] Эта вторая реакция не зависит от донора ацетила, поскольку она покидает фермент до того, как свяжется акцептор ацетила. [ 5 ] Однако, как и во многих реакциях «пинг-понг-би-би», возможна конкуренция между донором ацетила и акцептором ацетила за неацетилированный фермент. [ 5 ] Это приводит к субстрат-зависимому ингибированию при высоких концентрациях. [ 5 ]

Структура фермента
[ редактировать ]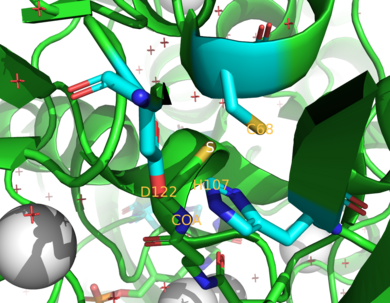
Двумя ферментами NAT у человека являются NAT1 и NAT2 . [ 4 ] Мыши и крысы экспрессируют три фермента: NAT1, NAT2 и NAT3. [ 4 ] Было обнаружено, что NAT1 и NAT2 тесно связаны у исследованных видов, поскольку эти два фермента имеют общую 75-95% аминокислотной последовательности . [ 9 ] [ 10 ] Оба также имеют в активном центре остаток цистеина (Cys 68 ) в N-концевой области. [ 9 ] [ 10 ] Кроме того, все функциональные ферменты NAT содержат триаду каталитически важных остатков, состоящих из цистеина , гистидина и аспарагина . [ 7 ] Было высказано предположение, что каталитические эффекты от рака молочной железы препарата цисплатин связаны с цистеином. 68 . [ 11 ] Инактивация NAT1 цисплатином вызвана необратимым образованием аддукта цисплатина с остатком цистеина в активном центре . [ 11 ] С-конец помогает связывать ацетил-КоА и различается среди NAT, включая прокариотических гомологов. [ 12 ]
NAT1 и NAT2 имеют разные, но перекрывающиеся субстратные специфичности. [ 4 ] Человеческий NAT1 преимущественно ацетилирует 4-аминобензойную кислоту (ПАБА), 4-аминосалициловую кислоту , сульфаметоксазол и сульфаниламид . [ 4 ] Человеческий NAT2 преимущественно ацетилирует изониазид (для лечения туберкулеза ), гидралазин , прокаинамид , дапсон , аминоглутетимид и сульфаметазин . [ 4 ]
Биологическое значение
[ редактировать ]NAT2 участвует в метаболизме ксенобиотиков , , что может приводить как к инактивации лекарств , так и к образованию токсичных метаболитов которые могут быть канцерогенными . [ 13 ] Биотрансформация ксенобиотиков может происходить в три фазы. [ 13 ] На этапе I в подложки вводятся реакционноспособные и полярные группы. На этапе II происходит конъюгация ксенобиотиков с заряженными видами, а на этапе III осуществляются дополнительные модификации, при этом механизмы оттока приводят к выведению переносчиками. [ 13 ] Полногеномное ассоциативное исследование (GWAS) выявило человеческий NAT2 как главный сигнал резистентности к инсулину , ключевого маркера диабета и основного фактора риска сердечно-сосудистых заболеваний. [ 13 ] и было показано, что он связан с резистентностью к инсулину всего организма у мышей, нокаутных по NAT1 . [ 14 ] Считается, что NAT1 играет эндогенную роль, вероятно, связанную с фундаментальным клеточным метаболизмом. [ 13 ] Это может быть связано с тем, почему NAT1 более широко распространен в тканях, чем NAT2. [ 13 ]
Значение для человека
[ редактировать ]Каждый человек метаболизирует ксенобиотики с разной скоростью, что является результатом полиморфизма генов метаболизма ксенобиотиков . [ 13 ] И NAT1, и NAT2 кодируются двумя высокополиморфными генами, расположенными на хромосоме 8 . [ 4 ] NAT2 Полиморфизм был одним из первых вариантов, объясняющих эту межиндивидуальную изменчивость метаболизма лекарств . [ 15 ] Эти полиморфизмы изменяют стабильность и/или каталитическую активность ферментов, которые изменяют скорость ацетилирования лекарств и ксенобиотиков, признак, называемый фенотипом ацетилатора . [ 16 ] Для NAT2 фенотип ацетилатора описывается как медленный, промежуточный или быстрый. [ 17 ] Помимо изменения ферментативной активности, эпидемиологические исследования обнаружили связь полиморфизмов NAT2 с различными видами рака, вероятно, из-за различных канцерогенов окружающей среды . [ 13 ]
Действительно, NAT2 весьма полиморфен в нескольких популяциях человека. [ 18 ] Полиморфизмы NAT2 включают одиночные аминокислотные замены R64Q, I114T, D122N, L137F, Q145P, R197Q и G286E. [ 18 ] Они классифицируются как медленные ацетиляторы, тогда как NAT2 дикого типа классифицируется как быстрый ацетилятор. [ 18 ] Медленные ацетиляторы, как правило, связаны с токсичностью лекарств и предрасположенностью к раку. [ 18 ] Например, генотип медленного ацетилатора NAT2 связан с повышенным риском рака мочевого пузыря , особенно среди курильщиков. [ 19 ] Однонуклеотидные полиморфизмы (SNP) NAT1 включают R64W, V149I, R187Q, M205V, S214A, D251V, E26K и I263V и связаны с генетической предрасположенностью к раку , врожденным дефектам и другим заболеваниям. [ 20 ] Эффект медленных ацетилирующих SNP в кодирующей области преимущественно проявляется через создание нестабильного белка, который агрегируется внутриклеточно перед убиквитинированием и деградацией. [ 3 ]
50% населения Великобритании испытывают дефицит печеночной N -ацетилтрансферазы. Это известно как отрицательный статус ацетилатора. На это влияют следующие препараты:
- изониазид
- прокаинамид
- гидралазин
- дапсон
- сульфасалазин
Побочные эффекты этого дефицита включают периферическую невропатию и гепатоксичность . [ 21 ] Самый медленный гаплотип ацетилатора , NAT2*5B (самая сильная связь с раком мочевого пузыря ), по-видимому, был выбран за последние 6500 лет у народов Западной и Центральной Евразии, что позволяет предположить, что медленное ацетилирование дало этой популяции эволюционное преимущество, несмотря на недавние неблагоприятные эпидемиологические события. данные о состоянии здоровья. [ 22 ]
Примеры
[ редактировать ]Ниже приводится список генов человека , кодирующих ферменты N-ацетилтрансферазы:
| Символ | Имя |
|---|---|
| ААНАТ | аралкиламин N-ацетилтрансфераза |
| АРД1А | Гомолог А ARD1, N-ацетилтрансфераза (S. cerevisiae) |
| ГНПНАТ1 | глюкозамин-фосфат N-ацетилтрансфераза 1 |
| ХГСНАТ | гепаран-альфа-глюкозаминид-N-ацетилтрансфераза |
| МАК10 | Гомолог MAK10, аминокислотная субъединица N-ацетилтрансферазы (S. cerevisiae) |
| НАТ1 | N-ацетилтрансфераза 1 (ариламин N-ацетилтрансфераза) |
| НОЧЬ2 | N-ацетилтрансфераза 2 (ариламин N-ацетилтрансфераза) |
| НАТ5 | N-ацетилтрансфераза 5 (связанная с GCN5, предположительно) |
| NAT6 | N-ацетилтрансфераза 6 (связанная с GCN5) |
| НАТ8 | N-ацетилтрансфераза 8 (связанная с GCN5, предположительно) |
| НАТ8Л | Подобная N-ацетилтрансферазе 8 (предположительно связанная с GCN5) |
| НАТ9 | N-ацетилтрансфераза 9 (связанная с GCN5, предположительно) |
| НАТ10 | N-ацетилтрансфераза 10 (связанная с GCN5) |
| НАТ11 | N-ацетилтрансфераза 11 (связанная с GCN5, предположительно) |
| НАТ12 | N-ацетилтрансфераза 12 (связанная с GCN5, предположительно) |
| НАТ13 | N-ацетилтрансфераза 13 (связанная с GCN5) |
| НАТ14 | N-ацетилтрансфераза 14 (связанная с GCN5, предположительно) |
| НАТ15 | N-ацетилтрансфераза 15 (связанная с GCN5, предположительно) |
Ссылки
[ редактировать ]- ^ Эванс Д.А. (1989). «N-ацетилтрансфераза». Фармакология и терапия . 42 (2): 157–234. дои : 10.1016/0163-7258(89)90036-3 . ПМИД 2664821 .
- ^ Ма Ю, Гошдастидер У, Ван Дж, Йе В, Дётч В, Филипек С, Бернхард Ф, Ван Х (2012). «Бесклеточная экспрессия человеческой глюкозамин-6-фосфат-N-ацетилтрансферазы (HsGNA1) для скрининга ингибиторов». Экспр. белка Пуриф . 86 (2): 120–6. дои : 10.1016/j.pep.2012.09.011 . ПМИД 23036358 .
- ^ Jump up to: а б Сим, Эдит ; Недостаток, Натан; Ван, Чан-Джу; и др. (май 2008 г.). «Ариламин-N-ацетилтрансферазы: структурные и функциональные последствия полиморфизмов». Токсикология . 254 (3): 170–183. дои : 10.1016/j.tox.2008.08.022 . ПМИД 18852012 .
- ^ Jump up to: а б с д и ж г Клаассен, Кертис Д. (2008). Токсикология Казаретта и Дулла: фундаментальная наука о ядах, 7-е изд . МакГроу-Хилл. ISBN 978-0071470513 .
- ^ Jump up to: а б с д и ж г час Минчин, Родни Ф.; Невилл, Батчер Дж. (апрель 2015 г.). «Роль лизина 100 в связывании ацетилкоэнзима А с ариламин-N-ацетилтрансферазой 1 человека: значение для других ацетилтрансфераз» (PDF) . Биохимическая фармакология . 94 (3): 195–202. дои : 10.1016/j.bcp.2015.01.015 . ПМИД 25660616 .
- ^ Вебер, WW; Коэн, С.Н.; Стейнберг, М.С. (1968). «Очистка и свойства N-ацетилтрансферазы из печени млекопитающих». Энн, Нью-Йоркская академия наук . 151 (2): 734–741. дои : 10.1111/j.1749-6632.1968.tb11934.x . ПМИД 4984197 . S2CID 44602517 .
- ^ Jump up to: а б Вествуд, ИМ; Кавамура, А.; Фуллам, Э.; и др. (2006). «Структура и механизм ариламин-N-ацетилтрансфераз». Актуальные темы медицинской химии . 6 (15): 1641–1654. дои : 10.2174/156802606778108979 . ПМИД 16918475 .
- ^ Синклер, Дж. К.; Сэнди, Дж.; Дельгода, Р.; Сим, Э .; Благородный, Мэн (2000). «Структура ариламин N-ацетилтрансферазы демонстрирует каталитическую триаду». Структурная биология природы . 7 (7): 560–564. дои : 10.1038/76783 . ПМИД 10876241 . S2CID 23694257 .
- ^ Jump up to: а б Грант, DM; Блюм, М.; Мейер, ЮА (1992). «Полиморфизмы генов N-ацетилтрансферазы». Ксенобиотика . 22 (9–10): 1073–1081. дои : 10.3109/00498259209051861 . ПМИД 1441598 .
- ^ Jump up to: а б Вацис, КП; Вебер, WW; Белл, Д.А. (1995). «Номенклатура N-ацетилтрансфераз». Фармакогенетика . 5 (1): 1–17. дои : 10.1097/00008571-199502000-00001 . ПМИД 7773298 .
- ^ Jump up to: а б Рагунатан, Нилуша; Дайру, Жюльен; Пульвинаж, Бенджамин; и др. (июнь 2008 г.). «Идентификация фермента, метаболизирующего ксенобиотики, ариламин N-ацетилтрансферазы 1 как новой мишени цисплатина в клетках рака молочной железы: молекулярные и клеточные механизмы ингибирования». Молекулярная фармакология . 73 (6): 1761–1768. дои : 10.1124/моль.108.045328 . ПМИД 18310302 . S2CID 9214220 .
- ^ Сим, Э .; Абухаммад, А.; Райан, А. (май 2014 г.). «Ариламин-N-ацетилтрансферазы: от метаболизма лекарств и фармакогенетики к открытию лекарств» . Бр Джей Фармакол . 171 (11): 2705–2725. дои : 10.1111/bph.12598 . ПМК 4158862 . ПМИД 24467436 .
- ^ Jump up to: а б с д и ж г час Лаурери, Никола; Сим, Эдит (2018). Ариламин-N-ацетилтрансферазы в здоровье и болезнях: от фармакогенетики к открытию и диагностике лекарств . Всемирная научная. ISBN 9789813232006 .
- ^ Кампорес, Жоау Паулу; Ван, Юнлян; Фааркрог, Каспер; и др. (декабрь 2017 г.). «Механизм, с помощью которого абляция ариламин N-ацетилтрансферазы 1 вызывает резистентность к инсулину у мышей» . ПНАС . 114 (52): Е11285–Е11292. дои : 10.1073/pnas.1716990115 . ПМЦ 5748223 . ПМИД 29237750 .
- ^ МакДонах, EM; и др. (2014). «Краткий обзор ФармГКБ: очень важная информация о фармакогене N-ацетилтрансферазы 2» . Фармакогенет. Геномика . 24 (8): 409–425. дои : 10.1097/FPC.0000000000000062 . ПМК 4109976 . ПМИД 24892773 .
- ^ Эванс, Д.А.; Уайт, Т. А. (1964). «Полиморфизм ацетилирования человека». Дж. Лаб. Клин. Мед . 63 : 394–403. ПМИД 14164493 .
- ^ Хейн, Д.В.; Кукла, Массачусетс (2012). «Точность различных панелей генотипирования SNP человека NAT2 для определения фенотипов быстрого, промежуточного и медленного ацетилатора» . Фармакогеномика . 13 (1): 31–41. дои : 10.2217/стр.11.122 . ПМЦ 3285565 . ПМИД 22092036 .
- ^ Jump up to: а б с д Раджасекаран, М.; Абирами, Сантанам; Чен, Чинпан (2011). «Влияние однонуклеотидных полиморфизмов на структуру и динамику N-ацетилтрансферазы 2 человека с помощью молекулярно-динамического моделирования» . ПЛОС ОДИН . 6 (9): e25801. Бибкод : 2011PLoSO...625801R . дои : 10.1371/journal.pone.0025801 . ПМК 3183086 . ПМИД 21980537 .
- ^ Хейн, Д.В. (2000). «Молекулярная генетика и эпидемиология полиморфизмов ацетилирования NAT1 и NAT2». Эпидемиол рака. Биомаркеры Пред . 9 (1): 29–42. ПМИД 10667461 .
- ^ Уолрейвен, Джейсон М.; Трент, Джон О.; Хейн, Дэвид В. (2008). «Структурно-функциональный анализ однонуклеотидных полиморфизмов в N-ацетилтрансферазе 1 человека» . Обзоры метаболизма лекарств . 40 (1): 169–184. дои : 10.1080/03602530701852917 . ПМК 2265210 . PMID 18259988 – через Informa Healthcare.
- ^ Унисса, Амеруддин Нусрат; Суббиан, Сельвакумар; Ханна, Люк Элизабет; Сельвакумар, Нагамия (2016). «Обзор механизмов действия и устойчивости к изониазиду микобактерий туберкулеза». Инфекция, генетика и эволюция . 45 : 474–492. дои : 10.1016/j.meegid.2016.09.004 . ПМИД 27612406 .
- ^ Патин, Э.; Баррейро, LB; Сабети, ПК; и др. (2006). «Расшифровка древней и сложной истории эволюции генов ариламин-N-ацетилтрансферазы человека» . Ам Джей Хум Жене . 78 (3): 423–436. дои : 10.1086/500614 . ПМК 1380286 . ПМИД 16416399 .