Рак мочевого пузыря
| Рак мочевого пузыря | |
|---|---|
 | |
| Переходноклеточный рак мочевого пузыря. Белый цвет в мочевом пузыре контрастен. | |
| Специальность | Онкология , урология |
| Симптомы | Кровь в моче , боль при мочеиспускании [1] |
| Обычное начало | от 65 до 84 лет [2] |
| Типы | Переходно-клеточная карцинома , плоскоклеточный рак , аденокарцинома [1] |
| Факторы риска | Курение , семейный анамнез, предшествующая лучевая терапия , частые инфекции мочевого пузыря , некоторые химические вещества. [1] |
| Diagnostic method | Cystoscopy with tissue biopsies[1] |
| Treatment | Surgery, radiation therapy, chemotherapy, immunotherapy[1] |
| Prognosis | Five-year survival rates ~77% (US)[2] |
| Frequency | 549,000 new cases (2018)[3] |
| Deaths | 200,000 (2018)[3] |
Рак мочевого пузыря – это любой из нескольких типов рака, возникающего из тканей мочевого пузыря . [1] Симптомы включают кровь в моче , боль при мочеиспускании и боль в пояснице. [1] Это заболевание возникает, когда эпителиальные клетки , выстилающие мочевой пузырь, становятся злокачественными. [4]
Факторы риска рака мочевого пузыря включают курение , семейный анамнез, предшествующую лучевую терапию , частые инфекции мочевого пузыря и воздействие определенных химических веществ. [1] Наиболее распространенным типом является переходно-клеточная карцинома . [1] Другие типы включают плоскоклеточный рак и аденокарциному . [1] Диагноз обычно ставится с помощью цистоскопии с биопсией тканей . [5] Стадию рака определяют с помощью трансуретральной резекции и медицинской визуализации . [1] [6] [7]
Лечение зависит от стадии рака . [1] Оно может включать в себя некоторую комбинацию хирургического вмешательства, лучевой терапии, химиотерапии или иммунотерапии . [1] Хирургические варианты могут включать трансуретральную резекцию, частичное или полное удаление мочевого пузыря или отведение мочи . [1] Типичная пятилетняя выживаемость в США составляет 77%, в Канаде — 75% и в Европе — 68%. [2] [8] [9]
Bladder cancer, as of 2018, affected about 1.6 million people globally with 549,000 new cases and 200,000 deaths.[3] Age of onset is most often between 65 and 84 years of age.[2] Males are more often affected than females.[2] In 2018, the highest rate of bladder cancer occurred in Southern and Western Europe followed by North America with rates of 15, 13, and 12 cases per 100,000 people.[3] The highest rates of bladder cancer deaths were seen in Northern Africa and Western Asia followed by Southern Europe.[3]
Signs and symptoms[edit]
The most common symptom of bladder cancer is visible blood in the urine (haematuria) despite painless urination. This affects around 75% of people eventually diagnosed with the disease.[10] Some instead have "microscopic haematuria" – small amounts of blood in the urine that can only be seen under a microscope during urinalysis – pain while urinating, or no symptoms at all (their tumors are detected during unrelated medical imaging).[10][11] Most people with blood in the urine do not have bladder cancer; up to 22% of those with visible haematuria and 5% with microscopic haematuria are diagnosed with the disease.[10] Women with bladder cancer and haematuria are often misdiagnosed with urinary tract infections, delaying appropriate diagnosis and treatment.[11]
People with advanced disease may have pelvic or bony pain, lower-extremity swelling, or flank pain.[12] Rarely, a palpable mass can be detected on physical examination.[13]
Causes[edit]
Bladder cancer is caused by genetic damage to the DNA of bladder cells. These changes can be random, or can be induced by exposure of the bladder to toxic substances such as those from consuming tobacco. The accumulation of this genetic damage disrupts the normal functioning of bladder cells, causing them to grow uncontrollably and form a tumor.[14]
Smoking[edit]
Tobacco smoking is the main known contributor to urinary bladder cancer; in most populations, smoking is associated with over half of bladder cancer cases in men and one-third of cases among women,[15] however these proportions have reduced over recent years since there are fewer smokers in Europe and North America.[16] There is an almost linear relationship between smoking duration (in years), pack years and bladder cancer risk. A risk plateau at smoking about 15 cigarettes a day can be observed (meaning that those who smoke 15 cigarettes a day are approximately at the same risk as those smoking 30 cigarettes a day). Smoking in any form (cigar, cigarette, pipe, Egyptian waterpipe and smokeless tobacco) increases the risk for bladder cancer.[17] Quitting smoking reduces the risk. Risk of bladder cancer decreases by 30% within 1–4 years and continues to decrease by 60% at 25 years after smoking cessation.[18] However, former smokers will most likely always be at a higher risk of bladder cancer compared to people who have never smoked.[16] Passive smoking also appears to be a risk.[19][20]
Opium consumption increases the risk of bladder cancer threefold, while concurrent use of opium and tobacco increases the risk of bladder cancer fivefold when compared to the general population.[21]
Occupational exposure[edit]
Thirty percent of bladder tumors probably result from occupational exposure in the workplace to carcinogens. Occupational or circumstantial exposure to the following substances has been implicated as a cause of bladder cancer; benzidine (dyes manufacturing), 4-aminobiphenyl (rubber industry), 2-naphtylamine (azo dyes manufacturing, foundry fumes, rubber industry, cigarette smoke and cancer research), phenacetin (analgesic), arsenic and chlorinated aliphatic hydrocarbons in drinking water, auramine (dye manufacturing), magenta (dye manufacturing), ortho-toluidine (dye manufacturing), epoxy and polyurethane resin hardening agents (plastics industry), chlornaphazine, coal-tar pitch.[22][23][24][25][26] Occupations at risk are bus drivers, rubber workers, painters, motor mechanics, leather (including shoe) workers, blacksmiths, machine setters, and mechanics.[27][28] Hairdressers are thought to be at risk as well because of their frequent exposure to permanent hair dyes.[29]
Infection[edit]
Infection with Schistosoma haematobium (bilharzia or schistosomiasis) may cause bladder cancer, particularly of the squamous cell type.[30] Schistosoma eggs induces a chronic inflammatory state in the bladder wall resulting in tissue fibrosis.[31] Higher levels of N-nitroso compounds has been detected in urine samples of people with schistosomiasis.[32] N-Nitroso compounds have been implicated in the pathogenesis of schistosomiasis related bladder cancer. They cause alkylation DNA damage, specially Guanine to Adenine transition mutations in the HRAS and p53 tumor suppressor gene.[33] Mutations of p53 are detected in 73% of the tumors, BCL-2 mutations accounting for 32% and the combination of the two accounting for 13%.[34] Other causes of squamous cell carcinoma of the bladder include chronic catheterizations in people with a spinal cord injury and history of treatment with cyclophosphamide.[35][36]
Diet[edit]
The American Institute for Cancer Research have stated that there is strong evidence that drinking water containing arsenic increases the risk of bladder cancer.[37]
High consumption of animal fat and dietary cholesterol increases bladder cancer risk in men.[38]
Ingestion of aristolochic acid present in many Chinese herbal medications has been shown to cause urothelial carcinoma and kidney failure.[39] Aristolochic acid activates peroxidase in the urothelium and causes transversion mutation in the TP53 tumor suppressor gene.[citation needed]
Other[edit]
People who undergo external beam radiotherapy (EBRT) for prostate cancer have a higher risk of developing invasive bladder cancer.[40]
In addition to these major risk factors there are also numerous other modifiable factors that are less strongly (i.e. 10–20% risk increase) associated with bladder cancer, for example, obesity.[41] Although these could be considered as minor effects, risk reduction in the general population could still be achieved by reducing the prevalence of a number of smaller risk factor together.[42]
Genetics[edit]
Mutations in FGFR3, TP53, PIK3CA, KDM6A, ARID1A, KMT2D, HRAS, TERT, KRAS, CREBBP, RB1 and TSC1 genes may be associated with some cases of bladder cancer.[43][44][45] Deletions of parts or whole of chromosome 9 is common in bladder cancer.[46] Low grade cancer are known to harbor mutations in RAS pathway and the fibroblast growth factor receptor 3 (FGFR3) gene, both of which play a role in the MAPK/ERK pathway. p53 and RB gene mutations are implicated in high-grade muscle invasive tumors.[47] Eighty nine percent of muscle invasive cancers have mutations in chromatin remodeling and histone modifying genes.[48]Deletion of both copies of the GSTM1 gene has a modest increase in risk of bladder cancer. GSTM1 gene product glutathione S-transferase M1 (GSTM1) participates in the detoxification process of carcinogens such as polycyclic aromatic hydrocarbons found in cigarette smoke.[49] Similarly, mutations in NAT2 (N-acetyltransferase) is associated with increased risk for bladder cancer. N-acetyltransferase helps in detoxification of carcinogens like aromatic amines (also present in cigarette smoke).[50] Various single-nucleotide polymorphisms in PSCA gene present on chromosome 8 have shown to increase the risk for bladder cancer. PSCA gene promoter region has an androgen response region. Loss of reactivity of this region to androgens is hypothesized as a cause of more aggressive tumors in women (unlike in men who have higher amount of androgen).[51]
Muscle invasive bladder cancer are heterogeneous in nature. In general, they can be genetically classified into basal and luminal subtypes. Basal subtype show alterations involving RB and NFE2L2 and luminal type show changes in FGFR3 and KDM6A genes.[52] Basal subtype are subdivided into basal and claudin low-type group and are aggressive and show metastasis at presentation, however they respond to platinum based chemotherapy. Luminal subtype can be subdivided into p53-like and luminal. p53-like tumors of luminal subtype although not as aggressive as basal type, show resistance to chemotherapy[53]
Diagnosis[edit]
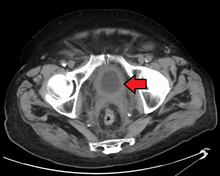
Currently, the best diagnosis of the state of the bladder is by way of cystoscopy, which is a procedure in which a flexible or rigid tube (called a cystoscope) bearing a camera and various instruments is inserted into the bladder through the urethra. The flexible procedure allows for a visual inspection of the bladder, for minor remedial work to be undertaken and for samples of suspicious lesions to be taken for a biopsy. A rigid cystoscope is used under general anesthesia in the operating room and can support remedial work and biopsies as well as more extensive tumor removal. Unlike papillary lesion, which grow into the bladder cavity and are readily visible, carcinoma in situ lesion are flat and obscure. Detection of carcinoma in situ lesions requires multiple biopsies from different areas of interior bladder wall.[54] Photodynamic detection (blue light cystoscopy) can aid in the detection of carcinoma in situ. In photodynamic detection, a dye is instilled into the bladder with the help of a catheter. Cancer cells take up this dye and are visible under blue light, providing visual clues on areas to be biopsied or resected.[55]
However, visual detection in any form listed above, is not sufficient for establishing pathological classification, cell type or the stage of the present tumor. A so-called cold cup biopsy during an ordinary cystoscopy (rigid or flexible) will not be sufficient for pathological staging either. Hence, a visual detection needs to be followed by transurethral surgery. The procedure is called transurethral resection of bladder tumor (TURBT). Further, a rectal and vaginal bimanual examination should be carried out before and after the TURBT to assess whether there is a palpable mass or if the tumour is fixed ("tethered") to the pelvic wall. The pathological classification and staging information obtained by the TURBT-procedure, is of fundamental importance for making the appropriate choice of ensuing treatment and/or follow-up routines.[56]
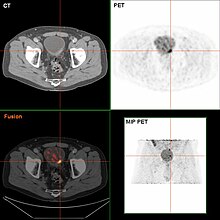
If invasive or high grade (includes carcinoma in situ) cancer is detected on TURBT, an MRI and/or CT scan of the abdomen and pelvis or urogram and CT chest should be conducted for disease staging and to look for cancer spread (metastasis).[57] Increase in alkaline phosphatase levels without evidence of liver disease should be evaluated for bone metastasis by a bone scan.[58] Although 18F-fluorodeoxyglucose (FDG)-positron emission tomography (PET)/CT has been explored as a viable method for staging, there is no consensus to support its role in routine clinical evaluations.[55]
Urine cytology can be obtained in voided urine or at the time of the cystoscopy ("bladder washing"). Cytology is not very sensitive for low-grade or grade 1 tumors (a negative result cannot reliably exclude bladder cancer) but has a high specificity (a positive result reliably detects bladder cancer).[59] There are newer non-invasive urine bound markers available as aids in the diagnosis of bladder cancer, including human complement factor H-related protein, high-molecular-weight carcinoembryonic antigen, and nuclear matrix protein 22 (NMP22).[60] In United States the FDA has approved NMP22, NMP22 BladderChek, and UroVysion tests for detection and surveillance of bladder cancer and ImmunoCyt, BTA-TRAK, and BTA-STAT tests have been approved for surveillance only. BTA-STAT and BladderChek can be performed in the clinic and others are done in the laboratory.[61][62] Other non-invasive urine based tests include the CertNDx Bladder Cancer Assay, which detects FGFR3 mutation and Urine Bladder Cancer test (UBC), which is a sandwich ELISA for Cytokeratin 8/18 fragment. Likewise, NMP22 is a sandwich ELISA and NMP22 BladderChek is a dipstick immunoassay, both of them detect nuclear mitotic apparatus protein (NuMA) tumor marker (a type of nuclear matrix protein).[63] UroVysion is a fluorescence in situ hybridization which detects aneuploidy in chromosomes 3, 7, 17 and loss of the 9p21 locus.[64][65] ImmunoCyt is an Immunofluorescence test which detects glycosylated CEA and MUCIN-like antigens (M344, LDQ10, 19A11).[63][64] BTA-STAT is a dipstick immunoassay for detection of human complement factor H-related protein. BTA-TRAK is a sandwich ELISA which also detects human complement factor H-related protein.[63] Sensitivities across biomarkers ranged from 0.57 to 0.82 and specificities from 0.74 to 0.88. Biomarkers fared better when used in combination with urine cytology than when used alone. However, detection accuracy is poor for low grade cancers and 10% cancers are still missed.[61] Current guidelines do not recommended using urinary biomarkers for detection and surveillance.[66]
Classification[edit]

| Type | Relative incidence | Subtypes |
|---|---|---|
| Transitional cell carcinoma | 95%[67][68] | Papillary (70%[67]) |
| Non-papillary (30%[67]) | ||
| Non-transitional cell carcinoma | 5% [67][68] | Squamous cell carcinomas, adenocarcinomas, sarcomas, small cell carcinomas, and secondary deposits from cancers elsewhere in the body.[68] |
Non-papillary carcinoma includes carcinoma in situ (CIS), microinvasive carcinoma and frankly invasive carcinoma.[69] Carcinoma in situ (CIS) invariably consists of cytologically high-grade tumour cells.[70]
Transitional cell carcinoma can undergo differentiation (25%) into its variants.[69][71][72] When seen under a microscope, papillary transitional cell carcinoma can present in its typical form or as one of its variations (squamous, glandular differentiation or micropapillary variant). Different variations of non-papillary transitional cell carcinoma are listed below.
| Variant | Histology | Percentage of non-papillary cases | Implications[73] |
|---|---|---|---|
| Squamous differentiation | Presence of intercellular bridges or keratinization | 60% | Outcomes similar to conventional transitional cell carcinoma |
| Glandular differentiation | Presence of true glandular spaces | 10% | |
| Sarcomatoid foci | Presence of both epithelial and mesenchymal differentiation | 7% | Clinically aggressive[74] |
| Micropapillary variant | Resembles papillary serous carcinoma of the ovary or resembling micropapillary carcinoma of breast or lung[75] | 3.7% | Clinically aggressive, early cystectomy recommended |
| Urothelial carcinoma with small tubules and microcystic form | Presence of cysts with a size range of microscopic to 1-2mm | Rare | |
| Lymphoepithelioma-like carcinoma | Resembles lymphoepithelioma of the nasopharynx | ||
| Lymphoma-like and plasmacytoid variants | Malignant cells resemble cells of malignant lymphoma or plasmacytoma | ||
| Nested variant | Histologically look similar to von Brunn's nests | Can be misdiagnosed as benign von Brunn's nests or non-invasive low-grade papillary urothelial carcinoma | |
| Urothelial carcinoma with giant cells | Presence of epithelial tumour giant cells and looks similar to giant cell carcinoma of the lung | ||
| Trophoblastic differentiation | Presence of syncytiotrophoblastic giant cells or choriocarcinomatous differentiation, may express HCG | ||
| Clear cell variant | Clear cell pattern with glycogen-rich cytoplasm | ||
| Plasmacytoid | Cells with abundant lipid content, mimic signet ring cell adenocarcinoma of stomach/ lobular breast cancer | Clinically aggressive, propensity for peritoneal spread | |
| Unusual stromal reactions | Presence of following; pseudosarcomatous stroma, stromal osseous or cartilaginous metaplasia, osteoclast-type giant cells, lymphoid infiltrate |
Staging[edit]
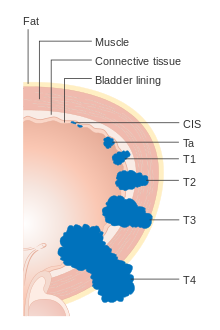


Bladder cancer is staged (classified by the extent of spread of the cancer) and graded (how abnormal and aggressive the cells appear under the microscope) to determine treatment and predict outcomes. Staging is usually performed with transurethral resection of bladder tumor (TURBT) and radiologic imaging (CT and MRI). Papillary tumors confined to the mucosa or which invade the lamina propria are classified as Ta or T1. Flat lesions that do not invade the basement membrane of the bladder mucosa are termed Tis (in situ). All three categories (Tis, Ta and T1) are grouped together as non-muscle invasive disease for therapeutic purposes and in most cases they are offered cystoscopic resection with TURBT without the need for radical resection of the entire urinary bladder. Tumors in the remaining categories (T2, T3 and T4) are termed muscle-invasive disease and are associated with less favorable prognosis.[57]
In the TNM staging system (8th Edn. 2017) for bladder cancer:[76][77]
T (Primary tumour)
- TX Primary tumour cannot be assessed
- T0 No evidence of primary tumour
- Ta Non-invasive papillary carcinoma
- Tis Carcinoma in situ ('flat tumour')
- T1 Tumour invades subepithelial connective tissue
- T2a Tumour invades superficial muscle (inner half of the detrusor muscle)[78]
- T2b Tumour invades deep muscle (outer half of the detrusor muscle)[78]
- T3 Tumour invades perivesical tissue:
- T3a Microscopically
- T3b Macroscopically (extravesical mass)
- T4a Tumour invades prostate, uterus or vagina
- T4b Tumour invades pelvic wall or abdominal wall
N (Lymph nodes)
- NX Regional lymph nodes cannot be assessed
- N0 No regional lymph node metastasis
- N1 Metastasis in a single lymph node in true pelvis (hypogastric, obturator, external iliac, or presacral nodes)
- N2 Metastasis in multiple lymph nodes in true pelvis (hypogastric, obturator, external iliac, or presacral nodes)
- N3 Metastasis in common iliac lymph nodes
M (Distant metastasis)
- MX Distant metastasis cannot be assessed
- M0 No distant metastasis
- M1 Distant metastasis.
- M1a: The cancer has spread only to lymph nodes outside of the pelvis.
- M1b: The cancer has spread other parts of the body.
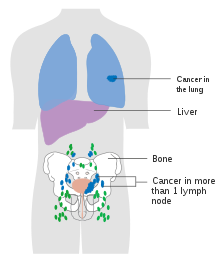
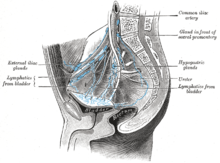
The most common sites for bladder cancer metastases are the lymph nodes, bones, lung, liver, and peritoneum.[79] The most common sentinel lymph nodes draining bladder cancer are obturator and internal iliac lymph nodes. The location of lymphatic spread depends on the location of the tumors. Tumors on the superolateral bladder wall spread to external iliac lymph nodes. Tumors on the neck, anterior wall and fundus spread commonly to the internal iliac lymph nodes.[80] From the regional lymph nodes (i.e. obturator, internal and external lymph nodes) the cancer spreads to distant sites like the common iliac lymph nodes and paraaortic lymph nodes.[81] Skipped lymph node lesions are not seen in bladder cancer.[80]
Numerical
The stages above can be integrated into a numerical staging (with Roman numerals) as follows:[82]
| Stage | Tumor | Nodes | Metastasis | 5-year survival in the US[83] |
|---|---|---|---|---|
| Stage 0a | Ta | N0 | M0 | 98% |
| Stage 0is | Tis | N0 | M0 | 95% |
| Stage I | T1 | N0 | M0 | 63% |
| Stage II | T2a | N0 | M0 | |
| T2b | ||||
| Stage IIIA | T3a | N0 | M0 | 35% |
| T3b | ||||
| T4a | ||||
| T1-4a | N1 | |||
| Stage IIIB | T1-4a | N2 | M0 | |
| N3 | ||||
| Stage IVA | T4b | Any N | M0 | |
| Any T | M1a | |||
| Stage IVB | Any T | Any N | M1b | 5% |
Grading[edit]
According to WHO classification (1973) bladder cancers are histologically graded into:[84]
- G1 – Well differentiated,
- G2 – Moderately differentiated
- G3 – Poorly differentiated
WHO classification (2004/2016)[85][86]
- Papillary lesions
- Urothelial Papilloma
- Papillary urothelial neoplasm of low malignant potential (PUNLMP)
- Low Grade
- High Grade
- Flat lesions
- Urothelial proliferation of uncertain malignant potential
- Reactive atypia
- Atypia of unknown significance
- Urothelial dysplasia
- Urothelial CIS (always high grade)
- Primary
- Secondary
- Concurrent
Risk stratification[edit]
People with non-muscle invasive bladder cancer (NMIBC), are risk-stratified based on clinical and pathological factors so that they are treated appropriately depending on their probability of having progression and/or recurrence.[87] People with non-muscle invasive tumors are categorized into low-risk, intermediate-risk and high-risk or provided with a numerical risk score. Risk-stratification framework is provided by American Urology Association/Society of Urological Oncology (AUA/SUO stratification), European Association of Urology (EAU) guidelines, European Organization for Research and Treatment of Cancer (EORTC) risk tables and Club Urológico Español de Tratamiento Oncológico (CUETO) scoring model.[88][89][90]
| Low risk | Intermediate risk | High risk |
|---|---|---|
| Low grade solitary Ta tumor, smaller than 3 cm | Recurrence within 1 year, Low grade Ta tumor | High grade T1 |
| Papillary urothelial neoplasm of low malignant potential | Solitary low grade Ta tumor, bigger than 3 cm | Any recurrent tumor or any high grade Ta |
| Low grade Ta, multifocal tumors | High grade Ta, bigger than 3 cm (or multifocal) | |
| High grade Ta, smaller than 3 cm | Any carcinoma in situ | |
| Low grade T1 | Any BCG failure in high grade tumors | |
| Any variant histology | ||
| Any lymphovascular invasion | ||
| Any high grade prostatic urethral involvement |
The EORTC and CUETO model use a cumulative score obtained from individual prognostic factors, which are then converted into risk of progression and recurrence. The six prognostic factors included in the EORTC model are number of tumors, recurrence rate, T-stage, presence of carcinoma-in-situ and grade of the tumor. Scoring for recurrence in the CUETO model incorporates 6 variables; age, gender, grade, tumor status, number of tumors and presence of tis. For progression scoring the previous 6 variables plus T stage is used.[91][92]
| Model | Cumulative score for recurrence | Recurrence at 1-year (%) | Recurrence at 5-year (%) |
|---|---|---|---|
| EORTC | 0 | 15 | 31 |
| 1-4 | 24 | 46 | |
| 5-9 | 38 | 62 | |
| 10-17 | 61 | 78 | |
| CUETO | 0-4 | 8.2 | 21 |
| 5-6 | 12 | 36 | |
| 7-9 | 25 | 48 | |
| 10-16 | 42 | 68 |
| Model | Cumulative score for progression | Progression at 1-year (%) | Progression at 5-year (%) |
|---|---|---|---|
| EORTC | 0 | 0.2 | 0.8 |
| 2-6 | 1 | 6 | |
| 7-13 | 5 | 17 | |
| 12-23 | 17 | 45 | |
| CUETO | 0-4 | 1.2 | 3.7 |
| 5-6 | 3 | 12 | |
| 7-9 | 5.5 | 21 | |
| 10-16 | 14 | 34 |
Prevention[edit]
Diet[edit]
As of 2019, there is limited high level evidence to suggest that eating vegetable and fruits decreases the risk of bladder cancer.[50] Fruit and yellow-orange vegetables, particularly carrots and those containing selenium, citrus fruits and cruciferous vegetables have been identified as having a possibly protective effect.
While it is suggested that the polyphenol compounds in tea may have an inhibitory effect on bladder tumor formation and growth, there is limited evidence to suggesting drinking tea decreases bladder cancer risk.[50] A 2022 review found that a Mediterranean diet has a protective effect on bladder cancer risk.[95] Higher consumption of monounsaturated fat and plant-based oils decrease bladder cancer risk in women.[38] Higher consumption of total dietary fiber and whole grains is associated with a reduced risk of bladder cancer.[96]
Screening[edit]
As of 2019 there is insufficient evidence to determine if screening for bladder cancer in people without symptoms is effective or not.[97]
Treatment[edit]
The treatment of bladder cancer depends on how deeply the tumor invades into the bladder wall.[citation needed]
Treatment strategies for bladder cancer include:[98][99]
- Non-muscle invasive: transurethral resection of bladder tumor (TURBT) with or without intravesical chemotherapy or immunotherapy
- Muscle invasive
- Stage II/Stage IIIA: radical cystectomy plus neoadjuvant chemotherapy (multimodal therapy, preferred) or transurethral resection with chemoradiation (trimodal therapy, highly selected people) or partial cystectomy plus neoadjuvant chemotherapy (in highly selected people)
- Stage IIIB/IVA: cisplatin-based chemotherapy followed by radical cystectomy or chemoradiation or observation depending on treatment response
- Stage IVB (locally advanced; unresectable tumors): palliative radiotherapy
- Metastatic disease: cisplatin-based chemotherapy
- Metastatic disease but unfit for cisplatin-based chemotherapy: carboplatin-based chemotherapy
- Metastatic disease with contraindication for chemotherapy: checkpoint inhibitors if programmed death ligand 1 (PD L1) positive
- Squamous cell carcinoma or adenocarcinoma of bladder: radical cystectomy
Non-muscle invasive[edit]
Transurethral resection[edit]
Non-muscle invasive bladder cancer (those not entering the muscle layer of the bladder) can be "shaved off" using an electrocautery device attached to a cystoscope, which in that case is called a resectoscope. The procedure is called transurethral resection of bladder tumor (TURBT) and serves primarily for pathological staging. In case of non-muscle invasive bladder cancer the TURBT is in itself the treatment, but in case of muscle invasive cancer, the procedure is insufficient for final treatment.[56] Additionally, blue light cystoscopy with optical-imaging agent Hexaminolevulinate (HAL) is recommended at initial TURBT to increase lesion detection (especially carcinoma in situ) and improve resection quality thereby reducing recurrence.[100][101] It is important to assess the quality of the resection: if there is evidence of incomplete resection, or if there is no muscle in the specimen (without which muscle invasiveness cannot be determined), then a second TURBT is strongly recommended. Moreover, nearly half of the people with high-grade noninvasive disease have residual tumor after primary TURBT; in such cases a second TURBT is important for avoiding under-staging.[102][103] At this point classifying people into risk groups is recommended. Treatment and surveillance for different risk groups is indicated in the table below.[citation needed]
Another method for reducing recurrence of tumors is medication after TURBT surgery. The two most common medicines used for this purpose are Bacillus Calmette–Guérin (BCG) and mitomycin.[104] For people who have already had a TURBT procedure, BCG may lead to similar risk of death and may reduce the risk of tumor recurrence.[104] However, this medication may increase the risk of serious unwanted side effects.[104] More research is needed to confirm these results.
Chemotherapy[edit]
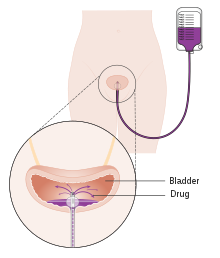
A single instillation of chemotherapy into the bladder after primary TURBT has shown benefit in deceasing recurrence by 35% in non-muscle invasive disease.[105] Medications which can be used for this purpose are mitomycin C (MMC), epirubicin, pirarubicin and gemcitabine. Instillation of post-operative chemotherapy should be conducted within first few hours after TURBT. As time progress residual tumor cells are known to adhere firmly and are covered by extracellular matrix which decrease the efficacy of the instillation.[103] The most common side effect is chemical cystitis and skin irritation.[105] If there is a suspicion of bladder perforation during TURBT, chemotherapy should not be instilled into the bladder as serious adverse events are known to occur due to drug extravasation. Studies have shown that efficacy of chemotherapy is increased by the use of Device assisted chemotherapy .[106] These technologies use different mechanisms to facilitate the absorption and action of a chemotherapy drug instilled directly into the bladder. Another technology – electromotive drug administration (EMDA) – uses an electric current to enhance drug absorption after surgical removal of the tumor.[107][108] Another technology, thermotherapy, uses radio-frequency energy to directly heat the bladder wall, which together with chemotherapy (chemohyperthermia) shows a synergistic effect, enhancing each other's capacity to kill tumor cells.[109]
Immunotherapy[edit]

Immunotherapy by Bacillus Calmette–Guérin (BCG) delivery into the bladder is also used to treat and prevent the recurrence of NMIBC.[110] BCG is a vaccine against tuberculosis that is prepared from attenuated (weakened) live bovine tuberculosis bacillus, Mycobacterium bovis, that has lost its virulence in humans. BCG immunotherapy is effective in up to 2/3 of the cases at this stage, and in randomized trials has been shown to be superior to standard chemotherapy.[111] The exact mechanism by which BCG prevents recurrence is unknown. However, it has been shown that the bacteria are taken up by the cancer cells.[112] The infection of these cells in the bladder may trigger a localized immune reaction which clears residual cancer cells.[113][114]
BCG is delivered as induction and a maintenance course. The induction course consists of 6-week course of intravesical and percutaneous BCG.[115] This is followed by a maintenance course. There is no consensus regarding the maintenance schedule, however the most commonly followed is the Southwestern Oncology Group (SWOG) schedule.[116] The SWOG maintenance schedule consists of intravesical and percutaneous BCG every week for 3 weeks given at 3, 6, 12, 18, 24, 30 and 36 months.[115] Three weekly maintenance regimen with induction has shown complete response rate of 84% compared to 69% in people who received 6-week induction BCG only at 6 months. Many studies have explored alternate treatment schedules and regimes of BCG but has shown no clinical significance.[115] Efficacy of different strains of BCG (Connaught, TICE, Pasteur, Tokio-172) has been shown not to be different however, there is no high-level evidence.[117]
Side effects of BCG therapy include cystitis, prostatitis, epididymo-orchitis, balanitis, ureteral obstruction, bladder contraction, mycobacterial osteomyelitis, reactive arthritis, mycobacterial pneumonia, granulomatous hepatitis, granulomatous nephritis, interstitial nephritis, infectious vasculitis and disseminated infection.[118][119]
Local infection (i.e. prostatitis, epididymo-orchitis, balanitis) because of BCG should be treated with triple tubercular therapy, with one of the drug being fluoroquinolone for 3 to 6 months. In people with systemic infections, BCG therapy should be stopped and anti-tubercular multidrug treatment for at-least 6 months should be started. Medications that can be used for this treatment are INH, rifampicin, ethambutol, fluoroquinolones, clarithromycin, aminoglycosides, and doxycycline. BCG strains are not sensitive to pyrazinamide therefore, it should not be a part of anti-tubercular treatment.[120]
Nogapendekin alfa inbakicept (Anktiva), used in combination with Bacillus Calmette-Guérin was approved for medical use in the United States in April 2024.[121]
BCG treatment failure[edit]
BCG treatment failure can be classified into 3 groups; BCG relapse, BCG-refractory and BCG-intolerant. In BCG relapse, tumor reoccurs after a disease free period. BCG-refractory tumors are the ones which do not respond to induction and maintenance doses of BCG or which progress during therapy. In BCG-intolerant, tumor reoccurs due to incomplete treatment as the person receiving it is unable to tolerate an induction course of BCG. Around 50% of the people fail BCG treatment and would require further treatment.[115]
People whose tumors recurred after treatment with BCG or who were unresponsive to treatment, are more difficult to treat.[122] In such people a radical cystectomy is recommendation[123][124] In people who do not show response to BCG therapy and are unfit or unwilling to undergo radical cystectomy, salvage therapies can be considered. Salvage therapy include intravesical chemotherapy with agents such as valrubicin, gemcitabine or docetaxel, chemoradiation or chemohyperthermia.[125]
| Risk | Other considerations | Chemotherapy | Immunotherapy (BCG) | Cystoscopy (surveillance) | Imaging (surveillance) |
|---|---|---|---|---|---|
| Low | at 3-months followed by cystoscopy at 12-months, then yearly for 5-years | CT/MR urography and CT/MRI of abdomen and pelvis at baseline | |||
| Intermediate | Primary tumor with history of chemotherapy | Intravesical chemotherapy for 1 year OR Intravesical BCG for 1 year (preferred) | at 3-months with cytology followed by once every 3–6 months for 5-years and then yearly | CT/MR urography and CT/MRI of abdomen and pelvis at baseline | |
| Recurrent tumors with history of previous chemotherapy | Intravesical BCG for 1 year | ||||
| High | Intravesical BCG for 3 year (as tolerated) | at 3-months with cytology followed by once every 3-months for 2-years after that, 6 monthly for 5 years then yearly | CT/MR urography and CT/MRI of abdomen and pelvis at baseline, CT/MR urography 1-2 yearly for 10 years | ||
| T1G3/High grade, Lymphovascular invasion, Presence of variant histology | Consider radical cystectomy | ||||
Photodynamic Therapy[edit]
Photodynamic therapy (PDT) is a treatment option involving the administration of a photosensitizing agent, followed by the exposure of the bladder’s inner lining to a specific wavelength of light through a cystoscope. The light activation of the photosensitizer helps to destroy cancerous cells while sparing much of the surrounding healthy tissue.[126][127]
PDT is particularly advantageous for patients who might be at high risk from surgery or those who prefer a less invasive option. The procedure is known for its precision and the ability to be repeated, which is important for managing the recurrent nature of NMIBC. Clinical trials and studies have shown that PDT can be effective in reducing tumor recurrence rates and is associated with a favorable safety profile, emphasizing its potential as a primary or adjuvant treatment modality.[128]
Research continues to evaluate the long-term outcomes of PDT for bladder cancer and explore potential improvements in photosensitizers and light delivery systems to enhance the treatment’s efficacy and patient outcomes.[129]
Muscle invasive[edit]

Multimodal therapy (standard treatment)[edit]
Untreated, non-muscle invasive tumors may gradually begin to infiltrate the muscular wall of the bladder (muscle invasive bladder cancer). Tumors that infiltrate the bladder wall require more radical surgery, where part (partial cystectomy) or all (radical cystectomy) of the bladder is removed (a cystectomy) and the urinary stream is diverted into an isolated bowel loop (called an ileal conduit or urostomy). In some cases, skilled surgeons can create a substitute bladder (a neobladder) from a segment of intestinal tissue, but this largely depends upon a person's preference, age of the person, renal function, and the site of the disease.[citation needed]
A bilateral pelvic lymphadenectomy should accompany radical cystectomy. At minimum, a standard template of lymphadenectomy should be followed by removing the external and internal iliac and obturator lymph node.[130] When performing a lymphadenectomy, the surgeon can either remove lymph nodes from a smaller (standard) or from larger (extended) area. In comparison with a standard lymph node dissection, having an extended dissection may reduce a person's likelihood of death from any reason, including dying from bladder cancer.[131] The extended procedure may lead to more serious unwanted effects and may or may not influence the likelihood of the cancer recurring over time.[131] The rate of not-so-serious side effects may be similar for both surgeries.[131]
Radical cystectomy has a significant morbidity associated with it. About 50-65% of the people experience complication within 90 days of surgery.[132][133] Mortality rates was 7% within 90 days of surgery. High volume centers have better outcomes than low volume centers.[134] Some centers are implementing Enhanced Recovery After Surgery (ERAS) society recommendations to decrease morbidity after radical cystectomy. However, due to lack of specific evidence in urologic surgery, ERAS protocol has not been widely incorporated in urologic clinical care.[135]
Even after surgical removal of bladder, 50% of the people with muscle invasive disease (T2-T4) develop metastatic disease within two years due to micrometastasis.[136] In such, neoadjuvant chemotherapy (chemotherapy before main treatment, i.e. surgery) has shown to increase overall survival at 5 years from 45% to 50% with an absolute survival benefit of 5%.[137][138][139] Currently the two most used chemotherapy regimens for neoadjuvant chemotherapy are platinum based; methotrexate, vinblastine, doxorubicin, cisplatin (MVAC) and gemcitabine with cisplatin (GC).[140] Other regimens include dose dense MVAC (DDMVC) and cisplatin, methotrexate and vinblastine (CMV).Although, the optimal regimen has not been established, the preferred regimen for neoadjuvant therapy is MVAC.[140]
Role of adjuvant chemotherapy (chemotherapy after main treatment) is limited to people with high grade tumours (pT3/T4and/or N+) and who have not been treated with neoadjuvant therapy.[130] Adjuvant radiation therapy has not shown any advantage in bladder cancer treatment.[141]
| MVAC | DDMVAC | Gemcitabine + cisplatin |
|---|---|---|
| Methotrexate (30 mg/m2 IV) - day 1,15,22 Vinblastine (3 mg/m2 IV) - day 2, 15, 22 Doxorubicin (30 mg/m2 IV) - day 2 Cisplatin (70 mg/m2 IV) - day 2 Repeat every 4 weeks for 3 cycles | Methotrexate (30 mg/m2 IV) - day 1 Vinblastine (3 mg/m2 IV) - day 2 Doxorubicin (30 mg/m2 IV) - day 2 Cisplatin (70 mg/m2 IV) - day 2 Granulocyte colony-stimulating factor (G-CSF) (240μg/m2 SC) - day 4-10 Repeat every 2 weeks for 3–4 cycles | Gemcitabine (1,000 mg/m2 IV) - day 1,8,15 Cisplatin (70 mg/m2) - day 2 Repeat every 4 weeks for 4 cycles |
Trimodal therapy (alternative treatment)[edit]
Комбинация лучевой и химиотерапии (химиолучевой терапии) в сочетании с трансуретральной (эндоскопической) резекцией опухоли мочевого пузыря может использоваться в качестве альтернативы у некоторых людей. [144] Обзор доступных больших серий данных по этой так называемой тримодальной терапии показал аналогичные долгосрочные показатели выживаемости, специфичные для рака, с улучшенным общим качеством жизни, как и у людей, перенесших радикальную цистэктомию с реконструкцией мочевой системы. Однако в настоящее время нет рандомизированных контролируемых исследований, в которых бы сравнивалась тримодальная терапия с радикальной цистэктомией. Люди, которые проходят тримодальную терапию, обычно тщательно отобраны и обычно имеют болезнь Т2 без гидронефроза и/или карциномы in-situ. [145] Пятилетняя выживаемость при раке и общая выживаемость после тримодальной терапии составляют от 50% до 82% и от 36% до 74%. [144]
При тримодальной терапии проводится максимальная ТУРБТ с последующей химиолучевой терапией. Используются схемы радиационно-сенсибилизирующей химиотерапии, состоящие из цисплатина или 5-флуроурацила и митомицина С. Лучевая терапия проводится посредством внешней лучевой терапии ( ДЛТ ) с целевой лечебной дозой 64-66 Гр. [146] Наблюдение за прогрессированием или рецидивом следует проводить с помощью компьютерной томографии , цистоскопии и цитологического исследования мочи. [130] Побочные эффекты химиолучевой терапии включают тошноту , рвоту , потерю аппетита , выпадение волос , язвы во рту , диарею , запор , повышенный риск инфекций, кровотечений и усталости. [147]
У людей, у которых тримодальная терапия оказалась неэффективной, рассматривается возможность радикальной цистэктомии, если есть мышечные инвазивные или рецидивирующие опухоли. Около 25-30% пациентов не справляются с лечением и подвергаются спасительной радикальной цистэктомии. [144] ТУРБТ с внутрипузырной терапией показана после неэффективности лечения немышечно-инвазивного заболевания. [130]
цистэктомия Частичная
У людей с одиночной опухолью без сопутствующей карциномы in situ в области, где можно добиться чистых хирургических границ, частичной цистэктомии с лимфаденэктомией можно рассмотреть возможность . План лечения, включающий частичную цистэктомию, должен сопровождаться неоадъювантной химиотерапией. [99] У людей с урахальной аденокарциномой мочевого пузыря единым блоком частичной цистэктомии с резекцией урахальной связки и пупка. можно рассмотреть возможность [148]
Метастатическое заболевание [ править ]
Лечение первой линии [ править ]
Комбинированная химиотерапия, содержащая цисплатин, является стандартом лечения метастатического мочевого пузыря. [149] Перед лечением оценивается пригодность к назначению химиотерапии на основе цисплатина. Человек считается недееспособным, если выполняется хотя бы одно из следующих утверждений. [150]
- Статус эффективности Восточной кооперативной онкологической группы — 2.
- Клиренс креатинина < 60 мл/мин
- Потеря слуха ≥ 2 степени
- ≥ 2 степени Невропатия
- Сердечная недостаточность III класса Нью-Йоркской кардиологической ассоциации
Люди, которые считаются пригодными, получают схемы лечения на основе платины; метотрексат , винбластин , доксорубицин с цисплатином (MVAC) или гемцитабин с цисплатином (GC). Альтернативные схемы включают паклитаксел с гемцитабином и цисплатином (PCG, тройная терапия) и цисплатин, метотрексат и винбластин (CMV). Частота ответа на комбинацию на основе цисплатина колеблется от 39 до 65%, а полный ответ наблюдается у 12-35% людей. [151] MVAC лучше переносится, если его комбинировать с гранулоцитарным колониестимулирующим фактором , и этот режим известен как режим MVAC с плотной дозой (DDMVAC). Было показано, что эта комбинация снижает все причины смертности. [152] Режим MVAC агрессивен. Фебрильная нейтропения (лихорадка из-за снижения количества лейкоцитов) встречается в 10–14% случаев, а смерть из-за токсичности примерно в 3–4%. Общие побочные эффекты MVAC включают угнетение функции костного мозга , лихорадку из-за снижения количества лейкоцитов, сепсис , мукозит , а также тошноту и рвоту . [151] Напротив, схема GC показала более низкую частоту нейтропенического сепсиса 3/4 степени и мукозита по сравнению с MVAC. [153] Были предприняты усилия по повышению переносимости режима на основе цисплатина путем замены его химиотерапией на основе карбоплатина . Однако терапия на основе цисплатина превосходит химиотерапию на основе карбоплатина в достижении общего и полного ответа. [154] Тем не менее, почти половина людей с метастатическим заболеванием «непригодны» для терапии на основе цисплатина. комбинацию карбоплатина и гемцитабина первой линии можно использовать У таких людей в качестве химиотерапии (GemCarbo) . [155] У людей, которым не показана химиотерапия на основе платины и у которых имеется экспрессия PD-L1 , атезолизумаб и пембролизумаб . можно использовать [ нужна ссылка ]
Люди с метастазами в кости должны получать бисфосфонаты или деносумаб для предотвращения событий, связанных со скелетом (например , переломов , сдавления спинного мозга , болей в костях). [156]
| ДДМВАК | Гемцитабин + Цисплатин |
|---|---|
| Метотрексат (30 мг/м 2 IV) - день 1 Винбластин (3 мг/м 2 IV) - день 2 Доксорубицин (30 мг/м 2 IV) - день 2 Цисплатин (70 мг/м 2 IV) - день 2 Гранулоцитарный колониестимулирующий фактор (G-CSF) (240 мкг/м 2 СК) - 4-10 день Повторяйте каждые 2 недели в течение 3–4 циклов. | Гемцитабин (1000 мг/м 2 IV) - 1,8,15 день Цисплатин (70 мг/м 2 ) - день 2 Повторяйте каждые 4 недели в течение 4 циклов. |
| Атезолизумаб (в PD-L1+) | Гемцитабин + Карбоплатин | Пембролизумаб (в PD-L1+) |
|---|---|---|
| Атезолизумаб (Атезолизумаб 1200 мг внутривенно) каждые 3 недели | Гемцитабин (1000 мг/м 2 IV) - 1,8 день Карбоплатин (4,5×[скорость клубочковой фильтрации +25]) – в 1 день и каждые 3 недели. | Пембролизумаб 200 мгкаждые 3 недели |
Лечение второй линии [ править ]
Рак мочевого пузыря, который является рефрактерным или прогрессирует после химиотерапии на основе платины, можно лечить с помощью химиотерапии второй линии или иммунотерапии. [ нужна ссылка ]
Наиболее часто используемой химиотерапией второй линии являются схемы монотерапии таксанами ( паклитаксел , наб -паклитаксел и доцетаксел ). Другие схемы монотерапии включают винфлунин третьего поколения , алкалоид барвинка (одобренный в Европе), гемцитабин , пеметрексед , оксалиплатин и ифосфамид . [157] [158] [159] Побочные эффекты винфлунина включают нейтропению , запор , утомляемость и анемию , что ограничивает его использование в качестве препарата второго ряда. Ответ на химиотерапию второй линии наблюдается у 5–20% людей. Медиана выживаемости без прогрессирования при химиотерапии второй линии составляет 3–4 месяца. [160]
У людей с мутациями рецепторов фактора роста фибробластов ( FGFR ) и неэффективностью стандартной химиотерапии на основе платины эрдафитиниб можно использовать . Эрдафитиниб продемонстрировал уровень ответа у этих пациентов в 40%. [161]
Пять иммунотерапевтических агентов были одобрены в США для использования при метастатическом раке мочевого пузыря. Они действуют путем ингибирования белка 1 запрограммированной гибели клеток (PD-1) или лиганда запрограммированной гибели клеток 1 (PD-L1) . Пембролизумаб и ниволумаб являются ингибиторами лиганда запрограммированной клеточной гибели 1 (PD-1) . Авелумаб , атезолизумаб и дурвалумаб являются ингибиторами PD-L1 . [162] [163]
Пембролизумаб, вероятно, немного улучшает общую выживаемость и может немного улучшить качество жизни людей с уротелиальным раком , которое ухудшилось после первоначального лечения по сравнению с продолжающейся химиотерапией. [164] Однако пембролизумаб может оказывать лишь минимальное влияние на уровень смертности в результате лечения или скорость прогрессирования рака. [164] Пембролизумаб может вызывать менее серьезные побочные эффекты, чем химиотерапия. [164]
| Атезолизумаб | Ниволумаб | Пембролизумаб | Дурвалумаб | Авелумаб |
|---|---|---|---|---|
| Атезолизумаб 1200 мг внутривенно каждые 3 недели | Ниволумаб 3 мг/кг внутривенно каждые 2 недели | Пембролизумаб 200 мг каждые 3 недели | Дурвалумаб 10 мг/кг каждые 2 недели в течение 12 месяцев | Авелумаб 10 мг/кг внутривенно каждые 2 недели |
Наблюдение и реагирование [ править ]
с контрастированием КТ используется для мониторинга метастазов в легких, печени и лимфатических узлах. Сканирование костей используется для обнаружения и мониторинга метастазов в костях. [165] Ответ на лечение измеряется с использованием критериев оценки ответа в солидных опухолях ( RECIST ) в одну из следующих групп; ответ (полный или частичный), стабильное заболевание и прогрессирующее заболевание. [166]
Прогноз [ править ]
Люди с немышечно-инвазивными опухолями имеют благоприятный исход (5-летняя выживаемость составляет 95% против 69% при мышечно-инвазивном раке мочевого пузыря). [167] [168] Однако у 70% из них возникнет рецидив после первоначального лечения, а у 30% из них проявится мышечно-инвазивное заболевание. [169] Рецидив и прогрессирование заболевания на более высокую стадию имеют менее благоприятный исход. [170]
Выживаемость после радикальной цистэктомии и диссекции тазовых лимфатических узлов зависит от стадии патологии. Если заболевание не распространилось на лимфатический узел и ограничивается мочевым пузырем (Т1 или Т2, N0), 5-летняя выживаемость составляет 78%. Если он распространился локально вокруг области мочевого пузыря без поражения лимфатических узлов (T3, N0), то 5-летняя выживаемость снижается до 47%. При заболевании с распространением лимфатических узлов (N+, независимо от стадии Т) 5-летняя выживаемость составляет 31%. Местно-распространенные и метастатические заболевания резко снижают выживаемость: медиана выживаемости без химиотерапии составляет 3–6 месяцев. Химиотерапия на основе цисплатина увеличила медиану выживаемости до 15 месяцев. Однако 5-летняя выживаемость по-прежнему составляет 15%. [171]
Существует несколько прогностических факторов, которые определяют специфическую выживаемость при раке после радикальной цистэктомии. Факторами, отрицательно влияющими на специфическую выживаемость при раке, являются старость, более высокая степень опухоли и патологическая стадия, в лимфатические узлы метастазы , наличие лимфоваскулярной инвазии и положительный край мягких тканей. [172] Плотность лимфатических узлов (положительные лимфатические узлы/всего лимфатических узлов, наблюдаемых в образце после операции) является предиктором выживаемости при положительном заболевании лимфатических узлов. Чем выше плотность, тем ниже выживаемость. [173]
Качество жизни [ править ]
После радикальной цистэктомии мочевая и сексуальная функция остаются ниже, чем в общей популяции. Люди с необнаруженным мочевым пузырем имеют лучшие эмоциональные функции и образ тела по сравнению с людьми с кожным отведением мочи (которым приходится носить мешок для сбора мочи над животом). [174] Социальные факторы, такие как семья, отношения, здоровье и финансы, вносят значительный вклад в определение хорошего качества жизни людей, у которых диагностирован рак мочевого пузыря. [175]
Высокий процент людей с раком мочевого пузыря страдает тревогой и депрессией . [176] Молодые, одинокие люди с поздними клиническими проявлениями заболевания имеют высокий риск получения диагноза психиатрического заболевания после лечения. Люди с психическими заболеваниями после лечения, по-видимому, имеют худшую онкологическую и общую выживаемость. [177] [178]
Эпидемиология [ править ]
| Классифицировать | Страна | Общий | Мужчины | Женщины |
|---|---|---|---|---|
| 1 | Ливан | 25 | 40 | 9 |
| 2 | Греция | 21 | 40 | 4 |
| 3 | Дания | 18 | 29 | 8 |
| 4 | Венгрия | 17 | 27 | 9 |
| 5 | Албания | 16 | 27 | 6 |
| 5 | Нидерланды | 16 | 26 | 8 |
| 7 | Бельгия | 16 | 27 | 6 |
| 8 | Италия | 15 | 27 | 6 |
| 9 | Германия | 15 | 26 | 6 |
| 10 | Испания | 15 | 27 | 6 |
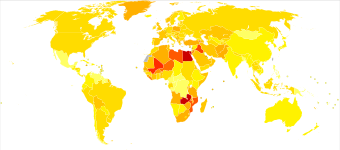
Ежегодно у около 500 000 человек диагностируется рак мочевого пузыря, и 200 000 умирают от этой болезни. [182] Это делает рак мочевого пузыря десятым наиболее часто диагностируемым видом рака и тринадцатой причиной смертности от рака. [183] Рак мочевого пузыря наиболее распространен в более богатых регионах мира, где воздействие определенных канцерогенов является самым высоким. Это также распространено в местах, где шистосомальная инфекция, например, в Северной Африке. распространена [183]
Рак мочевого пузыря гораздо чаще встречается у мужчин, чем у женщин; около 1,1% мужчин и 0,27% женщин заболевают раком мочевого пузыря. [11] Это делает рак мочевого пузыря шестым по распространенности раком у мужчин и семнадцатым у женщин. [184] Когда у женщин диагностируют рак мочевого пузыря, у них, как правило, заболевание протекает на более поздних стадиях и, следовательно, прогноз ухудшается. [184] Эта разница в результатах объясняется многочисленными факторами, такими как разница в воздействии канцерогенов, генетика , социальная помощь и качество медицинской помощи. [51] Одним из распространенных признаков рака мочевого пузыря является гематурия, которую у женщин нередко ошибочно принимают за инфекцию мочевыводящих путей, что приводит к задержке диагностики. [51] Курение может лишь частично объяснить столь высокие показатели среди мужчин в западном полушарии. [185] В Африке мужчины более склонны к полевым работам и подвержены заражению шистосомой , это может в определенной степени объяснить разницу в заболеваемости плоскоклеточным раком в районах, где рак мочевого пузыря является эндемичным. [185]
Ветеринария [ править ]
Ссылки [ править ]
- ↑ Перейти обратно: Перейти обратно: а б с д и ж г час я дж к л м н «Лечение рака мочевого пузыря (PDQ®) – версия для пациентов – Национальный институт рака» . www.cancer.gov . 11 мая 2020 г. Проверено 4 июня 2020 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и «Рак мочевого пузыря — факты о раке» . ПРОИДЧИК . Проверено 30 октября 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б с д и «Информационный бюллетень о раке мочевого пузыря» (PDF) . Глобальная обсерватория рака . Проверено 8 ноября 2019 г.
- ^ Хейес С.М., Прайор К.Н., Уайтхед Д., Бонд М.Дж. К пониманию опыта пациентов и их партнеров по поводу рака мочевого пузыря. Онкологические медсестры.. 2020;43(5):E254-E263. doi:10.1097/NCC.0000000000000718
- ^ «Лечение рака мочевого пузыря» . Национальный институт рака . 5 июня 2017 года. Архивировано из оригинала 14 июля 2017 года . Проверено 18 июля 2017 г.
- ^ «Рекомендации ЕАУ: неинвазивный рак мочевого пузыря» . Уровеб .
- ^ «Рак мочевого пузыря – стадии и степени» . Рак.Нет . 25 июня 2012 г.
- ^ «Рак мочевого пузыря» . Всемирный фонд исследования рака . 24 апреля 2018 г.
- ^ «Статистика выживаемости при раке мочевого пузыря – Канадское онкологическое общество» . www.cancer.ca .
- ↑ Перейти обратно: Перейти обратно: а б с Дирскьот и др. 2023 г. , «Клиническая презентация».
- ↑ Перейти обратно: Перейти обратно: а б с Ленис, Лек и Шами 2020 , с. 1981 год
- ^ Клиническая онкология Абелоффа . Нидерхубер, Джон Э., Армитидж, Джеймс О., 1946-, Дорошоу, Джеймс Х., Кастан, М.Б. (Майкл Б.), Теппер, Джоэл Э., Предшественник: Абелофф, Мартин Д. (6-й ред.). Филадельфия, Пенсильвания. 8 января 2019 г. с. 1388. ИСБН 978-0-323-56815-9 . OCLC 1089396489 .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: другие ( ссылка ) - ^ Ходжес, Стефани С.; Холт, Гарри Р.; Деджордж, Кэтрин К. (15 октября 2017 г.). «Рак мочевого пузыря: диагностика и лечение» . Американский семейный врач . 96 (8): 507–514. ПМИД 29094888 .
- ^ «Что вызывает рак мочевого пузыря?» . Американское онкологическое общество. 12 марта 2024 г. Проверено 2 июля 2024 г.
- ^ Зегерс, член парламента, Тан Ф.Е., Дорант Э., ван Ден Брандт, Пенсильвания (август 2000 г.). «Влияние особенностей курения сигарет на риск рака мочевыводящих путей: метаанализ эпидемиологических исследований» . Рак . 89 (3): 630–9. doi : 10.1002/1097-0142(20000801)89:3<630::AID-CNCR19>3.0.CO;2-Q . ПМИД 10931463 .
- ↑ Перейти обратно: Перейти обратно: а б ван Ош Ф.Х., Йохемс С.Х., ван Скутен Ф.Дж., Брайан Р.Т., Зегерс, член парламента (июнь 2016 г.). «Количественная связь между воздействием табакокурения и риском рака мочевого пузыря: метаанализ 89 обсервационных исследований» . Международный журнал эпидемиологии . 45 (3): 857–70. дои : 10.1093/ije/dyw044 . ПМИД 27097748 .
- ^ Леташова С, Медвеева А, Шовчикова А, Душинска М, Волковова К, Мосою С, Бартонова А (июнь 2012 г.). «Рак мочевого пузыря, обзор факторов риска окружающей среды» . Экологическое здоровье . 11 (Приложение 1): S11. Бибкод : 2012EnvHe..11S..11L . дои : 10.1186/1476-069X-11-S1-S11 . ПМЦ 3388449 . ПМИД 22759493 .
- ^ Бреннан П., Богиллот О., Кордье С., Грейзер Э., Шилл В., Винейс П. и др. (апрель 2000 г.). «Курение сигарет и рак мочевого пузыря у мужчин: объединенный анализ 11 исследований случай-контроль» . Международный журнал рака . 86 (2): 289–94. doi : 10.1002/(sici)1097-0215(20000415)86:2<289::aid-ijc21>3.0.co;2-m . ПМИД 10738259 .
- ^ Ян Х., Ин Ю, Се Х., Ли Дж., Ван Х., Хэ Л. и др. (2018). «Пассивное курение увеличивает риск рака мочевого пузыря у некурящего населения: метаанализ» . Управление раком и исследования . 10 : 3781–3791. дои : 10.2147/CMAR.S175062 . ПМК 6159806 . ПМИД 30288109 .
- ^ «Риски для здоровья, связанные с пассивным курением» . www.cancer.org . Проверено 21 ноября 2019 г.
- ^ Афшари М., Джанбабаи Г., Бахрами М.А., Мусазаде М. (2017). «Опиум и рак мочевого пузыря: систематический обзор и метаанализ отношений шансов употребления опиума и риска рака мочевого пузыря» . ПЛОС ОДИН . 12 (6): e0178527. Бибкод : 2017PLoSO..1278527A . дои : 10.1371/journal.pone.0178527 . ПМК 5460843 . ПМИД 28586371 .
- ^ Рабочая группа МАИР по оценке канцерогенного риска для человека (2012 г.). 4-АМИНОБИФЕНИЛ . Международное агентство по исследованию рака.
- ^ Сен-Жак Н., Паркер Л., Браун П., Даммер Т.Дж. (июнь 2014 г.). «Мышьяк в питьевой воде и раке мочевыводящих путей: систематический обзор эпидемиологических данных за 30 лет» . Экологическое здоровье . 13 (1): 44. Бибкод : 2014EnvHe..13...44S . дои : 10.1186/1476-069X-13-44 . ПМЦ 4088919 . ПМИД 24889821 .
- ^ Клин Б., Пайрон Дж.К. (ноябрь 2014 г.). «Медицинское наблюдение за работниками, подвергшимися воздействию канцерогенов мочевого пузыря: французское научно обоснованное и прагматичное заявление» . BMC Общественное здравоохранение . 14 :1155. дои : 10.1186/1471-2458-14-1155 . ПМК 4230399 . ПМИД 25377503 .
- ^ Рабочая группа МАИР по оценке канцерогенного риска для человека (2012 г.). ХЛОРНАФАЗИН . Международное агентство по исследованию рака.
- ^ Люди, Рабочая группа МАИР по оценке канцерогенного риска (2012). 2-НАФТИЛАМИН . Международное агентство по исследованию рака.
- ^ Ройлен Р.К., Келлен Э., Бантинкс Ф., Бринкман М., член парламента Зигерса (сентябрь 2008 г.). «Метаанализ связи между раком мочевого пузыря и профессией». Скандинавский журнал урологии и нефрологии. Дополнение . 42 (218): 64–78. дои : 10.1080/03008880802325192 . ПМИД 18815919 . S2CID 30510231 .
- ^ Гуха Н., Стинланд Н.К., Мерлетти Ф., Алтьери А., Коглиано В., Страйф К. (август 2010 г.). «Риск рака мочевого пузыря у художников: метаанализ» . Профессиональная и экологическая медицина . 67 (8): 568–73. дои : 10.1136/oem.2009.051565 . ПМИД 20647380 .
- ^ Харлинг М., Шаблон А., Шедлбауэр Г., Дулон М., Нинхаус А. (май 2010 г.). «Рак мочевого пузыря у парикмахеров: метаанализ» . Профессиональная и экологическая медицина . 67 (5): 351–8. doi : 10.1136/oem.2009.050195 . ПМК 2981018 . ПМИД 20447989 .
- ^ Мостафа М.Х., Шевейта С.А., О'Коннор П.Дж. (январь 1999 г.). «Связь между шистосомозом и раком мочевого пузыря» . Обзоры клинической микробиологии . 12 (1): 97–111. дои : 10.1128/CMR.12.1.97 . ПМК 88908 . ПМИД 9880476 .
- ^ Заглул М.С. (декабрь 2012 г.). «Рак мочевого пузыря и шистосомоз» . Журнал Египетского национального института рака . 24 (4): 151–9. дои : 10.1016/j.jnci.2012.08.002 . ПМИД 23159285 .
- ^ Мостафа М.Х., Хельми С., Бадави А.Ф., Трикер А.Р., Шпигельхальдер Б., Пройссманн Р. (апрель 1994 г.). «Нитрат, нитрит и летучие N-нитрозосоединения в моче пациентов, инфицированных Schistosoma haematobium и Schistosoma mansoni». Канцерогенез . 15 (4): 619–25. дои : 10.1093/carcin/15.4.619 . ПМИД 8149471 .
- ^ Бадави АФ (август 1996 г.). «Молекулярные и генетические события при раке мочевого пузыря человека, связанном с шистосомозом: роль онкогенов и генов-супрессоров опухолей». Письма о раке . 105 (2): 123–38. дои : 10.1016/0304-3835(96)04284-х . ПМИД 8697435 .
- ^ Чаудхари К.С., Лу К.Л., Абель П.Д., Хандан-Ниа Н., Шома А.М., Эль Баз М. и др. (январь 1997 г.). «Экспрессия онкопротеинов bcl-2 и p53 при шистосомоз-ассоциированном переходном и плоскоклеточном раке мочевого пузыря» . Британский журнал урологии . 79 (1): 78–84. дои : 10.1046/j.1464-410x.1997.30717.x . ПМИД 9043502 .
- ^ Шокейр А.А. (январь 2004 г.). «Плоскоклеточный рак мочевого пузыря: патология, диагностика и лечение». БЖУ Интернешнл . 93 (2): 216–20. дои : 10.1111/j.1464-410x.2004.04588.x . ПМИД 14690486 . S2CID 10487371 .
- ^ Монах П.А., Арнольд Л.М., Меркель П.А. (январь 2010 г.). «Частота возникновения и профилактика токсичности мочевого пузыря циклофосфамида при лечении ревматических заболеваний: обзор данных». Артрит и ревматизм . 62 (1): 9–21. дои : 10.1002/арт.25061 . ПМИД 20039416 .
- ^ «Диета, питание, физическая активность и рак мочевого пузыря» . wcrf.org. Проверено 27 октября 2022 г.
- ↑ Перейти обратно: Перейти обратно: а б Дианатинасаб, Мостафа; Весселиус, Анке; Салехи-Абаргуэй, Амин; Ю, Эван Ю.В.; Фараруи, Мохаммед; Бринкман, Мари; Брандт, Пит ван ден; Уайт, Эмили; Вейдерпасс, Элизабете; Кальвес-Кельм, Флоренс Ле; Гюнтер, Марк Дж; Хайбрехтс, Инге; Зигерс, Морис П. (2022). «Диетические жиры и их источники в связи с риском рака мочевого пузыря: объединенный анализ 11 проспективных когортных исследований» . Международный журнал рака . 151 (1): 44–55. дои : 10.1002/ijc.33970 . ПМЦ 9303525 . ПМИД 35182086 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ян ХИ, Чен ПК, Ван Дж.Д. (2014). «Китайские травы, содержащие аристолохиевую кислоту, связаны с почечной недостаточностью и уротелиальной карциномой: обзор от эпидемиологических наблюдений к причинно-следственным выводам» . БиоМед Исследования Интернэшнл . 2014 : 569325. doi : 10.1155/2014/569325 . ПМК 4241283 . ПМИД 25431765 .
- ^ Суриано Ф, Альтобелли Э, Сержи Ф, Бускарини М (2013). «Рак мочевого пузыря после лучевой терапии рака простаты» . Обзоры в Урологии . 15 (3): 108–12. ПМК 3821989 . ПМИД 24223022 .
- ^ Сунь Дж.В., Чжао Л.Г., Ян Ю, Ма Икс, Ван Юй, Сян ЮБ (24 марта 2015 г.). «Ожирение и риск рака мочевого пузыря: метаанализ реакции на дозу 15 когортных исследований» . ПЛОС ОДИН . 10 (3): e0119313. Бибкод : 2015PLoSO..1019313S . дои : 10.1371/journal.pone.0119313 . ПМЦ 4372289 . ПМИД 25803438 .
- ^ Аль-Залабани А.Х., Стюарт К.Ф., Весселиус А., Шолс А.М., Зигерс, член парламента (сентябрь 2016 г.). «Модифицируемые факторы риска для профилактики рака мочевого пузыря: систематический обзор метаанализа» . Европейский журнал эпидемиологии . 31 (9): 811–51. дои : 10.1007/s10654-016-0138-6 . ПМК 5010611 . ПМИД 27000312 .
- ^ «Браузер генетики рака» . Cancer.sanger.ac.uk . Проверено 21 ноября 2019 г.
- ^ Интернет-менделевское наследование у человека (OMIM): 109800
- ^ Чжан X, Чжан Ю (сентябрь 2015 г.). «Рак мочевого пузыря и генетические мутации». Клеточная биохимия и биофизика . 73 (1): 65–9. дои : 10.1007/s12013-015-0574-z . ПМИД 27352265 . S2CID 14316154 .
- ^ «Рак мочевого пузыря» . Домашний справочник по генетике .
- ^ Ахмад I, Сансом О.Дж., Люнг Х.И. (май 2012 г.). «Изучение молекулярной генетики рака мочевого пузыря: уроки, извлеченные из моделей на мышах» . Модели и механизмы заболеваний . 5 (3): 323–32. дои : 10.1242/dmm.008888 . ПМЦ 3339826 . ПМИД 22422829 .
- ^ Хамфри П.А., Мок Х., Кубилла А.Л., Улбрайт Т.М., Рейтер В.Е. (июль 2016 г.). «Классификация опухолей мочевой системы и мужских половых органов ВОЗ 2016 г. - Часть B: опухоли простаты и мочевого пузыря» (PDF) . Европейская урология . 70 (1): 106–119. дои : 10.1016/j.eururo.2016.02.028 . ПМИД 26996659 . S2CID 3756845 .
- ^ Энгель Л.С., Тайоли Э., Пфайффер Р., Гарсиа-Клозас М., Маркус П.М., Лан К. и др. (июль 2002 г.). «Объединенный анализ и метаанализ глутатион S-трансферазы M1 и рака мочевого пузыря: обзор HuGE» . Американский журнал эпидемиологии . 156 (2): 95–109. дои : 10.1093/aje/kwf018 . ПМИД 12117698 .
- ↑ Перейти обратно: Перейти обратно: а б с «Отчет о раке мочевого пузыря» (PDF) . Всемирный фонд исследования рака: Международный . Проверено 9 ноября 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б с Маркс П., Соаве А., Шариат С.Ф., Файкович Х., Фиш М., Ринк М. (октябрь 2016 г.). «Женщина с раком мочевого пузыря: в чем и почему есть разница?» . Трансляционная андрология и урология . 5 (5): 668–682. дои : 10.21037/tau.2016.03.22 . ПМК 5071204 . ПМИД 27785424 .
- ^ Чой В., Очоа А., МакКонки Д.Д., Айн М., Хёглунд М., Ким В.Ю. и др. (сентябрь 2017 г.). «Генетические изменения в молекулярных подтипах рака мочевого пузыря: иллюстрация в наборе данных Атласа генома рака» . Европейская урология . 72 (3): 354–365. дои : 10.1016/j.eururo.2017.03.010 . ПМК 5764190 . ПМИД 28365159 .
- ^ Чой В., Черняк Б., Очоа А., Су Х, Зифкер-Радтке А., Динни С., МакКонки DJ (июль 2014 г.). «Собственные базальные и просветные подтипы мышечно-инвазивного рака мочевого пузыря». Обзоры природы. Урология . 11 (7): 400–10. дои : 10.1038/nrurol.2014.129 . ПМИД 24960601 . S2CID 24723395 .
- ^ «Руководство EAU: Неинвазивная диагностика рака мочевого пузыря» . Уровеб . Проверено 12 ноября 2019 г. .
- ↑ Перейти обратно: Перейти обратно: а б «Руководство EAU: Диагностика мышечно-инвазивного и метастатического рака мочевого пузыря» . Уровеб . Проверено 12 ноября 2019 г. .
- ↑ Перейти обратно: Перейти обратно: а б с «Uroweb — Европейская ассоциация урологов (ЕАУ)» . Уровеб . Проверено 7 ноября 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б Авиви, Миссури; Викрам, Р. (18 июня 2022 г.). «Рентгенологическая диагностика и стадирование рака мочевого пузыря: обновленная информация» . Журнал компьютерной томографии . 46 (4): 530–544. дои : 10.1097/RCT.0000000000001322 . ПМИД 35723651 . S2CID 249869037 . Проверено 23 июня 2022 г.
- ^ «Лечение рака мочевого пузыря» . Национальный институт рака . 8 мая 2020 г. Проверено 4 июня 2020 г.
- ^ Лотан Ю., Рёрборн К.Г. (январь 2003 г.). «Чувствительность и специфичность общедоступных маркеров опухоли мочевого пузыря по сравнению с цитологией: результаты всестороннего обзора литературы и метаанализа» . Урология . 61 (1): 109–18, обсуждение 118. doi : 10.1016/S0090-4295(02)02136-2 . ПМИД 12559279 .
- ^ Шариат С.Ф., Карам Дж.А., Лотан Ю., Каракевич П.И. (2008). «Критическая оценка маркеров мочи для выявления и мониторинга рака мочевого пузыря» . Обзоры в Урологии . 10 (2): 120–35. ПМЦ 2483317 . ПМИД 18660854 .
- ↑ Перейти обратно: Перейти обратно: а б Чоу Р., Гор Дж.Л., Бакли Д., Фу Р., Густафсон К., Гриффин Дж.К. и др. (декабрь 2015 г.). «Мочевые биомаркеры для диагностики рака мочевого пузыря: систематический обзор и метаанализ» . Анналы внутренней медицины . 163 (12): 922–31. дои : 10.7326/M15-0997 . ПМИД 26501851 .
- ^ Сантони Дж., Морелли М.Б., Амантини С., Баттелли Н. (2018). «Мочевые маркеры при раке мочевого пузыря: обновленная информация» . Границы онкологии . 8 : 362. doi : 10.3389/fonc.2018.00362 . ПМК 6137202 . ПМИД 30245975 .
- ↑ Перейти обратно: Перейти обратно: а б с Мияке М., Овари Т., Хори С., Накаи Ю., Фудзимото К. (2018). «Новые биомаркеры для диагностики и мониторинга уротелиальной карциномы» . Исследования и отчеты в области урологии . 10 : 251–261. дои : 10.2147/RRU.S173027 . ПМК 6299471 . ПМИД 30588457 .
- ↑ Перейти обратно: Перейти обратно: а б Гудисон С., Россер С.Дж., Уркиди В. (апрель 2013 г.). «Выявление и мониторинг рака мочевого пузыря: оценка маркерных тестов мочи и крови» . Молекулярная диагностика и терапия . 17 (2): 71–84. дои : 10.1007/s40291-013-0023-x . ПМЦ 3627848 . ПМИД 23479428 .
- ^ Здоровье, Центр приборов и радиологии (7 октября 2019 г.). «Тесты на основе нуклеиновых кислот» . FDA .
- ^ Сория Ф., Дроллер М.Дж., Лотан Ю., Гонтеро П., Д'Андреа Д., Гаст К.М. и др. (декабрь 2018 г.). «Обновленный каталог доступных биомаркеров мочи для наблюдения за неинвазивным раком мочевого пузыря» . Всемирный журнал урологии . 36 (12): 1981–1995. дои : 10.1007/s00345-018-2380-x . ПМК 6280823 . ПМИД 29931526 .
- ↑ Перейти обратно: Перейти обратно: а б с д Андреассен, БК; Агнес, Б.; Гислефосс, Р.; Андреассен, М.; Вальквист, Р. (2016). «Заболеваемость и выживаемость уротелиальной карциномы мочевого пузыря в Норвегии 1981-2014 гг.» . БМК Рак . 16 (1): 799. doi : 10.1186/s12885-016-2832-x . ISSN 1471-2407 . ПМК 5064906 . ПМИД 27737647 .
- ↑ Перейти обратно: Перейти обратно: а б с «Типы рака мочевого пузыря: ПКК и другие варианты» . CancerCenter.com . Архивировано из оригинала 10 августа 2018 года . Проверено 10 августа 2018 г.
- ↑ Перейти обратно: Перейти обратно: а б Амин М.Б. (июнь 2009 г.). «Гистологические варианты уротелиального рака: диагностические, терапевтические и прогностические значения» . Современная патология . 22 Приложение 2 (S2): S96–S118. дои : 10.1038/modpathol.2009.26 . ПМИД 19494856 .
- ^ Тан Д.Х., Чанг СС (декабрь 2015 г.). «Лечение рака мочевого пузыря in situ: передовая практика и последние разработки» . Терапевтические достижения в урологии . 7 (6): 351–64. дои : 10.1177/1756287215599694 . ПМЦ 4647140 . ПМИД 26622320 .
- ^ Чаласани В., Чин Дж.Л., Идзава Дж.И. (декабрь 2009 г.). «Гистологические варианты уротелиального рака мочевого пузыря и неуротелиальная гистология при раке мочевого пузыря» . Журнал Канадской урологической ассоциации . 3 (6 Приложение 4): С193-8. дои : 10.5489/cuaj.1195 . ПМК 2792446 . ПМИД 20019984 .
- ^ Москини М, Д'Андреа Д, Корн С, Ирмак Ю, Сориа Ф, Комперат Е, Шариат СФ (ноябрь 2017 г.). «Характеристика и клиническое значение гистологических вариантов рака мочевого пузыря». Обзоры природы. Урология . 14 (11): 651–668. дои : 10.1038/nrurol.2017.125 . ПМИД 28895563 . S2CID 6351401 .
- ^ Уоррик Джи (октябрь 2017 г.). «Клиническое значение гистологических вариантов рака мочевого пузыря» . Журнал Национальной комплексной онкологической сети . 15 (10): 1268–1274. дои : 10.6004/jnccn.2017.7027 . ПМИД 28982751 .
- ^ Веньо АК, Тити С (2014). «Саркоматоидный вариант уротелиальной карциномы (карциносаркома, веретеноклеточный рак): обзор литературы» . ISRN Урология . 2014 : 794563. doi : 10.1155/2014/794563 . ПМЦ 3920806 . ПМИД 24587922 .
- ^ «Варианты уротелиальной карциномы - Американская урологическая ассоциация» . www.auanet.org . Архивировано из оригинала 30 июля 2020 года . Проверено 3 ноября 2019 г.
- ^ «Руководство ЕАУ – СИСТЕМЫ СТАДИРОВАНИЯ И КЛАССИФИКАЦИИ» . Уровеб .
- ^ Магерс М.Дж., Лопес-Бельтран А., Монтирони Р., Уильямсон С.Р., Каймаклиотис Х.З., Ченг Л. (январь 2019 г.). «Стадирование рака мочевого пузыря» . Гистопатология . 74 (1): 112–134. дои : 10.1111/его.13734 . ПМИД 30565300 .
- ↑ Перейти обратно: Перейти обратно: а б «Рак мочевого пузыря: стадии и степени» . Рак.нет . 25 июня 2012 г. Одобрено редакционной коллегией Cancer.Net 05/2019
- ^ Синагаре AB, Рамайя Н.Х., Джаганнатан Дж. П., Феннесси FM, Таплин М. Е., Ван ден Аббиле А. Д. (январь 2011 г.). «Метастатическая картина рака мочевого пузыря: корреляция с характеристиками первичной опухоли». АЖР. Американский журнал рентгенологии . 196 (1): 117–22. дои : 10.2214/AJR.10.5036 . ПМИД 21178055 .
- ↑ Перейти обратно: Перейти обратно: а б Мао Ю., Хеджире С., Прапруттам Д., Харисингхани М. (16 сентября 2014 г.). «Визуализация тазовых лимфатических узлов» . Текущие отчеты о радиологии . 2 (11). дои : 10.1007/s40134-014-0070-z .
- ^ Шанкар П.Р., Баркмайер Д., Хаджиски Л., Кохан Р.Х. (октябрь 2018 г.). «Иллюстрированный обзор узловых метастазов рака мочевого пузыря» . Трансляционная андрология и урология . 7 (5): 804–813. дои : 10.21037/tau.2018.08.25 . ПМК 6212631 . ПМИД 30456183 .
- ^ «Как ставится рак мочевого пузыря?» . Американское онкологическое общество . Архивировано из оригинала 4 октября 2015 г. Последний медицинский обзор: 02.11.2019.
- ^ «Показатель выживаемости при раке мочевого пузыря по стадиям» . Американское онкологическое общество . Архивировано из оригинала 13 октября 2015 г. Последний медицинский обзор: 26.02.2014.
- ^ Сет П. Лернер. «Обзор диагностики и лечения немышечно-инвазивного рака мочевого пузыря» (PDF) . Управление по контролю за продуктами и лекарствами . ОДАК, 14 сентября 2016 г.
- ^ Эпштейн Дж.И., Амин М.Б., Рейтер В.Р., Мостофи ФК (декабрь 1998 г.). «Консенсусная классификация уротелиальных (переходно-клеточных) новообразований мочевого пузыря Всемирной организации здравоохранения / Международного общества урологической патологии. Комитет консенсусной конференции по мочевому пузырю». Американский журнал хирургической патологии . 22 (12): 1435–48. дои : 10.1097/00000478-199812000-00001 . ПМИД 9850170 .
- ^ Комперат Э.М., Бургер М., Гонтеро П., Мостафид А.Х., Палу Дж., Рупре М. и др. (май 2019 г.). «Классификация уротелиальной карциномы и новая «Классификация опухолей мочевой системы и мужских половых органов Всемирной организации здравоохранения 2016» » . Европейский фокус урологии . 5 (3): 457–466. дои : 10.1016/j.euf.2018.01.003 . ПМИД 29366854 .
- ↑ Перейти обратно: Перейти обратно: а б Чанг С.С., Бурджиан С.А., Чоу Р., Кларк П.Е., Данешманд С., Конети Б.Р. и др. (октябрь 2016 г.). «Диагностика и лечение немышечно-инвазивного рака мочевого пузыря: рекомендации AUA/SUO». Журнал урологии . 196 (4): 1021–9. дои : 10.1016/j.juro.2016.06.049 . ПМИД 27317986 .
- ↑ Перейти обратно: Перейти обратно: а б «Рак мочевого пузыря: рекомендации по неинвазивному лечению мышц - Американская урологическая ассоциация» . www.auanet.org . Архивировано из оригинала 7 августа 2020 года . Проверено 30 октября 2019 г.
- ^ Соукуп В., Чапун О., Коэн Д., Эрнандес В., Бургер М., Комперат Е. и др. (ноябрь 2018 г.). «Инструменты стратификации риска и прогностические модели при немышечно-инвазивном раке мочевого пузыря: критическая оценка группы рекомендаций Европейской ассоциации урологов по немышечно-инвазивному раку мочевого пузыря». Европейский фокус урологии . 6 (3): 479–489. дои : 10.1016/j.euf.2018.11.005 . ПМИД 30470647 . S2CID 53722156 .
- ^ Сильвестр Р.Дж., ван дер Мейден А.П., Остерлинк В., Витжес Дж.А., Буффиу С., Денис Л. и др. (март 2006 г.). «Прогнозирование рецидива и прогрессирования у отдельных пациентов с раком мочевого пузыря стадии Ta T1 с использованием таблиц риска EORTC: комбинированный анализ 2596 пациентов из семи исследований EORTC». Европейская урология . 49 (3): 466–5, обсуждение 475–7. дои : 10.1016/j.eururo.2005.12.031 . ПМИД 16442208 .
- ^ Сильвестр Р.Дж., ван дер Мейден А.П., Остерлинк В., Витжес Дж.А., Буффиу С., Денис Л. и др. (март 2006 г.). «Прогнозирование рецидива и прогрессирования у отдельных пациентов с раком мочевого пузыря стадии Ta T1 с использованием таблиц риска EORTC: комбинированный анализ 2596 пациентов из семи исследований EORTC». Европейская урология . 49 (3): 466–5, обсуждение 475–7. дои : 10.1016/j.eururo.2005.12.031 . ПМИД 16442208 .
- ^ Фернандес-Гомес Х., Мадеро Р., Солсона Э., Унда М., Мартинес-Пиньейро Л., Гонсалес М. и др. (ноябрь 2009 г.). «Прогнозирование рецидива и прогрессирования немышечно-инвазивного рака мочевого пузыря у пациентов, получавших лечение бациллой Кальметта-Герена: модель оценки CUETO». Журнал урологии . 182 (5): 2195–203. дои : 10.1016/j.juro.2009.07.016 . ПМИД 19758621 .
- ^ «Рекомендации ЕАУ: неинвазивный рак мочевого пузыря» . Уровеб .
- ^ Чой С.Ю., Рю Дж.Х., Чанг И.Х., Ким Т.Х., Мён С.К., Мун Ю.Т. и др. (октябрь 2014 г.). «Прогнозирование рецидива и прогрессирования немышечно-инвазивного рака мочевого пузыря у корейских пациентов: сравнение моделей EORTC и CUETO» . Корейский журнал урологии . 55 (10): 643–9. дои : 10.4111/kju.2014.55.10.643 . ПМЦ 4198762 . ПМИД 25324946 .
- ^ Дианатинасаб М., Форозани Э., Акбари А. (2022). «Схемы питания и риск рака мочевого пузыря: систематический обзор и метаанализ» . BMC Общественное здравоохранение . 22 (1): 73. дои : 10.1186/s12889-022-12516-2 . ПМЦ 8753903 . ПМИД 35016647 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ Ю ЭЮВ, Весселиус А, Мехрканун С, Бринкман М, ван ден Брандт П, Уайт Е, Вейдерпасс Е, Ле Кальвес-Кельм Ф, Гюнтер М, Хайбрехтс И, Лидберг Ф, Скей Г, Тьоннеланд А, Риболи Е, Джайлс Г.Г., Милн Р.Л., член парламента Зигерса (2020 г.). «Потребление зерна и пищевых волокон и риск рака мочевого пузыря: объединенный анализ проспективных когортных исследований» . Американский журнал клинического питания . 112 (5): 1252–1266. дои : 10.1093/ajcn/nqaa215 . ПМЦ 7657329 . PMID 32778880 .
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) - ^ «Окончательное резюме обновления: Рак мочевого пузыря у взрослых: скрининг - Рабочая группа профилактической службы США» . www.uspreventiveservicestaskforce.org . Проверено 13 ноября 2019 г. .
- ^ Камат А.М., Хан Н.М., Эфстатиу Дж.А., Лернер С.П., Мальмстрем П.У., Чой В. и др. (декабрь 2016 г.). «Рак мочевого пузыря». Ланцет . 388 (10061): 2796–2810. дои : 10.1016/S0140-6736(16)30512-8 . ПМИД 27345655 . S2CID 29104789 .
- ↑ Перейти обратно: Перейти обратно: а б с «Руководство NCCN по раку мочевого пузыря, 2018 г.» (PDF) . Проверено 25 ноября 2019 г.
- ^ Витжес Дж.А., Бабьюк М., Гонтеро П., Жакмин Д., Карл А., Крук С. и др. (ноябрь 2014 г.). «Клиническая и экономическая эффективность цистоскопии в синем свете под контролем гексаминолевулината: обзор фактических данных и обновленные рекомендации экспертов» (PDF) . Европейская урология . 66 (5): 863–71. дои : 10.1016/j.eururo.2014.06.037 . ПМИД 25001887 .
- ^ Данешманд С., Шукман А.К., Бохнер Б.Х., Куксон М.С., Даунс Т.М., Гомелла Л.Г. и др. (октябрь 2014 г.). «Гексаминолевулиновая цистоскопия в синем свете при немышечно-инвазивном раке мочевого пузыря: обзор клинических данных и консенсусное заявление о целесообразности использования в США» . Обзоры природы. Урология . 11 (10): 589–96. дои : 10.1038/nrurol.2014.245 . ПМИД 25245244 .
- ^ Милади М., Пейромор М., Зербиб М., Сайги Д., Дебре Б. (март 2003 г.). «Значение второй трансуретральной резекции при обследовании пациентов с опухолями мочевого пузыря». Европейская урология . 43 (3): 241–5. дои : 10.1016/s0302-2838(03)00040-x . ПМИД 12600426 . S2CID 5784606 .
- ↑ Перейти обратно: Перейти обратно: а б «Рекомендации ЕАУ: неинвазивный рак мочевого пузыря» . Уровеб .
- ↑ Перейти обратно: Перейти обратно: а б с Шмидт, Стефани; Кунат, Фрэнк; Коулз, Бернадетт; Дрегер, Дезире Луиза; Краббе, Лаура-Мария; Дерш, Рик; Килиан, Сэмюэл; Дженсен, Катрин; Дам, Филипп; Меерполь, Йорг Дж. (8 января 2020 г.). Кокрейновская урологическая группа (ред.). «Внутрипузырная палочка Кальметта-Герена в сравнении с митомицином С при раке мочевого пузыря Та и Т1» . Кокрейновская база данных систематических обзоров . 1 (1): CD011935. дои : 10.1002/14651858.CD011935.pub2 . ПМК 6956215 . ПМИД 31912907 .
- ↑ Перейти обратно: Перейти обратно: а б Замбони С., Баумайстер П., Маттеи А., Мордасини Л., Антонелли А., Симеоне С., Москини М. (февраль 2019 г.). «Одиночная послеоперационная инстилляция при немышечно-инвазивном раке мочевого пузыря: есть ли еще показания?» . Трансляционная андрология и урология . 8 (1): 76–84. дои : 10.21037/tau.2018.08.20 . ПМК 6414349 . ПМИД 30976571 .
- ^ Витджес Дж. А., Хендриксен К. (январь 2008 г.). «Внутрипузырная фармакотерапия немышечно-инвазивного рака мочевого пузыря: критический анализ доступных в настоящее время лекарств, схем лечения и долгосрочных результатов». Европейская урология . 53 (1): 45–52. дои : 10.1016/j.eururo.2007.08.015 . ПМИД 17719169 .
- ^ Ди Стази С.М., Ридл К. (июнь 2009 г.). «Обновления внутрипузырного электродвижущего введения препарата митомицина-С при немышечно-инвазивном раке мочевого пузыря» (PDF) . Всемирный журнал урологии . 27 (3): 325–30. дои : 10.1007/s00345-009-0389-x . hdl : 2108/6440 . ПМИД 19234707 . S2CID 24496739 .
- ^ Кос Б., Васкес Х.Л., Миклавчич Д., Герман Г.Г., Гель Дж. (2016). «Исследование механизмов действия Управления электромоторными лекарствами (EMDA)» . ПерДж . 4 (е2309): е2309. дои : 10.7717/peerj.2309 . ПМК 5012313 . ПМИД 27635313 .
- ^ Бахут З., Халахми С., Московиц Б., Натив О. (2016). «Роль гипертермии в лечении немышечно-инвазивного рака мочевого пузыря». Экспертный обзор противораковой терапии . 16 (2): 189–98. дои : 10.1586/14737140.2016.1126515 . ПМИД 26618756 . S2CID 681090 .
- ^ Александрофф А.Б., Джексон А.М., О'Доннелл М.А., Джеймс К. (май 1999 г.). «Иммунотерапия БЦЖ рака мочевого пузыря: 20 лет спустя». Ланцет . 353 (9165): 1689–94. дои : 10.1016/S0140-6736(98)07422-4 . ПМИД 10335805 . S2CID 19355109 .
- ^ Ламм Д.Л., Блюменштейн Б.А., Кроуфорд Э.Д., Монти Дж.Э., Скардино П., Гроссман Х.Б. и др. (октябрь 1991 г.). «Рандомизированное исследование внутрипузырного доксорубицина и иммунотерапии бациллой Кальметта-Герена при переходно-клеточном раке мочевого пузыря» . Медицинский журнал Новой Англии . 325 (17): 1205–9. дои : 10.1056/NEJM199110243251703 . ПМИД 1922207 .
- ^ Курода К., Браун Э.Дж., Телле В.Б., Рассел Д.Г., Рэтлифф Т.Л. (январь 1993 г.). «Характеристика интернализации бациллы Кальметта-Герена клетками опухоли мочевого пузыря человека» . Журнал клинических исследований . 91 (1): 69–76. дои : 10.1172/JCI116202 . ПМК 329996 . ПМИД 8423234 .
- ^ Рэтлифф Т.Л., Ричи Дж.К., Юань Дж.Дж., Андриоле Г.Л., Каталона В.Дж. (сентябрь 1993 г.). «Субпопуляции Т-клеток, необходимые для внутрипузырной иммунотерапии БЦЖ при раке мочевого пузыря». Журнал урологии . 150 (3): 1018–23. дои : 10.1016/s0022-5347(17)35678-1 . ПМИД 8102183 .
- ^ Фуге О., Васдев Н., Олчорн П., Грин Дж.С. (2015). «Иммунотерапия рака мочевого пузыря» . Исследования и отчеты в области урологии . 7 : 65–79. дои : 10.2147/RRU.S63447 . ПМЦ 4427258 . ПМИД 26000263 .
- ↑ Перейти обратно: Перейти обратно: а б с д Камат А.М., Флейг Т.В., Гроссман Х.Б., Конети Б., Ламм Д., О'Доннелл М.А. и др. (апрель 2015 г.). «Экспертный консенсусный документ: Консенсусное заявление о передовой практике использования внутрипузырной иммунотерапии БЦЖ при раке мочевого пузыря» . Обзоры природы. Урология . 12 (4): 225–35. дои : 10.1038/nrurol.2015.58 . ПМИД 25800393 .
- ^ Альхунаиди О, Злотта А.Р. (2019). «Применение внутрипузырной БЦЖ при уротелиальном раке мочевого пузыря» . электрораковая медицинская наука . 13 : 905. дои : 10.3332/ecancer.2019.905 . ПМК 6411413 . ПМИД 30915163 .
- ^ Д'Андреа Д., Гонтеро П., Шариат С.Ф., Сория Ф. (февраль 2019 г.). «Внутрипузырная палочка Кальметта-Герена при раке мочевого пузыря: все ли штаммы равны?» . Трансляционная андрология и урология . 8 (1): 85–93. дои : 10.21037/tau.2018.08.19 . ПМК 6414340 . ПМИД 30976572 .
- ^ Маклауд LC, Нго TC, Гонсалго ML (июль 2014 г.). «Осложнения внутрипузырной палочки Кальметта-Герена» . Журнал Канадской урологической ассоциации . 8 (7–8): Е540-4. дои : 10.5489/cuaj.1411 . ПМК 4137021 . ПМИД 25210559 .
- ^ Шах С., Картер-Монро Н., Атта М.Г. (октябрь 2015 г.). «Гранулематозный интерстициальный нефрит» . Клинический журнал почек . 8 (5): 516–23. дои : 10.1093/ckj/sfv053 . ПМЦ 4581373 . ПМИД 26413275 .
- ^ Декестекер К., Остерлинк В. (2015). «Управление побочными эффектами внутрипузырной терапии бациллой Кальметта-Герена» . Исследования и отчеты в области урологии . 7 : 157–63. дои : 10.2147/RRU.S63448 . ПМК 4630183 . ПМИД 26605208 .
- ^ «ImmunityBio объявляет об одобрении FDA Анктивы, первого в своем классе агониста рецептора IL-15 для лечения невосприимчивого к БЦЖ неинвазивного мышечно-инвазивного рака мочевого пузыря» (пресс-релиз). ИммунитетБио. 23 апреля 2024 г. Проверено 24 апреля 2024 г. - через Business Wire.
- ^ Витджес Дж. А. (май 2006 г.). «Лечение неудач БЦЖ при поверхностном раке мочевого пузыря: обзор». Европейская урология . 49 (5): 790–7. дои : 10.1016/j.eururo.2006.01.017 . ПМИД 16464532 . S2CID 5103506 .
- ^ Бабьюк В., Остерлинк В., Сильвестр Р. и др. (2010). «Руководство по TaT1 (немышечно-инвазивному) раку мочевого пузыря» . Европейская ассоциация урологов . Архивировано из оригинала 24 апреля 2010 года.
- ^ Группа по обновлению клинических рекомендаций по раку мочевого пузыря (2007 г.). Рак мочевого пузыря: Рекомендации по лечению немышечно-инвазивного рака мочевого пузыря: (стадии Ta, T1 и Tis): обновление 2007 г. Американская урологическая ассоциация . [ нужна страница ]
- ^ Хасслер М.Р., Шариат С.Ф., Сория Ф. (май 2019 г.). «Терапевтические стратегии спасения при неудаче, вызванной бациллой Кальметта-Герена». Современное мнение в урологии . 29 (3): 239–246. doi : 10.1097/MOU.0000000000000593 . ПМИД 30762670 . S2CID 73439134 .
- ^ Мур, К. (2006). «Клиническая оценка оптических характеристик простаты у мужчин с раком простаты» . Европейская урология . 5 (Приложение): 131.
- ^ Флешкер, С. (2008). «Фотодинамическая терапия рака мочевого пузыря — обзор текущего состояния и перспектив на будущее» . Обзоры природы Урология . 84 : 1231–1237. doi : 10.1038/nrurol.2008.123 (неактивен 29 апреля 2024 г.).
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Лимами, Юнесс (2023). «Проливая свет на рак простаты: фотодинамическая терапия и комбинированные подходы» . Фармацевтика . 15 (6): 1767. doi : 10.3390/pharmaceutics15061767 . ПМЦ 10302598 . ПМИД 37376215 .
- ^ «Достижения в лечении рака мочевого пузыря — роль фотодинамической терапии» . МДПИ Фармасьютика .
- ↑ Перейти обратно: Перейти обратно: а б с д «Лечение неметастатического мышечно-инвазивного рака мочевого пузыря: Рекомендации AUA/ASCO/ASTRO/SUO (2017) – Американская урологическая ассоциация» . www.auanet.org . Архивировано из оригинала 23 июля 2020 года . Проверено 20 ноября 2019 г.
- ↑ Перейти обратно: Перейти обратно: а б с Хван, Ю Чанг; Сатианатен, Ниранджан Дж; Имамура, Мари; Кунц, Гретхен М; Риск, Майкл С; Дам, Филипп (14 мая 2019 г.). Кокрейновская урологическая группа (ред.). «Расширенная и стандартная лимфаденэктомия при уротелиальной карциноме мочевого пузыря у пациентов, перенесших радикальную цистэктомию» . Кокрейновская база данных систематических обзоров . 2019 (5): CD013336. дои : 10.1002/14651858.CD013336 . ПМК 6528183 . ПМИД 31111956 .
- ^ Джохар Р.С., Хейн М.Х., Стегеманн А.П., Ахмед К., Агарвал П., Балбай М.Д. и др. (июль 2013 г.). «Осложнения после роботизированной радикальной цистэктомии: результаты Международного консорциума роботизированной цистэктомии». Европейская урология . 64 (1): 52–7. дои : 10.1016/j.eururo.2013.01.010 . ПМИД 23380164 . S2CID 7369962 .
- ^ Шабсиг А., Корец Р., Вора К.С., Брукс СМ, Кронин А.М., Сэвидж С. и др. (январь 2009 г.). «Определение ранней заболеваемости радикальной цистэктомией у пациентов с раком мочевого пузыря с использованием стандартизированной методологии отчетности». Европейская урология . 55 (1): 164–74. дои : 10.1016/j.eururo.2008.07.031 . ПМИД 18675501 .
- ^ Москини М., Симоне Дж., Стенцл А., Гилл И.С., Катто Дж. (апрель 2016 г.). «Критический обзор результатов радикальной цистэктомии: можно ли уменьшить осложнения радикальной цистэктомии с помощью хирургического объема и роботизированной хирургии?». Европейский фокус урологии . 2 (1): 19–29. дои : 10.1016/j.euf.2016.03.001 . ПМИД 28723446 .
- ^ Серантола Ю., Валерио М., Перссон Б., Йихлински П., Юнгквист О., Хюбнер М. и др. (декабрь 2013 г.). «Руководство по периоперационному уходу после радикальной цистэктомии по поводу рака мочевого пузыря: рекомендации общества ускоренного восстановления после операции (ERAS (®))» . Клиническое питание . 32 (6): 879–87. дои : 10.1016/j.clnu.2013.09.014 . ПМИД 24189391 . S2CID 24108744 .
- ^ «UpToDate: Неоадъювантная химиотерапия» . www.uptodate.com .
- ^ Вейл, К. (июнь 2003 г.). «Неоадъювантная химиотерапия при инвазивном раке мочевого пузыря: систематический обзор и метаанализ». Ланцет . 361 (9373): 1927–34. дои : 10.1016/s0140-6736(03)13580-5 . ПМИД 12801735 . S2CID 29233494 .
- ^ Совместная работа по метаанализу рака мочевого пузыря (ABC) (август 2005 г.). «Неоадъювантная химиотерапия при инвазивном раке мочевого пузыря: обновление систематического обзора и метаанализа данных отдельных пациентов, сотрудничество в метаанализе распространенного рака мочевого пузыря (ABC)». Европейская урология . 48 (2): 202–5, обсуждение 205–6. дои : 10.1016/j.eururo.2005.04.006 . ПМИД 15939524 .
- ^ Гроссман Х.Б., Натале Р.Б., Танген К.М., Спейтс В.О., Фогельзанг Н.Дж., Трамп Д.Л. и др. (август 2003 г.). «Неоадъювантная химиотерапия плюс цистэктомия по сравнению с только цистэктомией при местно-распространенном раке мочевого пузыря» . Медицинский журнал Новой Англии . 349 (9): 859–66. doi : 10.1056/NEJMoa022148 . ПМИД 12944571 .
- ↑ Перейти обратно: Перейти обратно: а б Инь М., Джоши М., Мейер Р.П., Гланц М., Холдер С., Харви Х.А. и др. (июнь 2016 г.). «Неоадъювантная химиотерапия при мышечно-инвазивном раке мочевого пузыря: систематический обзор и двухэтапный метаанализ» . Онколог . 21 (6): 708–15. doi : 10.1634/теонколог.2015-0440 . ПМЦ 4912364 . ПМИД 27053504 .
- ^ Ивата Т., Кимура С., Абуфарай М., Яниш Ф., Каракевич П.И., Сибахер В. и др. (октябрь 2019 г.). «Роль адъювантной лучевой терапии после операции по поводу уротелиальной карциномы верхних и нижних мочевых путей: систематический обзор». Урологическая онкология . 37 (10): 659–671. дои : 10.1016/j.urolonc.2019.05.021 . ПМИД 31255542 . S2CID 195760627 .
- ↑ Перейти обратно: Перейти обратно: а б с д «Схемы лечения рака мочевого пузыря» . Консультант по терапии рака . 1 января 2019 года. Архивировано из оригинала 29 августа 2021 года . Проверено 26 ноября 2019 г. .
- ^ "До настоящего времени" . www.uptodate.com . Проверено 26 ноября 2019 г. .
- ↑ Перейти обратно: Перейти обратно: а б с Плауссар Г., Данешманд С., Эфстатиу Дж.А., Герр Х.В., Джеймс Н.Д., Рёдель К.М. и др. (июль 2014 г.). «Критический анализ сохранения мочевого пузыря с помощью тримодальной терапии при мышечно-инвазивном раке мочевого пузыря: систематический обзор». Европейская урология . 66 (1): 120–37. дои : 10.1016/j.eururo.2014.02.038 . ПМИД 24613684 .
- ^ Смелзер В.В., Остенфельд М.А., Хольцбайерляйн Дж.М., Ли ЭК. Где мы находимся с сохранением мочевого пузыря при мышечно-инвазивном раке мочевого пузыря в 2017 году? Indian J Urol 2017; 33: 111–7 http://www.indianjurol.com/text.asp?2017/33/2/111/203415. Архивировано 10 сентября 2017 г. на Wayback Machine.
- ^ Мирза А., Чоудхури А. (апрель 2016 г.). «Сохранение мочевого пузыря при мышечно-инвазивном раке мочевого пузыря» . Рак мочевого пузыря . 2 (2): 151–163. дои : 10.3233/BLC-150025 . ПМЦ 4927909 . ПМИД 27376137 .
- ^ «Химиотерапия рака мочевого пузыря» . www.cancer.org . Проверено 27 ноября 2019 г. .
- ^ Клейле Й., Шлак К., Богеманн М., Стейнестель Дж., Шрадер А.Дж., Краббе Л.М. (октябрь 2016 г.). «Вариантная гистология при раке мочевого пузыря: как она должна изменить лечение немышечно-инвазивных и мышечно-инвазивных заболеваний?» . Трансляционная андрология и урология . 5 (5): 692–701. дои : 10.21037/tau.2016.06.13 . ПМК 5071184 . ПМИД 27785426 .
- ^ «Рекомендации ЕАУ: мышечно-инвазивный и метастатический рак мочевого пузыря» . Уровеб .
- ^ Гальский М.Д., Хан Н.М., Розенберг Дж., Сонпавде Г., Хатсон Т., О В.К. и др. (июнь 2011 г.). «Лечение больных метастатическим уротелиальным раком, «непригодным» для химиотерапии на основе цисплатина». Журнал клинической онкологии . 29 (17): 2432–8. дои : 10.1200/JCO.2011.34.8433 . ПМИД 21555688 . S2CID 33263969 .
- ↑ Перейти обратно: Перейти обратно: а б Ким Б. (2018). «Раздел VI. Химиотерапия метастатического рака мочевого пузыря» . Рак мочевого пузыря . Академическая пресса. п. 527. ИСБН 978-0-12-809939-1 . Проверено 27 ноября 2019 г. .
- ^ Лайман Г.Х., Дейл Д.С., Кулакова Е., Поневьерски М.С., Вольф Д.А., Кудерер Н.М. и др. (октябрь 2013 г.). «Влияние гранулоцитарного колониестимулирующего фактора на интенсивность дозы химиотерапии и выживаемость при раке: систематический обзор и метаанализ рандомизированных контролируемых исследований» . Анналы онкологии . 24 (10): 2475–84. дои : 10.1093/annonc/mdt226 . ПМЦ 3841419 . ПМИД 23788754 .
- ^ Гиллиган Т.Д., Стил Г.С., Зитман А.Л., Кантофф П.В. (2003). Химиотерапия метастатических заболеваний . БК Декер.
- ^ Гальский М.Д., Чен Г.Дж., О В.К., Беллмунт Дж., Рот Б.Дж., Петриоли Р. и др. (февраль 2012 г.). «Сравнительная эффективность химиотерапии на основе цисплатина и карбоплатина для лечения распространенной уротелиальной карциномы» . Анналы онкологии . 23 (2): 406–10. дои : 10.1093/annonc/mdr156 . ПМИД 21543626 .
- ^ Шелли, доктор медицинских наук, Кливс А., Уилт Т.Дж., Мейсон, доктор медицинских наук (июль 2011 г.). «Химиотерапия гемцитабином для лечения метастатического рака мочевого пузыря» . БЖУ Интернешнл . 108 (2): 168–79. дои : 10.1111/j.1464-410X.2011.10341.x . ПМИД 21718430 . S2CID 26003400 .
- ^ Аапро М., Абрахамссон П.А., Боди Дж.Дж., Коулман Р.Э., Коломер Р., Коста Л. и др. (март 2008 г.). «Руководство по использованию бисфосфонатов при солидных опухолях: рекомендации международной группы экспертов» . Анналы онкологии . 19 (3): 420–32. дои : 10.1093/annonc/mdm442 . ПМИД 17906299 .
- ^ Шридхар СС (май 2017 г.). «Развивающееся лечение распространенного уротелиального рака» . Журнал онкологической практики . 13 (5): 309–315. дои : 10.1200/JOP.2017.022137 . ПМИД 28489981 .
- ^ Геруллис Х., Ваврошек Ф., Кёне Ч., Экке Т.Х. (январь 2017 г.). «Винфлунин в лечении распространенного уротелиального рака: клинические данные и опыт» . Терапевтические достижения в урологии . 9 (1): 28–35. дои : 10.1177/1756287216677903 . ПМК 5167074 . ПМИД 28042310 .
- ^ Оинг С., Ринк М., Охсле К., Зайдель С., фон Амсберг Г., Бокемейер С. (февраль 2016 г.). «Химиотерапия второй линии при распространенной и метастатической уротелиальной карциноме: винфлунин и не только - всесторонний обзор современной литературы». Журнал урологии . 195 (2): 254–63. дои : 10.1016/j.juro.2015.06.115 . ПМИД 26410730 .
- ^ Ким Б. (2018). «Раздел VI. Химиотерапия метастатического рака мочевого пузыря» . Рак мочевого пузыря . Академическая пресса. п. 530. ИСБН 978-0-12-809939-1 . Проверено 27 ноября 2019 г. .
- ^ «Эрдафитиниб эффективен против распространенного рака мочевого пузыря» . Национальный институт рака . 9 августа 2019 г.
- ^ Конала В.М., Адапа С., Аронов В.С. (февраль 2019 г.). «Иммунотерапия рака мочевого пузыря». Американский журнал терапии . 29 (3): е334–е337. дои : 10.1097/MJT.0000000000000934 . ПМИД 30839322 . S2CID 73472390 .
- ^ Кац Х., Васси Э., Альшареди М. (сентябрь 2017 г.). «Ингибиторы контрольных точек: новая парадигма лечения уротелиального рака мочевого пузыря». Медицинская онкология . 34 (10): 170. дои : 10.1007/s12032-017-1029-8 . ПМИД 28864844 . S2CID 22280860 .
- ↑ Перейти обратно: Перейти обратно: а б с Нараян, Викрам; Кальмейер, Андреас; Дам, Филипп; Скец, Николь; Риск, Майкл С; Бонджорно, Конни; Патель, Нил; Хван, Ю Чанг; Юнг, Джэ Хунг; Гартленер, Джеральд; Кунат, Франк (23 июля 2018 г.). Кокрейновская урологическая группа (ред.). «Монотерапия пембролизумабом по сравнению с химиотерапией для лечения распространенной уротелиальной карциномы с прогрессированием заболевания во время или после химиотерапии, содержащей платину. Кокрейновский краткий обзор» . Кокрейновская база данных систематических обзоров . 2018 (7): CD012838. дои : 10.1002/14651858.CD012838.pub2 . ПМК 6513246 . ПМИД 30036453 .
- ^ Хайденрайх А., Альберс П., Классен Дж., Грефен М., Гшвенд Дж., Котцерке Дж. и др. (2010). «Визуализирующие исследования у пациентов с метастатическим раком мочеполовой системы, проходящих системную терапию: рекомендации междисциплинарного консенсусного совещания Ассоциации урологической онкологии Немецкого онкологического общества» . Международная урология . 85 (1): 1–10. дои : 10.1159/000318985 . ПМИД 20693823 .
- ^ Ллевелин Р. «Критерии оценки ответа при солидных опухолях | Справочная статья по радиологии | Radiopaedia.org» . Радиопедия .
- ^ Сиддики М.Р., Грант С., Сэнфорд Т., Агарвал П.К. (август 2017 г.). «Текущие клинические исследования немышечно-инвазивного рака мочевого пузыря» . Урологическая онкология . 35 (8): 516–527. дои : 10.1016/j.urolonc.2017.06.043 . ПМК 5556973 . ПМИД 28778250 .
- ^ «Рак мочевого пузыря – статистика» . Рак.Нет . 25 июня 2012 г.
- ^ Кауфман Д.С., Шипли В.У., Фельдман А.С. (июль 2009 г.). «Рак мочевого пузыря». Ланцет . 374 (9685): 239–49. дои : 10.1016/S0140-6736(09)60491-8 . ПМИД 19520422 . S2CID 40417997 .
- ^ ван дер Хейден АГ, Витджес Дж.А. (сентябрь 2009 г.). «Рецидив, прогрессирование и наблюдение при немышечно-инвазивном раке мочевого пузыря». Европейские урологические добавки . 8 (7): 556–562. doi : 10.1016/j.eursup.2009.06.010 .
- ^ Тайсон, доктор медицины, Чанг СС, Киган К.А. (2016). «Роль консолидированной хирургической терапии у пациентов с местно-распространенным или регионарно-метастатическим раком мочевого пузыря» . Мочевой пузырь . 3 (2): е26. doi : 10.14440/bladder.2016.89 (неактивен 29 апреля 2024 г.). ПМК 5336315 . ПМИД 28261632 .
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на апрель 2024 г. ( ссылка ) - ^ Чжан Л, Ву Б, Чжа З, Цюй В, Чжао Х, Юань Дж (июль 2019 г.). «Клинико-патологические факторы рака мочевого пузыря, влияющие на выживаемость, специфичную для рака, после радикальной цистэктомии: систематический обзор и метаанализ» . БМК Рак . 19 (1): 716. doi : 10.1186/s12885-019-5924-6 . ПМК 6642549 . ПМИД 31324162 .
- ^ Ку Дж.Х., Кан М., Ким Х.С., Чон К.В., Квак С., Ким Х.Х. (июнь 2015 г.). «Плотность лимфатических узлов как прогностическая переменная при раке мочевого пузыря с поражением узлов: метаанализ» . БМК Рак . 15 : 447. doi : 10.1186/s12885-015-1448-x . ПМК 4450458 . ПМИД 26027955 .
- ^ Ян Л.С., Шан Б.Л., Шан Л.Л., Чин П., Мюррей С., Ахмади Н., Саксена А. (сентябрь 2016 г.). «Систематический обзор и метаанализ результатов качества жизни после радикальной цистэктомии по поводу рака мочевого пузыря». Хирургическая онкология . 25 (3): 281–97. дои : 10.1016/j.suronc.2016.05.027 . ПМИД 27566035 .
- ^ Сомани Б.К., Гимлин Д., Файерс П., Ндоу Дж. (ноябрь 2009 г.). «Качество жизни и образ тела пациентов с раком мочевого пузыря, перенесших радикальную цистэктомию и отведение мочи - проспективное когортное исследование с систематическим обзором литературы». Урология . 74 (5): 1138–43. doi : 10.1016/j.urology.2009.05.087 . ПМИД 19773042 .
- ^ Вартоломей Л., Ферро М., Мирон В., Шариат С.Ф., Вартоломей М.Д. (июль 2018 г.). «Систематический обзор: распространенность депрессии и тревоги у больных раком мочевого пузыря» . Рак мочевого пузыря . 4 (3): 319–326. дои : 10.3233/BLC-180181 . ПМК 6087432 . ПМИД 30112443 .
- ^ Дэвид Э. (февраль 2017 г.). «Психические расстройства ухудшают выживаемость при раке мочевого пузыря» . www.healio.com . Проверено 27 ноября 2019 г. .
- ^ Корреа А.Ф., Смальдоне MC (август 2018 г.). «Меланхолия и рак: история рака мочевого пузыря» . Рак . 124 (15): 3080–3083. дои : 10.1002/cncr.31402 . ПМИД 29660788 .
- ^ «Статистика рака мочевого пузыря» . Всемирный фонд исследования рака . 22 августа 2018 г. Проверено 9 ноября 2019 г.
- ^ «Информационный бюллетень о Греции» (PDF) . Глобальная обсерватория рака . Проверено 9 ноября 2019 г.
- ^ «Оценки ВОЗ по болезням и травмам в странах» . Всемирная организация здравоохранения . 2009. Архивировано из оригинала 11 ноября 2009 года . Проверено 11 ноября 2009 г.
- ^ Ленис, Лек и Шами 2020 , с. 1980 год
- ↑ Перейти обратно: Перейти обратно: а б Дирскьот и др. 2023 г. , «Эпидемиология».
- ↑ Перейти обратно: Перейти обратно: а б Дирскьот и др. 2023 , «Введение».
- ↑ Перейти обратно: Перейти обратно: а б Хемелт М., Ямамото Х., Ченг К.К., член парламента Зигерса (январь 2009 г.). «Влияние курения на распространенность рака мочевого пузыря у мужчин: метаанализ и географический анализ» . Международный журнал рака . 124 (2): 412–9. дои : 10.1002/ijc.23856 . ПМИД 18792102 . S2CID 28518800 .
- ^ Липскомб, Виктория Дж. (2011). «Раздел XI Мочеполовая система. Глава 116 Мочевой пузырь. Неоплазия мочевого пузыря». В Тобиасе, Карен М.; Джонстон, Спенсер А. (ред.). Ветеринарная хирургия . Лондон: Elsevier Health Sciences. стр. 1990–1992 гг. ISBN 9780323263375 .
Цитируемые работы [ править ]
- Дирскёт Л., Хансель Д.Е., Эфстатиу Дж.А., Ноулз М.А., Гальский М.Д., Теох Дж., Теодореску Д. (октябрь 2023 г.). «Рак мочевого пузыря» . Праймеры Nat Rev Dis . 9 (1): 58. дои : 10.1038/s41572-023-00468-9 . ПМЦ 11218610 . ПМИД 37884563 .
- Ленис А.Т., Лек П.М., Шами К. (ноябрь 2020 г.). «Рак мочевого пузыря: обзор». ДЖАМА . 324 (19): 1980–1991. дои : 10.1001/jama.2020.17598 . ПМИД 33201207 .