CREB-связывающий белок
| КРЕББП | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | CREBBP , AW558298, CBP, CBP/p300, KAT3A, p300/CBP, RSTS, CREB-связывающий белок, RSTS1, MKHK1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 600140 ; МГИ : 1098280 ; Гомологен : 68393 ; GeneCards : CREBBP ; ОМА : CREBBP — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
CREB-связывающий белок , также известный как CREBBP или CBP или KAT3A (где CREB — белок, связывающий элемент ответа цАМФ), представляет собой коактиватор, кодируемый CREBBP геном у людей, расположенный на хромосоме 16p13.3. [ 5 ] [ 6 ] CBP имеет внутренние ацетилтрансферазы функции ; он способен добавлять ацетильные группы как к факторам транскрипции, так и к лизинам гистонов, последний из которых, как было показано, изменяет структуру хроматина, делая гены более доступными для транскрипции . [ 7 ] [ 8 ] [ 9 ] [ 10 ] Эта относительно уникальная активность ацетилтрансферазы также наблюдается у другого транскрипционного фермента, EP300 (p300). Вместе они известны как семейство коактиваторов p300-CBP и, как известно, связаны с более чем 16 000 генами человека; однако, хотя эти белки имеют много общих структурных особенностей, новые данные свидетельствуют о том, что эти два коактиватора могут способствовать транскрипции генов с различными биологическими функциями. [ 7 ] [ 11 ] [ 12 ]
Например, только CBP вовлечен в широкий спектр патофизиологических процессов, включая колоректальный рак, а также плоскоклеточный рак головы и шеи . Было показано , что при этих заболеваниях ассоциация CBP с β-катенином способствует пролиферации раковых клеток и агрессивности заболевания, тогда как p300/β-катенин приводит к дифференцировке клеток и/или апоптозу . [ 11 ] [ 13 ] Также было показано, что CBP помогает модулировать функцию печени посредством поддержания энергетического гомеостаза в ответ на изменения условий питания клеток путем регулирования активности транскрипционных факторов и генов, ответственных за липогенез и глюконеогенез . [ 6 ] CBP также вовлечен в этиологию ряда других заболеваний, включая гематологические злокачественные новообразования и другие солидные опухоли, диабет , шизофрению , болезнь Альцгеймера , депрессию и многие другие неврологические состояния. [ 14 ] [ 15 ] [ 16 ] [ 17 ] [ 18 ]
Структура
[ редактировать ]Функциональный CBP имеет длину примерно 7362 нуклеотида и кодирует 2441 аминокислоту. [ 8 ] [ 18 ] CBP не взаимодействует напрямую с элементами промотора; он доставляется к месту посредством белок-белковых взаимодействий, которые являются результатом комплексообразования его различных структурных доменов с другими коактиваторами транскрипции. [ 8 ]
Переходные адаптерные домены цинковых пальцев
[ редактировать ]CBP имеет два домена переходных адаптерных цинковых пальцев (TAZ), каждый из которых состоит из четырех альфа-спиралей, стабилизированных ионами цинка. Оба домена TAZ1 и TAZ2 отдают предпочтение гидрофобным остаткам в амфипатических аминокислотных последовательностях, а их аффинность связывания усиливается за счет взаимодействия кислотных остатков с положительными боковыми цепями. [ 19 ] Факторы, которые связываются с TAZ2, также потенциально регулируются посредством ацетилирования из-за его близости к домену ацетилтрансферазы (KAT). [ 19 ]

Области, богатые цистеином и гистидином
[ редактировать ]Хотя в CBP идентифицированы три богатых цистеином и гистидином домена, структурные функции только доменов 1 и 3 (CH1, CH3) решены. [ 8 ] Ряд факторов, которые связаны с CBP, связываются либо с доменом CH1, либо с доменом CH3, либо с обоими, несмотря на их расположение на противоположных концах белка. На сегодняшний день мало что известно о взаимодействии этих двух областей. Было показано, что первичная структура CH1 и CH3 распадается на консенсусные последовательности, которые способны хелатировать ионы цинка (Zn 2+ ). [ 8 ] Проведенные эксперименты также показали, что остатки в этих последовательностях необходимы для коактивации транскрипции с помощью CH1 или CH3. [ 8 ] Область CH2, расположенная в середине белка в его ацетилтрансферазном домене, не содержит этой консенсусной последовательности, и не было убедительно показано, что она связывает ионы цинка.
Домен, индуцируемый киназой, взаимодействующий домен
[ редактировать ]Домен KIX , связывающий домен CREB, домен взаимодействия MYB
Домен, индуцируемый киназой (KID), взаимодействующий с доменом (KIX), также представляет собой белковый домен на CBP и p300, где гетеродимеры образуются в результате взаимодействия CBP (или p300) с другими факторами транскрипции и коактиваторами. Он состоит из трех альфа-спиралей и двух 3-10 - спиралей, обладающих высоким сродством к амфипатическим белковым последовательностям. [ 19 ] Интересно, что эти спирали могут сворачиваться в ряд различных конформеров, что позволяет домену поддерживать как уровень распущенности, так и осуществлять регуляторный контроль. [ 19 ] Домен KIX контролирует скорость транскрипции и, как было показано, имеет решающее значение для гемопоэтической дифференцировки. [ 8 ] [ 19 ] [ 20 ] Было показано, что некоторые из белков, которые связываются с этим доменом, связываются конкурентно, например CREB и Myb, тогда как другие связываются посредством аллостерической кооперации, как в случае MLL и Myb . [ 19 ]
Бромодомен
[ редактировать ]Бромодомены (BRD) состоят примерно из 110 аминокислот, которые распознают молекулы ацетилированного лизина. [ 8 ] Они состоят из четырех левых альфа-спиралей, соединенных петлями, образующими гидрофобные карманы связывания. [ 8 ] [ 19 ] Бромодомен CBP связывается с областями генома, богатыми ацетилированными остатками лизина, то есть они теряют свой положительный заряд, что снижает сродство гистонов к ДНК, что делает этот участок более открытым и доступным для транскрипции. ацетилированные p53 и STAT3 связываются с бромодоменом CBP. Было показано, что [ 18 ]

Домен лизинацетилтрансферазы
[ редактировать ]Домен лизинацетилтрансферазы (КАТ), состоящий из 380 белковых остатков, возможно, является одним из наиболее важных и идентифицирующих структурных компонентов CBP. Его активность регулируется посредством фосфорилирования CBP. Интересно то, что он способен ацетилировать не только гистоны, но и другие белки. В настоящее время известно более 100 субстратов для домена KAT CBP, включая такие белки, как p53, E2F -1-3, GATA-1 , MyoD и CREB . [ 18 ] Способность CBP ацетилировать p53 через его KAT-домен, что затем увеличивает сродство p53 к бромодомену CBP, демонстрирует интересный механизм, с помощью которого этот уникальный белок может корыстно регулировать транскрипцию генов.
Домен, связывающий коактиватор ядерного рецептора
[ редактировать ]Домен, связывающий фактор ответа интерферона (IBiD)
Домен, связывающий коактиватор ядерного рецептора (NCBD), расположенный на c-конце CBP, в несвязанном состоянии колеблется между несколькими конформациями. [ 19 ] Связывание целевого белка с NCBD приведет к его сворачиванию в три спирали, специально функционирующие для связи с неупорядоченными доменами его партнеров по связыванию. [ 19 ] Среди белков, которые, как известно, связываются с этой областью, есть ACTR (p160) — коактиватор тироидных и ретиноидных рецепторов, его гомолог SRC-1 , p53 и SMAD . [ 20 ] [ 19 ]
Взаимодействия
[ редактировать ]Показано, что белки специфически взаимодействуют с CBP
Функция
[ редактировать ]Этот ген экспрессируется повсеместно и участвует в коактивации транскрипции многих различных факторов транскрипции . CBP имеет два важнейших механизма, с помощью которых он способен регулировать экспрессию генов: как ацетилтрансфераза и как белковый каркас, который помогает рекрутировать и конструировать комплексы, необходимые для транскрипции или ремоделирования хроматина. Фосфорилирование CBP увеличивает его ацетилтрансферазную активность - процесс, который, как предполагается, регулируется в зависимости от клеточного цикла. [ 18 ] Недавние результаты позволяют предположить, что новая активность посттрансляционного N- гликозилирования , опосредованная CBP , изменяет конформацию взаимодействующих с CBP белков, что приводит к регуляции экспрессии генов, росту и дифференцировке клеток. [ 28 ]
Отличие от п300
[ редактировать ]Часто в научных работах (особенно в менее поздних) CBP и p300 используются как взаимозаменяемые как CBP/p300. Это разумное объединение, учитывая гомологию последовательностей, структурное сходство и поведение связывания этих двух белков. Однако текущие исследования показывают, что CBP и p300 поддерживают разные биологические функции и поэтому не должны смешиваться.

Сообщалось, что, несмотря на наличие общих субстратов гистонов, когда доступны меньшие количества гистонов или ацетил-КоА, CBP и p300 имеют разные, предпочтительные субстраты ацетилтрансферазы. [ 18 ] В эксперименте, проведенном с участием герпесвируса, ассоциированного с саркомой Капоши , было показано, что патологический белок (vIRF) активируется CBP и репрессируется p300. [ 12 ] Исследования гомозиготного нокаута p300 на мышах были эмбрионально летальными, с неправильной нейруляцией и плохим развитием сердца, происходящими во время их ограниченной выживаемости. Кроме того, фибробласты, выделенные от этих мышей, не могли правильно пролиферировать и не имели рецептора ретиноевой кислоты . [ 7 ] [ 18 ] Трансгенно измененные мыши, гомозиготные по мутированным копиям CBP (отсутствующие в домене KAT), также были эмбрионально летальными, однако вместо этого у этих мышей наблюдался плохой сосудистый ангиогенез и аномальный гемопоэз, характеризующийся отсутствием пролиферации клеток-предшественников и измененным гемопоэтическим микроокружением. [ 18 ] Тот факт, что гомозиготные нокауты как CBP, так и p300 были эмбрионально летальными, позволяет предположить, что эти факторы играют критическую роль в эмбриогенезе. Дифференциальные фенотипы этих эмбрионов также указывают на то, что CBP и p300 регулируют различные аспекты эмбриологического развития.
Роль в регуляции клеточного цикла
[ редактировать ]
Исследования, проведенные в конце 1990-х годов, показали, что пиковая активность ацетилтрансферазы CBP возникает при переходе между G1/S фазами контрольной точки клеточного цикла . [ 29 ] Учитывая концентрации CDK2, присутствующие в клетке на этой стадии клеточного цикла, было высказано предположение, что CDK2 может быть ключевым регулятором этих посттрансляционных модификаций. [ 7 ] Оказалось, что введение ингибиторов циклина E/CDK2 действительно подавляло ферментативную активность KAT-домена CBP. [ 29 ] Другие белки, которые, как было показано, фосфорилируют CBP, включают MAP-киназу , PKA и CAMK4 . [ 7 ] [ 18 ] Было показано, что Ser-133 является важным остатком, который фосфорилируется с помощью PKA, чтобы инициировать транскрипционную активность CBP. [ 30 ] [ 20 ]
Семейство транскрипционных факторов E2F имеет решающее значение для перевода клетки из фазы G1 в фазу S клеточного цикла. [ 31 ] Они связываются с консенсусной последовательностью в промоторной области генов, участвующих в репликации ДНК. Было показано, что CBP (и p300) взаимодействует с белками E2F как коактиватор и как ацетилтрансфераза, последняя из которых вызывает повышенную аффинность связывания ДНК E2F. [ 5 ] [ 12 ] Нокаут -исследование , опубликованное в 2000 году, в котором использовалась микроинъекция антитела против CBP/p300, значительно уменьшило количество клеток, способных перейти в S-фазу, что еще раз подтверждает идею о том, что CBP важен для транскрипции факторов, необходимых G1/S. фазовый переход. [ 12 ]
Считается также, что CBP облегчает процесс репликации ДНК во время S-фазы путем ацетилирования гистонов вокруг начала репликации . [ 12 ] Ацетилирование гистонов , особенно остатков лизина в гистонах, ослабляет взаимодействие электрических зарядов между гистонами и ДНК, в результате чего эта область становится более открытой и доступной для механизмов, необходимых для репликации ДНК. Два маркера ацетилирования гистонов, которые были связаны с активными областями, включают ацетилирование гистона 3 лизина 18 (H3K18ac) и ацетилирование гистона 3 лизина 27 (H3K27ac). [ 12 ] Было также показано, что CBP ацетилирует две эндонуклеазы ( FEN1 , DNA2 ), которые участвуют в процессинге фрагментов Оказаки . [ 12 ]
Другим ключевым компонентом клеточного цикла, который регулируется CBP, является комплекс/циклосома, способствующий анафазе (APC/C). Этот комплекс состоит из многочисленных субъединиц, которые сгруппированы в два субдомена, «Дуговая лампа» и «Платформа», и функционирует как убиквитинлигаза E3 , которая нацелена на компоненты, связанные с клеточным циклом, такие как циклин B , секурин и PLK1 для протеасом. деградация. [ 32 ] [ 33 ] Было показано, что две субъединицы APC/C напрямую взаимодействуют с CBP: AP5, который расположен в субдомене платформы, и AP7, расположенный в субдомене дуговой лампы. [ 32 ] [ 33 ] Эксперименты, проведенные с использованием RNAi для полного подавления CBP и p300, показали значительное увеличение концентраций белков для тех, на которые обычно нацелен APC/C, и вызвали остановку ряда клеток в митотической фазе клеточного цикла. [ 33 ]
Было показано, что CBP и p300 ацетилируют ключевые факторы, участвующие в различных процессах репарации ДНК , включая эксцизионную репарацию оснований , эксцизионную репарацию нуклеотидов и негомологичное соединение концов . [ 23 ] CBP и p300 играют роль в ацетилировании белков ответа на повреждение ДНК , и эта посттрансляционная модификация влияет на их функцию. [ 23 ]
Роль в болезни
[ редактировать ]Синдром Рубинштейна-Тайби
[ редактировать ]Синдром Рубинштейна-Тайби (СРТ) — редкое генетическое заболевание, которое является результатом генетических мутаций либо в CBP, либо в p300. RTS типа 1, вызываемый мутациями CBP, для которого зарегистрировано более 500 различных вариантов, составляет примерно 55% всех случаев, тогда как RTS типа 2, вызываемый любым из почти 120 различных типов мутаций p300, составляет лишь 8% диагностированных случаев. [ 34 ] Было показано, что большинство этих мутаций вызывают потерю функции гена посредством делеций, точечных или усеченных мутаций. [ 12 ] Статистические данные показывают, что у пациентов с РТС повышен риск развития рака, причем примерно 5% этого риска приходится на педиатрические злокачественные новообразования, исходящие из нервного гребня. [ 12 ] У людей с РТС часто наблюдаются скелетные аномалии, нейроанатомические дефекты и психические нарушения, включая более низкий уровень интеллекта, дефицит внимания и нарушение координации движений. [ 22 ]
| Тип рака | Н | % образцов мутировали |
|---|---|---|
| Фолликулярная лимфома | 66 | 33.3 |
| Плоскоклеточный рак кожи | 77 | 28.6 |
| В-клеточная лимфома маргинальной зоны | 15 | 13.3 |
| Диффузная крупноклеточная В-клеточная лимфома | 242 | 12.0 |
| Рак слюнной железы | 63 | 9.5 |
| Рак мочевого пузыря | 438 | 8.9 |
| Карцинома эндометрия | 337 | 8.0 |
| Мелкоклеточная карцинома легких | 52 | 7.7 |
| ER+ Карцинома молочной железы | 80 | 7.5 |
Рак
[ редактировать ]Было показано, что CBP играет роль на каждой стадии развития опухоли. [ 8 ] Из-за своей решающей роли в регуляции пролиферации, роста, миграции и апоптоза клеток он считается онкогеном или супрессором опухоли. [ 5 ] Напротив, на сегодняшний день повышенная активность CBP связана с множеством различных злокачественных новообразований, включая рак молочной железы , рак легких , рак предстательной железы , колоректальный рак, острые лейкозы, рак головы и шеи и многие другие. [ 8 ] [ 11 ] [ 18 ] [ 12 ] Согласно Каталогу соматических мутаций при раке ( COSMIC ), наиболее распространенными генетическими мутациями при CBP являются миссенс-мутации (составляющие ~71% всех мутаций CBP). Наиболее частые мутации происходят в домене КАТ, что приводит в основном либо к снижению, либо к ингибированию активности ацетилтрансферазы. [ 12 ]
Гематологические злокачественные новообразования
[ редактировать ]Эмбриональные мыши, гетерозиготные по CBP (Cbp +/- ) демонстрировали « экстрамедуллярный гемопоэз , снижение клеточности костного мозга (более низкое соотношение костного мозга и жира) и аномалии кроветворной дифференцировки». [ 18 ] К возрасту 1 год у этих мышей наблюдалась повышенная заболеваемость лейкемией или гематологическими неоплазиями. [ 25 ] Интересно, что секвенирование опухоли показало потерю гетерозиготности по дикого типа аллели . [ 18 ] Одно из объяснений, предложенное для этих экспериментальных результатов, заключается в том, что CBP играет роль в самообновлении гемопоэтических стволовых клеток. [ 18 ]
что у пациентов с диагнозом острый миелоидный лейкоз (ОМЛ) и миелодиспластический синдром CBP начинает функционировать. Было показано, [ 12 ] Это происходит посредством хромосомных транслокаций между CBP и другой ацетилтрансферазой, называемой моноцитарным лейкозом цинкового пальца (MOZ), или между генами MORF (фактор, связанный с MOZ) и MLL (лейкоз смешанного происхождения). [ 12 ] В обоих случаях образуются слитые белки, в которых С-конец CBP теряется, а домены ацетилтрансферазы обоих белков остаются, что приводит к усилению активности КАТ и началу заболевания. [ 12 ]
пациентов с рецидивирующим случаем острого лимфобластного лейкоза (ОЛЛ) были мутации домена CBP KAT. Сообщалось, что примерно у 18% [ 18 ]
Солидные опухоли
[ редактировать ]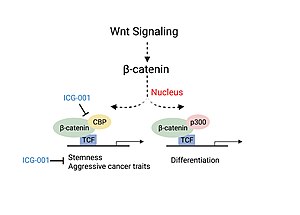
Мутации CBP, хотя и относительно редкие, выявляются при раке легких . [ 21 ] Дальнейший анализ также показал, что на ранних стадиях онкогенеза респираторного эпителия наблюдается повышенная экспрессия CBP, а также AP-1 и циклина D1, факторов, которые, как известно, связаны с транскрипционной активностью CBP. Эта сверхэкспрессия может привести к последующим сигнальным событиям, которые способствуют развитию опухоли легких. [ 21 ]
Тяжесть заболевания колоректального рака и рака головы и шеи (HNSCC) связана с ассоциацией CBP с β-катенином, критическим фактором, участвующим в каноническом Wnt . сигнальном пути [ 11 ] [ 13 ] Ассоциация CBP с β-катенином приводит к транскрипции генов, ответственных за более агрессивные проявления рака, включая наличие популяций раковых стволовых клеток, снижение инфильтрации иммунных клеток и вероятность метастазирования. [ 13 ] Эксперименты по использованию низкомолекулярного ингибитора ассоциации β-катенин/CBP (ICG-001), который не блокирует ассоциацию p300/β-катенин, показали снижение канцерогенеза и усиление клеточной дифференцировки и апоптоза. [ 11 ] [ 13 ]
Повышенная передача сигналов ядерных гормонов, опосредованная рецепторами андрогена (AR) и эстрогена (ER), ответственна за ряд простаты и случаев рака молочной железы соответственно. [ 11 ] Известно, что CBP взаимодействует с AR и ER как в контексте коактиватора, так и в контексте ацетилтрансферазы. Было показано, что ингибирование активности CBP KAT снижает передачу сигналов AR и ER за счет снижения экспрессии рецепторов; это, в свою очередь, подавляет онкогенез обоих злокачественных новообразований. [ 11 ]
Метаболический гомеостаз
[ редактировать ]Энергетический гомеостаз , основанный на балансе глюкозы и липидов , необходим для выживания организма. [ 6 ] Заболевания, сопровождающиеся нарушением метаболической активности , включают ожирение , диабет 2 типа (СД2) и неалкогольную жировую болезнь печени (НАЖБП). В контексте равновесия избыточное питание способствует липогенезу (синтезу липидов) в ответ на повышение концентрации глюкозы и инсулина, а голодание способствует β-окислению (распаду липидов) и глюконеогенезу (синтезу глюкозы). [ 6 ] Эксперименты, проведенные на мышах с ожирением, вызванным диетой, показали усиление липогенеза, вызванное избыточной экспрессией белка, связывающего регуляторные элементы стерола 1C ( SREBP1C ), который работает в координации с белком, связывающим реагирующие на углеводы элементы ( ChREBP ). Оба являются факторами транскрипции, критическими для липогенеза, и оба ацетилируются с помощью CBP, посттрансляционной модификации, которая увеличивает их транскрипционную активность. [ 6 ] Чтобы сбалансировать увеличение синтеза липидов, организму необходимо иметь возможность экспортировать макромолекулы из клеток и хранилищ. Микросомальный белок-переносчик триглицеридов ( MTP ) отвечает за сборку и секрецию липопротеинов и связывается с РНК-хеликазой DDX3, которая взаимодействует с CBP, вызывая ацетилирование HNF4 , что, в свою очередь, увеличивает скорость транскрипции MTP в петле положительной обратной связи. [ 6 ]
CBP также играет роль в регуляции гомеостаза глюкозы во время голодания. Исследования также показали, что глюкагон , гормон, вырабатываемый при низком уровне сахара в крови, активирует белок, связывающий ответный элемент цАМФ ( CREB ), который затем связывается с CBP в качестве коактиватора для транскрипции FOXO1. [ 6 ] FOXO1 является фактором транскрипции ферментов, включая глюкозо-6-фосфатазу и фосфоенолпируваткарбоксикиназу ( PECK1 ), которые необходимы для глюконеогенеза.
Неврологические расстройства
[ редактировать ]Было показано, что CREB обладает нейропротекторными свойствами. [ 14 ] Из-за его связи с CBP понимание роли CBP в неврологических путях и того, как аберрации влияют на заболевание, становится все более интересным. Было разработано множество моделей животных для оценки изменений в двигательных функциях, функциях обучения и памяти у мышей с мутациями CBP. Мыши с условным нокаутом (cKO), которые были гемизиготными по CBP или имели точковые мутации CBP, демонстрировали дефекты памяти, особенно связанные с долговременной памятью . [ 22 ] У мышей с гомозиготными точковыми мутациями в домене CBP KIX наблюдалось нарушение обучения и выполнения двигательных навыков. [ 22 ] В сочетании с неврологическими проблемами, с которыми сталкиваются пациенты с РТС (более низкий уровень интеллекта, дефицит внимания), СВР обусловлено множеством неврологических симптомов, характерных для многих различных типов заболеваний.
Расстройства алкогольного спектра плода
[ редактировать ]Расстройства алкогольного спектра плода (ФАСН) — это класс заболеваний, которые все возникают в результате воздействия алкоголя во время беременности. [ 22 ] Симптомы этих расстройств включают плохое обучение, зависящее от мозжечка, координацию движений и нарушение равновесия. [ 22 ] У крыс с ФАСН было показано, что у них были снижены концентрации CBP и меньшее количество ацетилирования H3 и H4. [ 22 ]
болезнь Хантингтона
[ редактировать ]Болезнь Хантингтона (БГ) — смертельное прогрессирующее нейродегенеративное заболевание, возникающее в результате генетической мутации гена Хантингтина, вызывающей синтез мутированного белка хантингтина (Htt). [ 22 ] Симптомами, наиболее часто связанными с этим заболеванием, являются двигательные расстройства, включая нарушение двигательной функции, изменение поведения и когнитивные нарушения, что в конечном итоге приводит к деменции. [ 35 ] На животных моделях наблюдалось, что у субъектов с HD наблюдалось снижение активности CBP и снижение ацетилирования гистонов нейронов. [ 22 ] Исследования показали, что mutHtt напрямую взаимодействует с CBP. Была выдвинута гипотеза, что мутантный Htt либо способен разрушать CBP, либо напрямую ингибирует ацетилтрансферазный домен CBP. [ 22 ] [ 14 ]
болезнь Альцгеймера
[ редактировать ]Болезнь Альцгеймера (БА) — прогрессирующее нейродегенеративное заболевание, патология которого диагностируется на основании наличия нейритных бляшек бета-амилоида (Аβ) и нейрофибриллярных тау-клубков (τ). [ 22 ] Поскольку точные причины заболевания до конца не изучены, существует ряд различных механизмов, с помощью которых предположительно СВР играет роль в прогрессировании БА. Во многих случаях семейной болезни Альцгеймера с ранним началом (FAD) наблюдаются мутации белков, составляющих фермент, ответственный за образование бляшек Aβ. Активность CBP снижается в отсутствие этих белков ( пресенилин 1 или пресенилин 2 ). [ 16 ] [ 22 ] Кроме того, на мышиных моделях AD было показано снижение ацетилирования гистонов нейронов, критической функции CBP. [ 22 ]
Ингибирование CBP
[ редактировать ]Учитывая контроль CBP над широким спектром физиологических процессов, разработка ингибиторов активности CBP становится все более важной в качестве потенциальной терапии. На сегодняшний день лишь часть того, что было обнаружено, дошла до клинических испытаний.
| Лекарство | Стадия разработки | Заболевание(я)/целевые области | Ссылка |
|---|---|---|---|
| А-485 | In vitro/in vivo | Гематологические злокачественные новообразования, положительный результат на андрогенные рецепторы
рак простаты |
[ 36 ] |
| C646 | In vitro/in vivo | Солидные опухоли, спасение ацетилированием нейроэпителиальных гистонов | [ 8 ] |
| CBP30 | В пробирке | Аутоиммунные заболевания | [ 8 ] |
| CCS1477 | Этап 1б/2а | Рак простаты, устойчивый к кастрации,
гематологические злокачественные новообразования |
[ 10 ] [ 8 ] |
| CPI-637 | In vitro/in vivo | Кастрационно-резистентный рак простаты | [ 37 ] |
| dCBP-1 | В кремнии | Множественная миелома (ММ) | [ 38 ] |
| DC_CP20 | В кремнии | Лейкемия | [ 8 ] |
| Е7386 | Этап 1 | Солидные опухоли, предотвращает белок-белок β-катенин/CBP
взаимодействия |
[ 39 ] |
| Гарцинол | In vitro/in vivo | Рак пищевода | [ 36 ] |
| ГНЕ-049 | In vitro/in vivo | Рак молочной железы и простаты | [ 38 ] |
| ГНЕ-207 | In vitro/in vivo | Острый миелоидный лейкоз (ОМЛ), потенциальные другие
гематологические злокачественные новообразования |
[ 8 ] |
| ГНЕ-781 | In vitro/in vivo | Острый миелоидный лейкоз (ОМЛ), потенциальные другие
гематологические злокачественные новообразования, рак простаты и молочной железы |
[ 38 ] [ 8 ] [ 40 ] |
| ОБД1 | In vitro/in vivo | Почечно-клеточный рак | [ 8 ] [ 41 ] |
| Я-CBP112 | In vitro/in vivo | Бромодомен CBP | [ 8 ] |
| ИКГ-001 | In vitro/in vivo | Колоректальный рак, плоскоклеточный рак головы и шеи | [ 11 ] [ 13 ] |
| КЦН1 | In vitro/in vivo | Глиома | [ 8 ] [ 42 ] |
| МИБМИМ | В кремнии | Острый миелоидный лейкоз (ОМЛ), предотвращает CBP/Myb
белок-белковые взаимодействия |
[ 8 ] |
| СЛЕДУЮЩИЙ | In vitro/in vivo | Аденокарцинома легких | [ 8 ] |
| НЕО2734 | In vitro/in vivo | Рак простаты | [ 8 ] |
| Никур | В кремнии | Желудочно-кишечный рак | [ 8 ] |
| ОМ1 | In vitro/in vivo | Предотвращает белок-белковое взаимодействие CBP/HIF-1α. | [ 8 ] |
| ПРИ-724 | In vitro/in vivo | Фиброз печени | [ 6 ] |
| ПУ139 | In vitro/in vivo | Нейробластома | [ 36 ] |
| Y08197 | В пробирке | Кастрационно-резистентный рак простаты | [ 37 ] |
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000005339 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000022521 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б с д и ж г Чан Х.М., La Thange NB (июль 2001 г.). «Белки p300/CBP: HAT для транскрипционных мостов и каркасов». Журнал клеточной науки . 114 (Часть 13): 2363–2373. дои : 10.1242/jcs.114.13.2363 . ПМИД 11559745 .
- ^ Jump up to: а б с д и ж г час я дж к л м Яо В, Ван Т, Хуан Ф (2018). «p300/CBP как ключевой датчик питания для энергетического гомеостаза печени и фиброза печени» . БиоМед Исследования Интернэшнл . 2018 : 8168791. doi : 10.1155/2018/8168791 . ПМК 5976926 . ПМИД 29862292 .
- ^ Jump up to: а б с д и ж г Во Н, Гудман Р.Х. (апрель 2001 г.). «CREB-связывающий белок и p300 в регуляции транскрипции» . Журнал биологической химии . 276 (17): 13505–13508. дои : 10.1074/jbc.R000025200 . ПМИД 11279224 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v В х и С Акинсику О.Э., Соремекун О.С., Солиман М.Э. (февраль 2021 г.). «Обновленные данные и потенциальные возможности в исследовании CBP [белка, связывающего элемент ответа циклического аденозинмонофосфата (цАМФ) (CREB)] с использованием вычислительных методов» . Белковый журнал . 40 (1): 19–27. дои : 10.1007/s10930-020-09951-8 . ПМЦ 7868315 . ПМИД 33394237 .
- ^ Го П, Чен В, Ли Х, Ли М, Ли Л (октябрь 2018 г.). «Модификации ацетилирования гистонов при раке молочной железы и их терапевтическое значение». Патологические и онкологические исследования . 24 (4): 807–813. дои : 10.1007/s12253-018-0433-5 . ПМИД 29948617 . S2CID 47020435 .
- ^ Jump up to: а б Хэ ZX, Вэй Б.Ф., Чжан X, Гун Ю.П., Ма Л.И., Чжао В. (январь 2021 г.). «Текущее развитие ингибиторов CBP/p300 за последнее десятилетие». Европейский журнал медицинской химии . 209 : 112861. doi : 10.1016/j.ejmech.2020.112861 . ISSN 0223-5234 . ПМИД 33045661 . S2CID 222319204 .
- ^ Jump up to: а б с д и ж г час Бордонаро М., Лазарова Д.Л. (июль 2015 г.). «CREB-связывающий белок, p300, бутират и передача сигналов Wnt при колоректальном раке» . Всемирный журнал гастроэнтерологии . 21 (27): 8238–8248. дои : 10.3748/wjg.v21.i27.8238 . ПМК 4507093 . ПМИД 26217075 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот Аттар Н., СК Курдистан (март 2017 г.). «Использование лизин-ацетилтрансфераз EP300 и CREBBP раком» . Перспективы Колд-Спринг-Харбора в медицине . 7 (3): а026534. doi : 10.1101/cshperspect.a026534 . ПМЦ 5334244 . ПМИД 27881443 .
- ^ Jump up to: а б с д и Карта В.К., Аламуд К.А., Садыков К., Нгуен BC, Ларош Ф., Фенг Х. и др. (июль 2018 г.). «Функциональный и геномный анализ раскрывает терапевтический потенциал воздействия на активность β-катенина/CBP при раке головы и шеи» . Геномная медицина . 10 (1): 54. дои : 10.1186/s13073-018-0569-7 . ПМК 6053793 . ПМИД 30029671 .
- ^ Jump up to: а б с д и Руо С., Леффлер Дж.П., Бутилье А.Л. (сентябрь 2004 г.). «Нацеливание на потерю функции CREB-связывающего белка (CBP) как терапевтическая стратегия при неврологических расстройствах». Биохимическая фармакология . 68 (6): 1157–1164. дои : 10.1016/j.bcp.2004.05.035 . ПМИД 15313413 .
- ^ Ван Х, Сюй Дж, Лазарович П, Кирион Р, Чжэн В (30 августа 2018 г.). «Белок, связывающий элемент ответа цАМФ (CREB): возможная связь сигнальной молекулы в патофизиологии шизофрении» . Границы молекулярной нейронауки . 11 : 255. doi : 10.3389/fnmol.2018.00255 . ПМК 6125665 . ПМИД 30214393 .
- ^ Jump up to: а б Амидфар М., де Оливейра Дж., Кучарска Э., Будни Дж., Ким Ю.К. (сентябрь 2020 г.). «Роль CREB и BDNF в нейробиологии и лечении болезни Альцгеймера». Науки о жизни . 257 : 118020. doi : 10.1016/j.lfs.2020.118020 . ПМИД 32603820 . S2CID 220287306 .
- ^ Стивен А., Фридрих М., Янк П., Хаймер Н., Будчиес Дж., Денкерт С., Селигер Б. (октябрь 2020 г.). «Что включает CREB? И выключает? И почему это имеет значение?» . Клеточные и молекулярные науки о жизни . 77 (20): 4049–4067. дои : 10.1007/s00018-020-03525-8 . ПМЦ 7532970 . ПМИД 32347317 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с Дутта Р., Тиу Б., Сакамото К.М. (сентябрь 2016 г.). «Активность ацетилтрансферазы CBP/p300 при гематологических злокачественных новообразованиях». Молекулярная генетика и обмен веществ . 119 (1–2): 37–43. дои : 10.1016/j.ymgme.2016.06.013 . ПМИД 27380996 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с т в v Дайсон Х.Дж., Райт П.П. (март 2016 г.). «Роль внутреннего белкового расстройства в функции и взаимодействии транскрипционных коактиваторов CREB-связывающего белка (CBP) и p300» . Журнал биологической химии . 291 (13): 6714–6722. дои : 10.1074/jbc.R115.692020 . ПМЦ 4807259 . ПМИД 26851278 .
- ^ Jump up to: а б с Сапио Л., Сальзилло А., Рагоне А., Иллиано М., Спина А., Навильо С. (октябрь 2020 г.). «Нацеливание на CREB в терапии рака: ключевой кандидат или один из многих? Обновление» . Раки . 12 (11): 3166. doi : 10.3390/cancers12113166 . ПМЦ 7693618 . ПМИД 33126560 .
- ^ Jump up to: а б с д и ж г час я дж к л м Карамузис М.В., Константинопулос П.А., Папавассилиу А.Г. (апрель 2007 г.). «Роль CREB-связывающего белка (CBP)/p300 в онкогенезе респираторного эпителия» . Клеточные исследования . 17 (4): 324–332. дои : 10.1038/cr.2007.10 . ПМИД 17372613 . S2CID 36084602 .
- ^ Jump up to: а б с д и ж г час я дж к л м н тот п д р с Валор Л.М., Виоска Дж., Лопес-Аталая Х.П., Барко А. (31 июля 2013 г.). «Лизин-ацетилтрансферазы CBP и p300 как терапевтические мишени при когнитивных и нейродегенеративных расстройствах» . Текущий фармацевтический дизайн . 19 (28): 5051–5064. дои : 10.2174/13816128113199990382 . ПМЦ 3722569 . ПМИД 23448461 .
- ^ Jump up to: а б с д и ж г час я дж к л м н Дутто I, Скалера С, Проспери Э (апрель 2018 г.). «CREBBP и лизин-ацетилтрансферазы p300 в реакции на повреждение ДНК» . Клеточные и молекулярные науки о жизни . 75 (8): 1325–1338. дои : 10.1007/s00018-017-2717-4 . ПМЦ 11105205 . ПМИД 29170789 . S2CID 3951961 .
- ^ Муллан П.Б., Куинн Дж.Э., Харкин Д.П. (сентябрь 2006 г.). «Роль BRCA1 в регуляции транскрипции и контроле клеточного цикла». Онкоген . 25 (43): 5854–5863. дои : 10.1038/sj.onc.1209872 . ПМИД 16998500 . S2CID 41157893 .
- ^ Jump up to: а б с д и ж Блобель Г.А. (01.02.2000). «CREB-связывающий белок и p300: молекулярные интеграторы гемопоэтической транскрипции» . Кровь . 95 (3): 745–755. дои : 10.1182/blood.V95.3.745.003k05_745_755 . ISSN 1528-0020 . ПМИД 10648382 .
- ^ Jump up to: а б с д и ж г час я Ньютон А.Л., Шарп Б.К., Кван А., Маккей Дж.П., Кроссли М. (май 2000 г.). «Домен трансактивации в богатой цистеином/гистидином области 1 CBP включает два новых цинксвязывающих модуля» . Журнал биологической химии . 275 (20): 15128–15134. дои : 10.1074/jbc.M910396199 . ПМИД 10748221 .
- ^ Кантор А.Б., Оркин С.Х. (май 2002 г.). «Транскрипционная регуляция эритропоэза: дело с участием нескольких партнеров». Онкоген . 21 (21): 3368–3376. дои : 10.1038/sj.onc.1205326 . ПМИД 12032775 . S2CID 33364155 .
- ^ Сиддик Х., Рао В.Н., Редди Э.С. (август 2009 г.). «CBP-опосредованное посттрансляционное N-гликозилирование BRCA2» . Международный журнал онкологии . 35 (2): 387–391. дои : 10.3892/ijo_00000351 . ПМИД 19578754 .
- ^ Jump up to: а б Айт-Си-Али С., Рамирес С., Барре FX, Дхисси Ф., Магнаги-Жаулин Л., Жиро Дж.А. и др. (ноябрь 1998 г.). «Активность гистонацетилтрансферазы CBP контролируется циклозависимыми киназами и онкопротеином E1A». Природа . 396 (6707): 184–186. Бибкод : 1998Natur.396..184A . дои : 10.1038/24190 . ПМИД 9823900 . S2CID 4340781 .
- ^ Чжан Х, Конг Ц, Ван Дж, Цзян Ю, Хуа Х (ноябрь 2020 г.). «Комплексная роль передачи сигналов цАМФ-РКА-CREB при раке» . Экспериментальная гематология и онкология . 9 (1): 32. дои : 10.1186/s40164-020-00191-1 . ПМЦ 7684908 . ПМИД 33292604 .
- ^ Рубин С.М., Сейдж Дж., Скотхайм Дж.М. (октябрь 2020 г.). «Интеграция старой и новой парадигм управления G1/S» . Молекулярная клетка . 80 (2): 183–192. doi : 10.1016/j.molcel.2020.08.020 . ПМЦ 7582788 . ПМИД 32946743 .
- ^ Jump up to: а б Бодруг Т., Уэлш К.А., Хинкль М., Эмануэле М.Дж., Браун Н.Г. (24 мая 2021 г.). «Сложные регуляторные механизмы комплекса/циклосомы, способствующего анафазе, и его роль в регуляции хроматина» . Границы клеточной биологии и биологии развития . 9 : 687515. doi : 10.3389/fcell.2021.687515 . ПМК 8182066 . ПМИД 34109183 .
- ^ Jump up to: а б с Тернелл А.С., Стюарт Г.С., Гранд Р.Дж., Рукс С.М., Мартин А., Ямано Х. и др. (декабрь 2005 г.). «APC/C и CBP/p300 взаимодействуют, регулируя транскрипцию и развитие клеточного цикла». Природа . 438 (7068): 690–695. Бибкод : 2005Natur.438..690T . дои : 10.1038/nature04151 . ПМИД 16319895 . S2CID 4432156 .
- ^ Ван Гилс Дж., Магдинье Ф., Фергелот П., Лакомб Д. (июнь 2021 г.). «Синдром Рубинштейна-Тейби: модель эпигенетического расстройства» . Гены . 12 7):968.doi : ( 10.3390/gen12070968 . ПМК 8303114 . ПМИД 34202860 .
- ^ Ким С., Юсефян-Джази А., Чхве Ш., Чанг И, Ли Дж., Рю Х. (ноябрь 2021 г.). «Неклеточные автономные и эпигенетические механизмы болезни Хантингтона» . Международный журнал молекулярных наук . 22 (22): 12499. doi : 10.3390/ijms222212499 . ПМЦ 8617801 . ПМИД 34830381 .
- ^ Jump up to: а б с Ван Ю, Се Q, Тан Х, Ляо М, Чжу С, Чжэн ЛЛ и др. (ноябрь 2021 г.). «Нацеливание на эпигенетические пути рака с помощью низкомолекулярных соединений: терапевтическая эффективность и комбинированная терапия». Фармакологические исследования . 173 : 105702. doi : 10.1016/j.phrs.2021.105702 . ПМИД 34102228 . S2CID 235378858 .
- ^ Jump up to: а б Акинсику О.Э., Соремекун О.С., Олоту Ф.А., Солиман М.Е. (2020). «Изучение роли Asp1116 в селективном нацеливании лекарств на CREBcAMP-чувствительный элемент-связывающий белок, вовлеченный в рак простаты». Комбинаторная химия и высокопроизводительный скрининг . 23 (3): 178–184. дои : 10.2174/1386207323666200219122057 . ПМИД 32072894 . S2CID 211193693 .
- ^ Jump up to: а б с Уодделл А.Р., Хуан Х., Ляо Д. (июнь 2021 г.). «CBP / p300: критические коактиваторы ядерных рецепторов стероидных гормонов и новые терапевтические цели при раке простаты и молочной железы» . Раки . 13 (12): 2872. doi : 10.3390/cancers13122872 . ПМЦ 8229436 . ПМИД 34201346 .
- ^ «CREB-связывающий белок (CBP)/ингибитор β-катенина E7386, созданный совместно Eisai и PRISM BioLab, прошел клинический POC (доказательство концепции) | Выпуск новостей: 2021 | Eisai Co., Ltd» . www.eisai.com . Проверено 4 декабря 2021 г.
- ^ Ромеро Ф.А., Мюррей Дж., Лай К.В., Цуй В., Альбрехт Б.К., Ан Л. и др. (ноябрь 2017 г.). «GNE-781, высокоэффективный и селективный бромодоменный ингибитор циклического аденозинмонофосфатного элемента, связывающего белок, связывающий белок (CBP)». Журнал медицинской химии . 60 (22): 9162–9183. doi : 10.1021/acs.jmedchem.7b00796 . ПМИД 28892380 .
- ^ Фарриа А., Ли В., Дент С.Ю. (сентябрь 2015 г.). «КАТ при раке: функции и методы лечения» . Онкоген . 34 (38): 4901–4913. дои : 10.1038/onc.2014.453 . ПМК 4530097 . ПМИД 25659580 .
- ^ Инь С., Калуз С., Деви Н.С., Джаббар А.А., де Норонья Р.Г., Мун Дж. и др. (декабрь 2012 г.). «Арилсульфонамид KCN1 ингибирует рост глиомы in vivo и препятствует передаче сигналов HIF, нарушая взаимодействие HIF-1α с кофакторами p300/CBP» . Клинические исследования рака . 18 (24): 6623–6633. дои : 10.1158/1078-0432.CCR-12-0861 . ПМЦ 3518680 . ПМИД 22923450 .
Дальнейшее чтение
[ редактировать ]- Гольдман П.С., Тран В.К., Гудман Р.Х. (1997). «Многофункциональная роль коактиватора CBP в регуляции транскрипции». Последние достижения в исследованиях гормонов . 52 : 103–19, обсуждение 119–20. ПМИД 9238849 .
- Марчелло А., Зоппе М., Джакка М. (март 2001 г.). «Множественные способы регуляции транскрипции с помощью трансактиватора Tat ВИЧ-1» . ИУБМБ Жизнь . 51 (3): 175–181. дои : 10.1080/152165401753544241 . ПМИД 11547919 . S2CID 10931640 .
- Мэтт Т. (2002). «Транскрипционный контроль воспалительной реакции: роль CREB-связывающего белка (CBP)». Акта Медика Австрия . 29 (3): 77–79. дои : 10.1046/j.1563-2571.2002.02010.x . ПМИД 12168567 .
- Комбс Р., Боллс М., Бансил Л., Барратт М., Белл Д., Ботэм П. и др. (2002). «Оценка прогресса в использовании альтернатив при тестировании на токсичность с момента публикации отчета второго комитета по токсичности FRAME (1991)» . Альтернативы лабораторным животным . 30 (4): 365–406. дои : 10.1177/026119290203000403 . ПМИД 12234245 . S2CID 26326825 .
- Мингетти Л., Висентин С., Патрицио М., Франчини Л., Аджмоне-Кэт М.А., Леви Г. (май 2004 г.). «Множественное действие белка Tat вируса иммунодефицита человека типа 1 на функции клеток микроглии». Нейрохимические исследования . 29 (5): 965–978. дои : 10.1023/B:NERE.0000021241.90133.89 . ПМИД 15139295 . S2CID 25323034 .
- Кино Т., Павлакис Г.Н. (апрель 2004 г.). «Молекулы-партнеры добавочного белка Vpr вируса иммунодефицита человека 1-го типа» . ДНК и клеточная биология . 23 (4): 193–205. дои : 10.1089/104454904773819789 . ПМИД 15142377 .
- Грин У.К., Чен Л.Ф. (2004). «Регуляция действия NF-κB путем обратимого ацетилирования». Обратимое ацетилирование белков . Симпозиумы Фонда Новартис. Том. 259. стр. 208–17, обсуждение 218–25. дои : 10.1002/0470862637.ch15 . ISBN 9780470862612 . ПМИД 15171256 .
{{cite book}}:|journal=игнорируется ( помогите ) - Лиу Л.И., Херрманн Ч., Райс А.П. (сентябрь 2004 г.). «ВИЧ-1-инфекция и регуляция функции Tat в макрофагах». Международный журнал биохимии и клеточной биологии . 36 (9): 1767–1775. doi : 10.1016/j.biocel.2004.02.018 . ПМИД 15183343 .
- Пульезе А., Видотто В., Бельтрамо Т., Петрини С., Торре Д. (2005). «Обзор биологических эффектов белка Tat ВИЧ-1». Клеточная биохимия и функции . 23 (4): 223–227. дои : 10.1002/cbf.1147 . ПМИД 15473004 . S2CID 8408278 .
- Баннварт С., Гатиньоль А. (январь 2005 г.). «РНК TAR ВИЧ-1: мишень молекулярных взаимодействий между вирусом и его хозяином». Текущие исследования ВИЧ . 3 (1): 61–71. дои : 10.2174/1570162052772924 . ПМИД 15638724 .
- Ле Рузик Э., Бенишу С. (февраль 2005 г.). «Белок Vpr ВИЧ-1: различные роли в жизненном цикле вируса» . Ретровирусология . 2:11 . дои : 10.1186/1742-4690-2-11 . ПМК 554975 . ПМИД 15725353 .
- Джибеллини Д., Витоне Ф., Скьявоне П., Ре MC (апрель 2005 г.). «Тат-белок ВИЧ-1, пролиферация и выживаемость клеток: краткий обзор». Новая микробиология . 28 (2): 95–109. ПМИД 16035254 .
- Хетцер С., Дормейер В., Шнольцер М., Отт М. (октябрь 2005 г.). «Расшифровка Tat: биология посттрансляционных модификаций Tat ВИЧ» . Микробы и инфекции . 7 (13): 1364–1369. дои : 10.1016/j.micinf.2005.06.003 . ПМИД 16046164 .
- Перуцци Ф (январь 2006 г.). «Множественные функции Tat ВИЧ-1: пролиферация против апоптоза» . Границы бионауки . 11 : 708–717. дои : 10.2741/1829 . ПМИД 16146763 . S2CID 12438136 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о синдроме Рубинштейна-Тайби
- CREBBP+белок+человек Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- НУРСА C39
- Drosophila nejire - Интерактивная муха
- человека Расположение генома CREBBP и CREBBP страница сведений о гене в браузере генома UCSC .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .