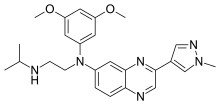
Эрдафитиниб
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Бальверса |
| Другие имена | JNJ-42756493 |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а619031 |
| Данные лицензии |
|
| Маршруты администрация | Через рот |
| Класс препарата | Азоторганические соединения |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ПабХим SID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.235.008 |
| Химические и физические данные | |
| Формула | С 25 Н 30 Н 6 О 2 |
| Молярная масса | 446.555 g·mol −1 |
| 3D model ( JSmol ) | |
Эрдафитиниб , продаваемый под торговой маркой Balversa , является противораковым препаратом . Это низкомолекулярный ингибитор рецептора фактора роста фибробластов (FGFR), используемый для лечения рака. FGFR представляют собой подмножество тирозинкиназ , которые не регулируются в некоторых опухолях и влияют на дифференцировку , пролиферацию, ангиогенез и выживаемость опухолевых клеток. [ 4 ] [ 5 ] Компания Astex Pharmaceuticals обнаружила препарат [ 6 ] и передал лицензию компании Janssen Pharmaceuticals для дальнейшего развития . [ 4 ]
Исследователи исследовали безопасность и эффективность эрдафитиниба при лечении рака желчных протоков , рака желудка , немелкоклеточного рака легких и рака пищевода . [ 7 ]
Медицинское использование
[ редактировать ]США (FDA) одобрило эрдафитиниб В апреле 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов для лечения метастатического или местно-распространенного рака мочевого пузыря с изменением FGFR3 или FGFR2, которое выходит за рамки традиционной терапии на основе платины, при условии подтверждающего исследования. [ 5 ] [ 8 ] [ 9 ] США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) считает его первым в своем классе лекарством . [ 10 ]
В январе 2024 года FDA одобрило эрдафитиниб для взрослых с местно-распространенным или метастатическим уротелиальным раком с чувствительными генетическими изменениями FGFR3, что определяется одобренным FDA сопутствующим диагностическим тестом, у которых заболевание прогрессировало на фоне или после хотя бы одной линии предшествующей системной терапии. [ 11 ]
Побочные эффекты
[ редактировать ]Общие побочные эффекты включают повышенный уровень фосфатов, язвы во рту, чувство усталости, изменение функции почек, диарею, сухость во рту, отслоение ногтей от ложа или плохое формирование ногтей, изменение функции печени, низкий уровень соли (натрия), снижение аппетита. , изменение вкусовых ощущений, низкий уровень эритроцитов (анемия), сухость кожи, сухость глаз и выпадение волос. [ 5 ] Другие побочные эффекты включают покраснение, отек, шелушение или болезненность рук или ног (синдром кистей и стоп), запор, боль в животе, тошноту и мышечные боли. [ 5 ]
Эрдафитиниб может вызвать серьезные проблемы со зрением, включая воспаление глаз, воспаление роговицы (передней части глаза) и нарушения сетчатки, внутренней части глаза. [ 5 ] Пациентам рекомендуется периодически проходить проверку зрения и немедленно сообщать своему лечащему врачу, если у них развивается нечеткость зрения, потеря зрения или другие изменения зрения. [ 5 ]
История
[ редактировать ]Эффективность эрдафитиниба изучалась в клиническом исследовании (NCT02365597), в котором приняли участие 87 взрослых с местно-распространенным или метастатическим раком мочевого пузыря с генетическими изменениями FGFR3 или FGFR2, которые прогрессировали после лечения химиотерапией. [ 5 ] [ 12 ] Общий уровень ответа у этих взрослых составил 32,2%, при этом 2,3% имели полный ответ и почти 30% имели частичный ответ. [ 5 ] Реакция длилась в среднем примерно пять с половиной месяцев. [ 5 ] Испытание проводилось в Азии, Европе и США. [ 12 ]
Эрдафитиниб получил ускоренное одобрение. [ 5 ] Для подтверждения клинической пользы эрдафитиниба необходимы дальнейшие клинические исследования, и спонсор проводит или планирует провести эти исследования. [ 5 ] Эрдафитинибу также был присвоен статус «прорывной терапии» . [ 5 ] FDA предоставило компании Janssen Pharmaceutical одобрение на препарат Бальверса. [ 5 ] [ 9 ] FDA также одобрило набор Therascreen FGFR RGQ RT-PCR Kit, разработанный Qiagen Manchester, Ltd., для использования в качестве сопутствующего диагностического средства с эрдафинитибом по этому терапевтическому показанию. [ 5 ]
В январе 2024 года FDA одобрило эрдафитиниб для взрослых с местно-распространенным или метастатическим уротелиальным раком с чувствительными генетическими изменениями FGFR3, что определяется одобренным FDA сопутствующим диагностическим тестом, у которых заболевание прогрессировало на фоне или после хотя бы одной линии предшествующей системной терапии. [ 11 ] Это одобрение вносит изменения в показание, ранее предоставленное в рамках ускоренного одобрения для людей с метастатической уротелиальной карциномой с чувствительными изменениями FGFR3 или FGFR2 после предшествующей платиносодержащей химиотерапии. [ 11 ] Эффективность оценивалась в исследовании BLC3001 когорта 1, рандомизированном открытом исследовании с участием 266 участников с метастатической уротелиальной карциномой, содержащей выбранные изменения FGFR3, которые ранее получали 1-2 системных лечения, включая ингибитор PD-1 или PD-L1. [ 11 ] Участники были рандомизированы 1:1 для получения эрдафитиниба или химиотерапии по выбору исследователя (доцетаксел или винфлунин). [ 11 ] Рандомизация была стратифицирована по региону, состоянию здоровья и наличию висцеральных или костных метастазов. [ 11 ] Изменения FGFR3 были выявлены в опухолевой ткани в центральной лаборатории с помощью набора therascreen FGFR RGQ RT-PCR (Qiagen) у 75% участников, а остальные были идентифицированы с помощью локальных анализов секвенирования следующего поколения. [ 11 ]
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]присвоило эрдафитинибу статус революционной терапии В марте 2018 года FDA для лечения уротелиального рака . [ 4 ]
В июне 2024 года Комитет по лекарственным средствам для применения человеком Европейского агентства по лекарственным средствам принял положительное заключение, рекомендовав выдать регистрационное удостоверение на лекарственный препарат Бальверса, предназначенный для лечения уротелиальной карциномы, несущей чувствительные генетические изменения FGFR3. [ 13 ] [ 14 ] Заявителем данного лекарственного препарата является компания Janssen-Cilag International NV. [ 13 ]
Ссылки
[ редактировать ]- ^ «Информация о продукте Balversa» . Здоровье Канады . Проверено 29 мая 2022 г.
- ^ «Краткая основа решения (SBD) для Balversa» . Здоровье Канады . 23 октября 2014 года . Проверено 29 мая 2022 г.
- ^ «Бальверса-эрдафитиниб таблетка, покрытая пленочной оболочкой» . ДейлиМед . 1 февраля 2024 г. Проверено 29 июня 2024 г.
- ^ Перейти обратно: а б с «Janssen объявляет о назначении эрдафитиниба революционной терапией FDA США для лечения метастатического уротелиального рака» . Джонсон и Джонсон (пресс-релиз). Архивировано из оригинала 20 июня 2018 года.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н «FDA одобрило первую таргетную терапию метастатического рака мочевого пузыря» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 12 апреля 2019 года. Архивировано из оригинала 15 ноября 2019 года . Проверено 13 мая 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Саксти Дж. (3 ноября 2011 г.). «Ингибиторы пиразолилхиназолинкиназы» . Гугл Патенты .
- ^ Бахледа Р., Итальяно А., Йерро С., Мита А., Сервантес А., Чан Н. и др. (август 2019 г.). «Мультицентровое исследование фазы I эрдафитиниба (JNJ-42756493), перорального ингибитора рецептора панфибробластного фактора роста, у пациентов с распространенными или рефрактерными солидными опухолями» . Клин. Рак Рез . 25 (16): 4888–97. дои : 10.1158/1078-0432.CCR-18-3334 . hdl : 10854/7722 . ПМИД 31088831 . S2CID 155089088 .
- ^ «Бальверса (эрдафитиниб) получает одобрение FDA США для лечения пациентов с местно-распространенной или метастатической уротелиальной карциномой с определенными генетическими изменениями FGFR» . Джонсон и Джонсон (пресс-релиз). 8 мая 2019 г. Архивировано из оригинала 8 мая 2019 г. . Проверено 24 ноября 2019 г.
- ^ Перейти обратно: а б «Пакет одобрения препарата: Бальверса (эрдафинитиб)» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) .
- ^ «Разрешения на новую лекарственную терапию 2019» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 31 декабря 2019 года . Проверено 15 сентября 2020 г.
- ^ Перейти обратно: а б с д и ж г «FDA одобрило эрдафитиниб для лечения уротелиальной карциномы» . Управление по контролю за продуктами и лекарствами США . 19 января 2024 г. Проверено 9 марта 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б «Снимки испытаний наркотиков: Бальверса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 12 апреля 2019 года. Архивировано из оригинала 27 сентября 2019 года . Проверено 24 ноября 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б «Балверса ЭПАР» . Европейское агентство лекарственных средств (EMA) . 27 июня 2024 г. Проверено 29 июня 2024 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Основные сведения о заседании Комитета по лекарственным препаратам для человеческого применения (CHMP) 24–27 июня 2024 г.» . Европейское агентство по лекарственным средствам . 28 июня 2024 года. Архивировано из оригинала 12 июля 2024 года . Проверено 12 июля 2024 г.