Осимертиниб
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Тагриссо и другие |
| Другие имена | AZD9291, мерелетиниб, мезилат осимертиниба ( JAN JP ), мезилат осимертиниба ( США, США ) |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а616005 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Связывание с белками | Вероятно, высокий [4] |
| Метаболизм | Окисление ( CYP3A ) |
| Период полувыведения | 48 часов |
| Экскреция | Кал (68%), моча (14%) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| PDB-лиганд | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
| Формула | С 28 Н 33 Н 7 О 2 |
| Молярная масса | 499.619 g·mol −1 |
| 3D model ( JSmol ) | |
Осимертиниб , продаваемый под торговой маркой Тагриссо . [6] — препарат, используемый для лечения немелкоклеточного рака легких со специфическими мутациями. [7] [8] Это рецептора эпидермального фактора роста ингибитор тирозинкиназы третьего поколения .
Наиболее распространенные побочные эффекты включают диарею, сыпь, скелетно-мышечные боли, сухость кожи, воспаление кожи вокруг ногтей, боль во рту, усталость и кашель. [9]
Осимертиниб был одобрен для медицинского применения в США в ноябре 2015 года. [10] и в Европейском Союзе в феврале 2016 г. [5]
Медицинское использование
[ редактировать ]Осимертиниб используется для лечения местно-распространенного или метастатического немелкоклеточного рака легких (НМРЛ), если раковые клетки положительны по мутации T790M в гене, кодирующем EGFR , или по активации мутаций EGFR. [4] [11] Мутация T790M может возникнуть de novo или быть приобретенной после лечения первой линии другими ингибиторами тирозинкиназы EGFR, такими как гефитиниб , эрлотиниб и афатиниб . [12]
В США делеции экзона 19 EGFR, мутации экзона 21 L858R или статус T790M пациента до лечения осимертинибом должны быть обнаружены с помощью сопутствующего диагностического теста. [4] Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило для этой цели несколько тестов, включая FoundationOne CDx . [13] В Европе и других странах активирующие мутации EGFR или мутации T790M можно определить с помощью валидированного теста. [14]
В феврале 2024 года FDA одобрило осимертиниб в сочетании с химиотерапией на основе платины для людей с местно-распространенным или метастатическим немелкоклеточным раком легкого, опухоли которых имеют делеции экзона 19 EGFR или мутации экзона 21 L858R, обнаруженные одобренным FDA препаратом. тест. [15]
У людей, получающих осимертиниб, резистентность обычно развивается примерно в течение десяти месяцев. [16] Резистентность, опосредованная мутацией C797S экзона 20, составляет большинство случаев резистентности. [17] что привело к многочисленным попыткам с помощью неконкурентных АТФ или аллостерических ингибиторов попытаться компенсировать эту приобретенную устойчивость путем воздействия на другие области киназного домена RTK. [18]
Побочные эффекты
[ редактировать ]Очень распространенные (более 10% участников клинических исследований) побочные эффекты включают диарею, стоматит , сыпь, сухость или зуд кожи, инфекции в местах соприкосновения ногтей на руках или ногах с кожей , низкое количество тромбоцитов, низкое количество лейкоцитов и низкое количество нейтрофилов. [19]
К частым (от 1% до 10% участников клинических исследований) побочным эффектам относятся интерстициальные заболевания легких . [19]
Это может нанести вред плоду. [4] [20]
Взаимодействия
[ редактировать ]Осимертиниб метаболизируется CYP3A4 и CYP3A5 , поэтому вещества, которые сильно ингибируют оба фермента, такие как макролидные антибиотики, противогрибковые и противовирусные препараты, могут увеличить воздействие осимертиниба, а такие вещества, как рифампицин , которые активируют любой фермент, могут снизить эффективность осимертиниба. [4] [19]
Фармакология
[ редактировать ]Осимертиниб преимущественно необратимо связывается с мутировавшими белками рецептора эпидермального фактора роста , особенно с белками с более распространенными мутациями при раке легких, такими как мутация L858R или делеция экзона 19. [4]
Он демонстрирует линейную фармакокинетику ; среднее время достижения Cmax составляет 6 часов (диапазон 3–24 часа). Расчетный средний период полувыведения составляет 48 часов, а клиренс при пероральном приеме (CL/F) — 14,3 (л/ч). [4] 68% выведения происходит с калом и 14% с мочой. [4]
Химия
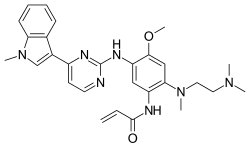
[ редактировать ]Осимертиниб выпускается в форме мезилата ; химическая формула C 28 H 33 N 7 O 2 ·CH 4 O 3 S, молекулярная масса 596 г/моль. Химическое название: N-(2-{2-диметиламиноэтилметиламино}-4-метокси-5-{[4-(1-метилиндол-3-ил)пиримидин-2-ил]амино}фенил)проп-2-. енамидмезилатная соль. [4]
История
[ редактировать ]Программа разработки лекарств , которая привела к созданию осимертиниба, началась в 2009 году и привела к созданию препарата к 2012 году; Этот процесс был структурно-ориентированным и был направлен на поиск ингибитора EGFR третьего поколения, который избирательно воздействовал бы на форму T790M рецептора EGFR. [21]
Осимертиниб был признан прорывной терапией в апреле 2014 года на основании результатов I фазы исследования. [21] и препарат был предварительно одобрен в рамках программы ускоренного одобрения FDA с ваучером приоритетной проверки в ноябре 2015 года. [22] [10]
В феврале 2016 года EMA предварительно одобрило осимертиниб в рамках ускоренной процедуры — первое одобрение в рамках программы. [21] [5]
В феврале 2024 года FDA одобрило осимертиниб в сочетании с химиотерапией на основе платины для людей с местно-распространенным или метастатическим немелкоклеточным раком легкого, опухоли которых имеют делеции экзона 19 EGFR или мутации экзона 21 L858R, обнаруженные одобренным FDA препаратом. тест. [15] Эффективность оценивалась в открытом рандомизированном исследовании FLAURA 2 (NCT04035486) с участием 557 участников с делецией экзона 19 EGFR или мутацией la/mNSCLC в экзоне 21 L858R и отсутствием предшествующей системной терапии по поводу распространенного заболевания. [15] Участники были рандомизированы 1:1 для получения осимертиниба в сочетании с химиотерапией на основе платины или монотерапии осимертинибом. [15] Заявке были предоставлены приоритетное рассмотрение , ускоренное рассмотрение , революционная терапия и статус орфанного препарата .
Общество и культура
[ редактировать ]Экономика
[ редактировать ]На момент запуска в США AstraZeneca оценила препарат в 12 750 долларов в месяц. [23] : 59
Исследовать
[ редактировать ]По состоянию на 2020 год [update], несколько клинических испытаний продолжаются. [24]
Ссылки
[ редактировать ]- ^ «Лекарства, отпускаемые по рецепту: регистрация новых химических веществ в Австралии, 2016» . Управление терапевтических товаров (TGA) . 21 июня 2022 г. Проверено 10 апреля 2023 г.
- ^ «Обновления о безопасности бренда в монографии о продукции» . Здоровье Канады . Февраль 2024 года . Проверено 24 марта 2024 г.
- ^ «Разрешения на новые лекарства Министерства здравоохранения Канады: основные события 2016 г.» . Здоровье Канады . 14 марта 2017 года . Проверено 7 апреля 2024 г.
- ^ Jump up to: а б с д и ж г час я дж «Тагриссо-осимертиниб, таблетка, покрытая пленочной оболочкой» . ДейлиМед . 5 июня 2020 г. Проверено 16 октября 2020 г. .
- ^ Jump up to: а б с «Тагриссо ЭПАР» . Европейское агентство лекарственных средств (EMA) . 17 сентября 2018 года . Проверено 16 октября 2020 г. .
- ^ «Предлагаемый МНН: Список 113» (PDF) . Международные непатентованные наименования фармацевтических субстанций (МНН) . 29 (2): 285. 2015. Архивировано (PDF) из оригинала 28 апреля 2017 года . Проверено 16 ноября 2015 г.
- ^ Айени Д., Полити К., Голдберг С.Б. (сентябрь 2015 г.). «Новые агенты и новые мутации при раке легких с мутацией EGFR» . Клинические исследования рака . 21 (17): 3818–20. дои : 10.1158/1078-0432.CCR-15-1211 . ПМК 4720502 . ПМИД 26169963 .
- ^ Тан К.С., Гиллиган Д., Пейси С. (сентябрь 2015 г.). «Подходы к лечению пациентов с немелкоклеточным раком легких, устойчивых к ингибиторам EGFR» . «Ланцет». Онкология . 16 (9): е447–е459. дои : 10.1016/S1470-2045(15)00246-6 . ПМИД 26370354 .
- ^ «FDA одобрило первую адъювантную терапию для наиболее распространенного типа рака легких» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 18 декабря 2020 г. Проверено 20 декабря 2020 г.
- ^ Jump up to: а б «Табриссо (осимертиниб) таблетки» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 22 декабря 2015 года . Проверено 16 октября 2020 г. .
- Разместить резюме в: «Краткий обзор» (PDF) . Соглашение о неразглашении . 10 ноября 2015 г.
- ^ Гейтенбек Р.Г., Дамхейс Р.А., ван дер Веккен А.Дж., Хендрикс Л.Е., Гроен Х.Дж., ван Геффен В.Х. (апрель 2023 г.). «Общая выживаемость при немелкоклеточном раке легкого с мутацией рецептора эпидермального фактора роста с использованием различных ингибиторов тирозинкиназы в Нидерландах: ретроспективное общенациональное исследование реестра» . Журнал Lancet Regional Health. Европа . 27 : 100592. doi : 10.1016/j.lanepe.2023.100592 . ПМЦ 9932646 . ПМИД 36817181 .
- ^ Сюй М, Се Ю, Ни С, Лю Х (май 2015 г.). «Новейшие терапевтические стратегии после резистентности к ингибиторам тирозинкиназы рецептора эпидермального фактора роста первого поколения (ИТК EGFR) у пациентов с немелкоклеточным раком легких (НМРЛ)» . Анналы трансляционной медицины . 3 (7): 96. doi : 10.3978/j.issn.2305-5839.2015.03.60 . ПМЦ 4430733 . ПМИД 26015938 .
- ^ Центр устройств и радиологического здоровья. «Диагностика in vitro — список разрешенных или одобренных сопутствующих диагностических устройств (инструментов in vitro и визуализации)» . www.fda.gov . Архивировано из оригинала 25 января 2018 года . Проверено 17 января 2018 г.
- ^ «Информация о европейском Тагриссо» (PDF) . Европейское агентство по лекарственным средствам . Архивировано (PDF) из оригинала 17 января 2018 года . Проверено 17 января 2018 г.
- ^ Jump up to: а б с д «FDA одобрило осимертиниб в сочетании с химиотерапией при немелкоклеточном раке легкого с мутацией EGFR» . Управление по контролю за продуктами и лекарствами США . 16 февраля 2024 г. Проверено 27 февраля 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Патель Х., Павара Р., Ансари А., Сурана С. (декабрь 2017 г.). «Последние новости об ингибиторах EGFR третьего поколения и появлении ингибиторов EGFR четвертого поколения для борьбы с устойчивостью к C797S». Европейский журнал медицинской химии . 142 : 32–47. дои : 10.1016/j.ejmech.2017.05.027 . ПМИД 28526474 .
- ^ Ван С., Сун Ю, Лю Д. (январь 2017 г.). «EAI045: Ингибитор EGFR четвертого поколения, преодолевающий резистентность к T790M и C797S». Письма о раке . 385 : 51–54. дои : 10.1016/j.canlet.2016.11.008 . ПМИД 27840244 .
- ^ Сараон П., Патманатан С., Снайдер Дж., Лякишева А., Вонг В., Стагляр I (июнь 2021 г.). «Рецепторные тирозинкиназы и рак: онкогенные механизмы и терапевтические подходы». Онкоген . 40 (24): 4079–4093. дои : 10.1038/s41388-021-01841-2 . ПМИД 34079087 . S2CID 235307318 .
- ^ Jump up to: а б с «Британский лейбл» . Справочник электронных лекарств Великобритании. 26 января 2017 года. Архивировано из оригинала 27 февраля 2017 года . Проверено 27 февраля 2017 г. .
- ^ Bollinger MK, Agnew AS, Mascara GP (июль 2018 г.). «Осимертиниб: ингибитор тирозинкиназы третьего поколения для лечения немелкоклеточного рака легких с мутацией рецептора эпидермального фактора роста и приобретенной мутацией Thr790Met». Журнал онкологической аптечной практики . 24 (5): 379–388. дои : 10.1177/1078155217712401 . ПМИД 28565936 . S2CID 206671000 .
- ^ Jump up to: а б с Ивер А (июнь 2016 г.). «Осимертиниб (AZD9291) — научно обоснованный совместный подход к быстрому проектированию и разработке лекарств» . Анналы онкологии . 27 (6): 1165–70. дои : 10.1093/annonc/mdw129 . ПМИД 26961148 .
- ^ «Разрешенные препараты – Осимертиниб» . США Управление по контролю за продуктами и лекарствами (FDA). 13 ноября 2015 года. Архивировано из оригинала 27 февраля 2017 года . Проверено 27 февраля 2017 г. .
- ^ «Система сканирования горизонтов здравоохранения AHRQ — отчет о потенциальных высокоэффективных вмешательствах, приоритетная область 02: рак» (PDF) . AHRQ. Декабрь 2015 г. Архивировано из оригинала (PDF) 30 апреля 2017 г. . Проверено 27 февраля 2017 г. .
- ^ «Поиск: Осимертиниб — Результаты списка — ClinicalTrials.gov» . www.clinicaltrials.gov . Проверено 27 апреля 2020 г.