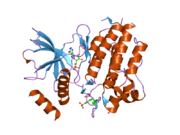RET протоонкоген
| ВЕРНО | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | RET , Ret, PTC, RET51, RET9, c-Ret, CDHF12, CDHR16, HSCR1, MEN2A, MEN2B, MTC1, RET-ELE1, ret протоонкоген | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 164761 ; МГИ : 97902 ; Гомологен : 7517 ; Генные карты : RET ; ОМА : RET — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Протоонкоген RET ) кодирует рецепторную тирозинкиназу членов глиального клеточного нейротрофического фактора (GDNF семейства внеклеточных сигнальных молекул . [5] RET Мутации потери функции связаны с развитием болезни Гиршпрунга . [6] [7] в то время как мутации усиления функции связаны с развитием различных типов рака человека , включая медуллярную карциному щитовидной железы , множественные эндокринные неоплазии типа 2А и 2В, феохромоцитому и гиперплазию паращитовидной железы. [ нужна ссылка ]
Структура
[ редактировать ]RET является аббревиатурой от «перестраивается во время трансфекции », поскольку первоначально было обнаружено, что последовательность ДНК этого гена подвергается реаранжировке внутри клеточной линии фибробластов 3T3 после ее трансфекции ДНК, взятой из клеток лимфомы человека . [8] человека Ген RET локализован на 10-й хромосоме (10q11.2) и содержит 21 экзон . [9]
Естественный альтернативный сплайсинг гена RET . приводит к образованию трех различных изоформ белка RET RET51, RET43 и RET9 содержат 51, 43 и 9 аминокислот в С-концевом хвосте соответственно. [10] Биологическая роль изоформ RET51 и RET9 наиболее хорошо изучена in vivo, поскольку это наиболее распространенные изоформы, в которых встречается RET.
Общим для каждой изоформы является доменная структура. Каждый белок разделен на три домена: N-концевой внеклеточный домен с четырьмя кадгериноподобными повторами и богатой цистеином областью, гидрофобный трансмембранный домен и цитоплазматический тирозинкиназный домен, который расщепляется вставкой из 27 аминокислот . Внутри цитоплазматического тирозинкиназного домена имеется 16 тирозинов (Tyrs) в RET9 и 18 в RET51. Tyr1090 и Tyr1096 присутствуют только в изоформе RET51. [11]
Внеклеточный . домен RET содержит девять N-гликозилирования сайтов Сообщается, что полностью гликозилированный белок RET имеет молекулярную массу 170 кДа, хотя неясно, к какой изоформе относится эта молекулярная масса. [12]
Активация киназы
[ редактировать ]RET является рецептором лигандов семейства GDNF (GFL). [13]
Чтобы активировать RET, GFL сначала необходимо сформировать комплекс с гликозилфосфатидилинозитол (GPI) -корецептором . Сами корецепторы классифицируются как члены семейства белков рецептора GDNF-α (GFRα). Различные члены семейства GFRα ( GFRα1 , GFRα2 , GFRα3 , GFRα4 ) проявляют специфическую связывающую активность для конкретных GFL. [14] При образовании комплекса GFL-GFRα комплекс затем объединяет две молекулы RET, запуская транс-аутофосфорилирование специфических остатков тирозина в тирозинкиназном домене каждой молекулы RET. Tyr900 и Tyr905 внутри петли активации (A-петли) киназного домена являются аутофосфорилирования сайтами По данным масс-спектрометрии, . [15] Фосфорилирование Tyr905 стабилизирует активную конформацию киназы, что, в свою очередь, приводит к аутофосфорилированию других тирозиновых остатков, расположенных преимущественно в С-концевой хвостовой области молекулы. [11]

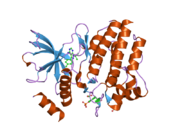
Структура, показанная слева, была взята из банка данных белков под кодом 2IVT . [5] Структура представляет собой димер, образованный между двумя белковыми молекулами, каждая из которых охватывает аминокислоты 703-1012 молекулы RET, охватывая внутриклеточный тирозинкиназный домен RET. Одна молекула белка, молекула А, показана желтым цветом, а другая, молекула Б, — серым. Петля активации окрашена в фиолетовый цвет, а отдельные остатки тирозина — в зеленый. Часть петли активации молекулы Б отсутствует.
фосфорилирование Было показано, что Tyr981 и дополнительных тирозинов Tyr1015, Tyr1062 и Tyr1096, не охваченных вышеуказанной структурой, важно для инициации процессов внутриклеточной передачи сигнала .
Роль передачи сигналов RET во время развития
[ редактировать ]У мышей с дефицитом GDNF, GFRα1 или самого белка RET наблюдаются серьезные дефекты развития почек и кишечной нервной системы . Это подразумевает, что передача сигнала RET является ключом к развитию нормальных почек и кишечной нервной системы . [11]
Клиническая значимость
[ редактировать ]Обнаружено по меньшей мере 26 мутаций этого гена, вызывающих заболевания. [16] Активация точечных мутаций в RET может привести к наследственному раковому синдрому, известному как множественная эндокринная неоплазия типа 2 (МЭН 2). [17] В зависимости от клинической картины выделяют три подтипа: MEN 2A, MEN 2B и семейный медуллярный рак щитовидной железы (FMTC). [18] Существует высокая степень корреляции между положением точковой мутации и фенотипом заболевания.
Хромосомные перестройки, которые генерируют слитый ген, приводящие к совмещению C-концевой области белка RET с N-концевой частью другого белка, также могут приводить к конститутивной активации киназы RET. Эти типы перестроек в первую очередь связаны с папиллярным раком щитовидной железы (ПТК), где они составляют 10-20% случаев, и немелкоклеточным раком легкого (НМРЛ), где они составляют 2% случаев. В литературе описано несколько партнеров слияния, и наиболее распространенные из них для обоих типов рака включают KIF5B , CCDC6 и NCOA4 .
В то время как более старые ингибиторы мультикиназы, такие как кабозантиниб или вандетаниб, показали умеренную эффективность в борьбе с злокачественными новообразованиями, вызванными RET, новые селективные ингибиторы (такие как селперкатиниб и пралсетиниб ) показали значительную активность как в отношении мутаций, так и слияний. Результаты исследования LIBRETTO-001 по изучению селперкатиниба показали выживаемость без прогрессирования 17,5 месяцев при ранее леченном RET-положительном НМРЛ и 22 месяца при RET-положительном раке щитовидной железы, что послужило причиной одобрения FDA для обоих этих показаний в мае 2020 года. Несколько других селективных ингибиторов RET находятся в стадии разработки, в том числе TPX-0046, макроциклический ингибитор RET и Src, предназначенный для ингибирования мутаций, обеспечивающих устойчивость к современным ингибиторам.
База данных заболеваний
[ редактировать ]База данных вариантов гена RET в Университете штата Юта идентифицирует (по состоянию на ноябрь 2014 года) 166 мутаций, которые связаны с MEN2 .
Взаимодействия
[ редактировать ]Было показано, что протоонкоген RET взаимодействует с:
- ДОК1 , [19]
- ДОК5 , [20] [21]
- Рецептор альфа-1 семейства GDNF , [22] [23]
- ГРБ10 , [24]
- ГРБ7 , [25]
- Грб2 , [24] [26]
- ШК1 , [26] [27] и
- СТАТ3 . [28] [29] [30]
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000165731 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000030110 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б Ноулз П.П., Мюррей-Раст Дж., Кьер С., Скотт Р.П., Ханрахан С., Санторо М. и др. (ноябрь 2006 г.). «Структура и химическое ингибирование тирозинкиназного домена RET» . Журнал биологической химии . 281 (44): 33577–33587. дои : 10.1074/jbc.M605604200 . ПМИД 16928683 .
- ^ Вейга-Фернандес Х., Пахнис В. (февраль 2017 г.). «Нейроиммунная регуляция во время развития кишечника и гомеостаза». Природная иммунология . 18 (2): 116–122. дои : 10.1038/ni.3634 . ПМИД 28092371 . S2CID 5519816 .
- ^ Бахрами А., Джуди М., Моэтамани-Ахмади М., Мафтух М., Хасанян С.М., Фернс Г.А., Аван А (январь 2018 г.). «Генетическая основа болезни Гиршпрунга: мост между фундаментальной наукой и клиническим применением». Журнал клеточной биохимии . 119 (1): 28–33. дои : 10.1002/jcb.26149 . ПМИД 28543993 . S2CID 12086686 .
- ^ Такахаши М., Ритц Дж., Купер Г.М. (сентябрь 1985 г.). «Активация нового трансформирующего гена человека ret путем перестройки ДНК». Клетка . 42 (2): 581–588. дои : 10.1016/0092-8674(85)90115-1 . ПМИД 2992805 . S2CID 13567823 .
- ^ Чеккерини И, Бочарди Р, Луо Й, Пасини Б, Хофстра Р, Такахаши М, Ромео Дж (ноябрь 1993 г.). «Структура экзона и фланкирующие интронные последовательности протоонкогена RET человека». Связь с биохимическими и биофизическими исследованиями . 196 (3): 1288–1295. дои : 10.1006/bbrc.1993.2392 . ПМИД 7902707 .
- ^ Майерс С.М., Энг К., Пондер Б.А., Маллиган Л.М. (ноябрь 1995 г.). «Характеристика 3'-вариантов сплайсинга протоонкогена RET и сайтов полиаденилирования: новый С-конец для RET». Онкоген . 11 (10): 2039–2045. ПМИД 7478523 .
- ^ Jump up to: а б с Ариги Э., Боррелло М.Г., Сариола Х. (2005). «Передача сигналов тирозинкиназы RET в развитии и раке». Обзоры цитокинов и факторов роста . 16 (4–5): 441–467. doi : 10.1016/j.cytogfr.2005.05.010 . ПМИД 15982921 .
- ^ Такахаси М., Асаи Н., Ивашита Т., Исомура Т., Миядзаки К., Мацуяма М. (ноябрь 1993 г.). «Характеристика продуктов протоонкогена ret, экспрессируемых в L-клетках мыши» . Онкоген . 8 (11): 2925–2929. ПМИД 8414495 .
- ^ Балох Р.Х., Эномото Х., Джонсон Э.М., Милбрандт Дж. (февраль 2000 г.). «Лиганды и рецепторы семейства GDNF - значение для развития нервной системы». Современное мнение в нейробиологии . 10 (1): 103–110. дои : 10.1016/S0959-4388(99)00048-3 . ПМИД 10679429 . S2CID 32315320 .
- ^ Айраксинен М.С., Титиевский А, Саарма М (май 1999 г.). «Передача сигналов нейротрофических факторов семейства GDNF: четыре хозяина, один слуга?». Молекулярная и клеточная нейронауки . 13 (5): 313–325. дои : 10.1006/mcne.1999.0754 . ПМИД 10356294 . S2CID 46427535 .
- ^ Кавамото Ю., Такеда К., Окуно Ю., Ямакава Ю., Ито Ю., Тагучи Р. и др. (апрель 2004 г.). «Идентификация сайтов аутофосфорилирования RET методом масс-спектрометрии» . Журнал биологической химии . 279 (14): 14213–14224. дои : 10.1074/jbc.M312600200 . ПМИД 14711813 .
- ^ Шимчикова Д., Хенеберг П. (декабрь 2019 г.). «Уточнение прогнозов эволюционной медицины на основе клинических данных о проявлениях менделевских болезней» . Научные отчеты . 9 (1): 18577. Бибкод : 2019NatSR...918577S . дои : 10.1038/s41598-019-54976-4 . ПМК 6901466 . ПМИД 31819097 .
- ^ Интернет-менделевское наследование у человека (OMIM): МНОЖЕСТВЕННЫЕ ЭНДОКРИННЫЕ НЕОПЛАЗИИ, ТИП IIA; МУЖЧИНЫ2А - 171400
- ^ Ци Х.П., Ма Дж.М., Ду З.Ф., Ин Р.Б., Фей Дж., Джин Х.И. и др. (2011). «Мутации зародышевой линии RET, выявленные с помощью секвенирования экзома в семействе китайской множественной эндокринной неоплазии типа 2А/семейной медуллярной карциномы щитовидной железы» . ПЛОС ОДИН . 6 (5): е20353. Бибкод : 2011PLoSO...620353Q . дои : 10.1371/journal.pone.0020353 . ПМК 3105051 . ПМИД 21655256 .
- ^ Мураками Х., Ямамура Ю., Симоно Ю., Каваи К., Курокава К., Такахаши М. (сентябрь 2002 г.). «Роль Dok1 в передаче сигналов в клетках, опосредованной тирозинкиназой RET» . Журнал биологической химии . 277 (36): 32781–32790. дои : 10.1074/jbc.M202336200 . ПМИД 12087092 .
- ^ Краудер Р.Дж., Эномото Х., Ян М., Джонсон Э.М., Милбрандт Дж. (октябрь 2004 г.). «Dok-6, член семейства Novel p62 Dok, способствует Ret-опосредованному росту нейритов» . Журнал биологической химии . 279 (40): 42072–42081. дои : 10.1074/jbc.M403726200 . ПМИД 15286081 .
- ^ Гримм Дж., Сакс М., Бритш С., Ди Чезаре С., Шварц-Ромонд Т., Алитало К., Бирчмайер В. (июль 2001 г.). «Новые члены семейства p62dok, dok-4 и dok-5, являются субстратами тирозинкиназы рецептора c-Ret и опосредуют дифференцировку нейронов» . Журнал клеточной биологии . 154 (2): 345–354. дои : 10.1083/jcb.200102032 . ПМК 2150770 . ПМИД 11470823 .
- ^ Кляйн Р.Д., Шерман Д., Хо У.Х., Стоун Д., Беннетт Г.Л., Моффат Б. и др. (июнь 1997 г.). «Белок, связанный с GPI, который взаимодействует с Ret с образованием кандидатного рецептора нейтурина» . Природа . 387 (6634): 717–721. Бибкод : 1997Natur.387..717K . дои : 10.1038/42722 . ПМИД 9192898 . S2CID 4360246 .
- ^ Сик М., Масуре С., Лесаж А.С., Ван дер Линден И., Ван Гомпель П., Пангалос М.Н. и др. (сентябрь 2000 г.). «Связывание GDNF и нейртурина с человеческими рецепторами альфа 1 и 2 семейства GDNF. Влияние cRET и кооперативные взаимодействия» . Журнал биологической химии . 275 (36): 27505–27512. дои : 10.1074/jbc.M000306200 . ПМИД 10829012 .
- ^ Jump up to: а б Пандей А., Дуан Х., Ди Фиоре П.П., Диксит В.М. (сентябрь 1995 г.). «Протеин-тирозинкиназа рецептора Ret связывается с SH2-содержащим адаптерным белком Grb10» . Журнал биологической химии . 270 (37): 21461–21463. дои : 10.1074/jbc.270.37.21461 . ПМИД 7665556 .
- ^ Пандей А., Лю X, Диксон Дж. Э., Ди Фиоре П. П., Диксит В. М. (май 1996 г.). «Прямая связь между тирозинкиназой рецептора Ret и адаптерным белком Grb7, содержащим гомологию Src 2» . Журнал биологической химии . 271 (18): 10607–10610. дои : 10.1074/jbc.271.18.10607 . ПМИД 8631863 .
- ^ Jump up to: а б Боррелло М.Г., Пеличчи Г., Ариги Е., Де Филиппис Л., Греко А., Бонгарцоне I и др. (июнь 1994 г.). «Онкогенные версии тирозинкиназ Ret и Trk связывают адаптерные белки Shc и Grb2». Онкоген . 9 (6): 1661–1668. ПМИД 8183561 .
- ^ Ариги Э., Альберти Л., Торрити Ф., Гиззони С., Риццетти М.Г., Пеличчи Г. и др. (февраль 1997 г.). «Идентификация места стыковки Shc на Ret-тирозинкиназе» . Онкоген . 14 (7): 773–782. дои : 10.1038/sj.onc.1200896 . ПМИД 9047384 .
- ^ Юань З.Л., Гуань Ю.Дж., Ван Л., Вэй В., Кейн А.Б., Чин Ю.Е. (ноябрь 2004 г.). «Центральная роль остатка треонина в петле p + 1 рецепторной тирозинкиназы в конститутивном фосфорилировании STAT3 в метастатических раковых клетках» . Молекулярная и клеточная биология . 24 (21): 9390–9400. дои : 10.1128/MCB.24.21.9390-9400.2004 . ПМК 522220 . ПМИД 15485908 .
- ^ Хван Дж.Х., Ким Д.В., Су Дж.М., Ким Х., Сон Дж.Х., Хван Э.С. и др. (июнь 2003 г.). «Активация преобразователя сигнала и активатора транскрипции 3 онкогенной RET/PTC (перестроенной при трансформации/папиллярной карциноме щитовидной железы) тирозинкиназой: роль в специфической регуляции генов и клеточной трансформации». Молекулярная эндокринология . 17 (6): 1155–1166. дои : 10.1210/me.2002-0401 . ПМИД 12637586 .
- ^ Шуринга Дж.Дж., Войтачнио К., Хагенс В., Велленга Е., Байс CH, Хофстра Р., Круйер В. (август 2001 г.). «Клеточная трансформация, индуцированная MEN2A-RET, путем активации STAT3» . Онкоген . 20 (38): 5350–5358. дои : 10.1038/sj.onc.1204715 . ПМИД 11536047 .
Дальнейшее чтение
[ редактировать ]- Энг С., Маллиган Л.М. (1997). «Мутации протоонкогена RET при синдромах множественной эндокринной неоплазии 2 типа, связанных с ней спорадических опухолях и болезни Гиршпрунга» . Человеческая мутация . 9 (2): 97–109. doi : 10.1002/(SICI)1098-1004(1997)9:2<97::AID-HUMU1>3.0.CO;2-M . ПМИД 9067749 . S2CID 32671155 .
- Хофстра Р.М., Осинга Дж., Байс CH (1998). «Мутации при болезни Гиршпрунга: когда мутация влияет на фенотип». Европейский журнал генетики человека . 5 (4): 180–185. дои : 10.1159/000484760 . ПМИД 9359036 .
- Никифоров Ю.Е. (2002). «Перестройка RET/PTC при опухолях щитовидной железы». Эндокринная патология . 13 (1): 3–16. дои : 10.1385/EP:13:1:03 . ПМИД 12114746 . S2CID 23964165 .
- Санторо М., Мелилло Р.М., Шарлемань Ф., Веккьо Дж., Фуско А. (декабрь 2004 г.). «Миниобзор: РЭТ: нормальные и аномальные функции » Эндокринология . 145 (12): 5448–5451. дои : 10.1210/en.2004-0922 . ПМИД 15331579 .
- Санторо М., Карломаньо Ф., Мелилло Р.М., Фуско А. (декабрь 2004 г.). «Дисфункция рецептора RET при раке человека». Клеточные и молекулярные науки о жизни . 61 (23): 2954–2964. дои : 10.1007/s00018-004-4276-8 . ПМИД 15583857 . S2CID 36766644 .
- Никколи-Сир П., Конте-Деволкс Б (июнь 2005 г.). «[Мутации RET и профилактическое лечение медуллярного рака щитовидной железы]». Анналы эндокринологии . 66 (3): 168–175. дои : 10.1016/s0003-4266(05)81748-2 . ПМИД 15988377 .
- Лантьери Ф, Гризери П, Чеккерини I (2006). «Молекулярные механизмы патогенеза Гиршпрунга, индуцированного RET» . Анналы медицины . 38 (1): 11–19. дои : 10.1080/07853890500442758 . ПМИД 16448984 . S2CID 43686346 .
- Чампи Р., Никифоров Ю.Е. (март 2007 г.). «Перегруппировки RET/PTC и мутации BRAF в онкогенезе щитовидной железы» . Эндокринология . 148 (3): 936–941. дои : 10.1210/en.2006-0921 . ПМИД 16946010 .
- Плаза-Меначо I, Буржински ГМ, де Гроот Дж.В., Эгген Б.Дж., Хофстра Р.М. (ноябрь 2006 г.). «Современные концепции генетики, передачи сигналов и терапии, связанных с RET» (PDF) . Тенденции в генетике . 22 (11): 627–636. дои : 10.1016/j.tig.2006.09.005 . ПМИД 16979782 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NCBI/NIH/UW о множественной эндокринной неоплазии типа 2
- ret + Протоонкоген + Белки в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)