СДХБ
| СДХБ | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | SDHB , CWS2, IP, PGL4, SDH, SDH1, SDH2, SDHIP, комплекс сукцинатдегидрогеназы, железо-серная субъединица B, MC2DN4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 185470 ; МГИ : 1914930 ; Гомологен : 2255 ; GeneCards : SDHB ; OMA : SDHB — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
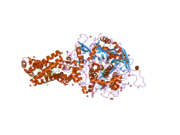
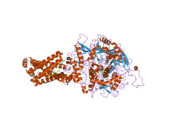
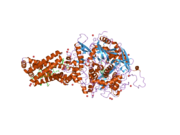
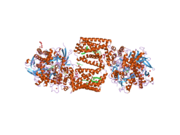
Сукцинатдегидрогеназа [убихинон] железо-серная субъединица митохондрий (SDHB), также известная как железо-серная субъединица комплекса II (Ip), представляет собой белок , который у человека кодируется SDHB геном . [ 5 ] [ 6 ] [ 7 ]
( Белковый комплекс сукцинатдегидрогеназа также называемый SDH или Комплекс II) катализирует окисление сукцината (сукцинат + убихинон => фумарат + убихинол). SDHB — одна из четырех белковых субъединиц, образующих сукцинатдегидрогеназу, остальные три — SDHA , SDHC и SDHD . Субъединица SDHB соединена с субъединицей SDHA на гидрофильном каталитическом конце комплекса SDH. Он также связан с субъединицами SDHC / SDHD на гидрофобном конце комплекса, закрепленном в митохондриальной мембране. Субъединица представляет собой железо-серный белок с тремя железо-серными кластерами. Он весит 30 кДа .
Структура
[ редактировать ]Ген, кодирующий белок SDHB, является ядерной , а не митохондриальной ДНК . Однако экспрессируемый белок находится во внутренней мембране митохондрий . Расположение гена у человека находится на первой хромосоме в локусе p36.1-p35. Ген экзонов закодирован 1162 парами оснований, разделенными на 8 . [ 5 ] Экспрессированный белок весит 31,6 кДа и состоит из 280 аминокислот. [ 8 ] [ 9 ] SDHB содержит кластеры железо-сера, необходимые для туннелирования электронов через комплекс. Он расположен между SDHA и двумя трансмембранными субъединицами SDHC и SDHD . [ 10 ]
Функция
[ редактировать ]
Комплекс SDH расположен на внутренней мембране митохондрий и участвует как в цикле лимонной кислоты, так и в дыхательной цепи . SDHB действует как промежуточное звено в основном действии фермента SDH, показанном на рисунке 1:
- SDHA превращает сукцинат в фумарат в рамках цикла лимонной кислоты . Эта реакция также превращает ФАД в ФАДН 2 .
- Электроны из FADH 2 передаются к кластерам железа субъединицы SDHB [2Fe-2S],[4Fe-4S],[3Fe-4S].
- Наконец, электроны передаются в пул убихинона (Q) через субъединицы SDHC / SDHD . Эта функция является частью дыхательной цепи .
Первоначально SDHA окисляет сукцинат путем депротонирования в сайте связывания FAD, образуя FADH 2 и оставляя фумарат , слабо связанный с активным сайтом, свободным для выхода из белка. Электроны из FADH 2 передаются в кластеры железа субъединицы SDHB [2Fe-2S],[4Fe-4S],[3Fe-4S] и туннелируют вдоль реле [Fe-S], пока не достигнут железо-серы [3Fe-4S]. кластер . Затем электроны передаются ожидающей молекуле убихинона в активном центре пула Q в димере SDHC / SDHD . кислород O1 Карбонильный убихинона ориентируется в активном центре (изображение 4) за счет взаимодействия водородной связи с Tyr83 SDHD . Наличие электронов в железо-серном кластере [3Fe-4S] индуцирует движение убихинона во вторую ориентацию. Это облегчает взаимодействие второй водородной связи между карбонильной группой O4 убихинона и Ser27 SDHC . После первого этапа одноэлектронного восстановления семихиноновый образуется радикал. Второй электрон приходит из кластера [3Fe-4S] и обеспечивает полное восстановление убихинона до убихинол . [ 11 ]
Клиническое значение
[ редактировать ]Зародышевые мутации в этом гене могут вызвать семейную параганглиому (в старой номенклатуре — параганглиома типа PGL4). Это же состояние часто называют семейной феохромоцитомой . Реже почечно-клеточную карциному эта мутация может вызывать .
Параганглиомы, связанные с мутациями SDHB, имеют высокий уровень злокачественности. Лечение злокачественных опухолей в настоящее время такое же, как и при любой злокачественной параганглиоме/феохромоцитоме.
Рак
[ редактировать ]Параганглиомы, вызванные мутациями SDHB, имеют несколько отличительных характеристик:
- Злокачественное новообразование встречается часто и варьируется от 38% до 83%. [ 12 ] [ 13 ] у носителей заболевания. Напротив, опухоли, вызванные мутациями SDHD , почти всегда доброкачественные. Спорадические параганглиомы злокачественны менее чем в 10% случаев.
- Злокачественные параганглиомы, вызванные SDHB, обычно (около 92% случаев) [ 13 ] ) вненадпочечниковый. Спорадические феохромоцитомы/параганглиомы располагаются вне надпочечников менее чем в 10% случаев.
- Пенетрантность . гена часто оценивается как 77% к 50 годам [ 12 ] (т.е. у 77% носителей к 50 годам будет хотя бы одна опухоль). Вероятно, это завышенная оценка. В настоящее время (2011 г.) проходят скрининг семей с молчащими мутациями SDHB. [ 14 ] определить частоту молчащих несущих.
- Средний возраст начала заболевания при SDHB и заболеваниях, не связанных с SDHB, примерно одинаков (около 36 лет).
Мутации, вызывающие заболевание, наблюдались в экзонах с 1 по 7, но не в 8. Как и гены SDHC и SDHD , SDHB является геном-супрессором опухоли .
Кнудсона Формирование опухоли обычно соответствует гипотезе «двух ударов» . Первая копия гена мутирована во всех клетках, однако вторая копия функционирует нормально. Когда вторая копия мутирует в определенной клетке из-за случайного события, происходит потеря гетерозиготности (LOH) и белок SDHB больше не вырабатывается. Тогда становится возможным образование опухоли.
Учитывая фундаментальную природу белка SDH во всех клеточных функциях, в настоящее время не понятно, почему поражаются только параганглионарные клетки. Однако чувствительность этих клеток к уровню кислорода может играть роль.
Пути заболевания
[ редактировать ]Точный путь, ведущий от мутации SDHB к онкогенезу, не определен; существует несколько предлагаемых механизмов. [ 15 ]
Генерация активных форм кислорода
[ редактировать ]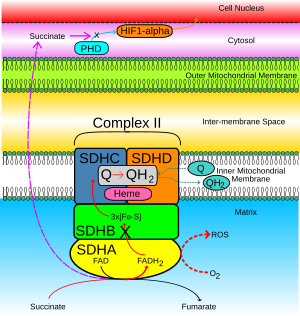
Когда активность сукцинат-убихинона ингибируется, электроны, которые обычно передаются через субъединицу SDHB в пул убихинона, вместо этого передаются на O 2 с образованием активных форм кислорода (АФК), таких как супероксид . Это показано пунктирной красной стрелкой на рисунке 2. АФК накапливают и стабилизируют выработку HIF1-α . HIF1-α объединяется с HIF1-β, образуя стабильный гетеродимерный комплекс HIF, что, в свою очередь, приводит к индукции антиапоптотических генов в ядре клетки.
Накопление сукцината в цитозоле
[ редактировать ]Инактивация СДГ может блокировать окисление сукцината , запуская каскад реакций:
- Сукцинат, накопленный в митохондриальном матриксе, диффундирует через внутреннюю и внешнюю митохондриальные мембраны в цитозоль (фиолетовые пунктирные стрелки на рисунке 2).
- При нормальной клеточной функции HIF1-α в цитозоле быстро гидроксилируется пролилгидроксилазой (PHD), как показано голубой стрелкой. Этот процесс блокируется накопившимся сукцинатом.
- HIF1-α стабилизируется и попадает в ядро клетки (оранжевая стрелка), где он соединяется с HIF1-β, образуя активный комплекс HIF, который индуцирует экспрессию генов, вызывающих опухоль. [ 16 ]
Этот путь повышает возможность терапевтического лечения. Накопление сукцината ингибирует активность PHD. Для действия PHD обычно необходимы кислород и альфа-кетоглутарат в качестве косубстратов , а также двухвалентное железо и аскорбат в качестве кофакторов . Сукцинат конкурирует с α-кетоглутаратом за связывание с ферментом PHD. Следовательно, повышение уровня α-кетоглутарата может нивелировать эффект накопления сукцината.
Обычный α-кетоглутарат не проникает эффективно через клеточные стенки, и необходимо создать производное, проникающее в клетку (например, сложные эфиры α-кетоглутарата). Испытания in vitro показывают, что этот подход к добавкам может снизить уровни HIF1-α и может привести к терапевтическому подходу к опухолям, возникающим в результате дефицита SDH. [ 17 ]
Нарушение апоптоза развития
[ редактировать ]Параганглионарная ткань происходит из клеток нервного гребня, присутствующих в эмбрионе . Брюшные вненадпочечниковые параганглионарные клетки секретируют катехоламины, которые играют важную роль в развитии плода. После рождения эти клетки обычно умирают, и этот процесс запускается снижением уровня фактора роста нервов (NGF), который инициирует апоптоз (гибель клеток).
Этот процесс гибели клеток опосредуется ферментом под названием пролилгидроксилаза EglN3. Накопление сукцината, вызванное инактивацией СДГ, ингибирует пролилгидроксилазу EglN3. [ 18 ] Конечным результатом является то, что параанглионарная ткань, которая обычно погибла бы после рождения, остается, и эта ткань может позже вызвать параганглиому/феохромоцитому.
Повышение регуляции гликолиза
[ редактировать ]Подавление цикла лимонной кислоты заставляет клетку гликолитически создавать АТФ для выработки необходимой энергии. Индуцированные гликолитические ферменты потенциально могут блокировать апоптоз клеток.
Редактирование РНК
[ редактировать ]Транскрипты мРНК гена SDHB у человека редактируются с помощью неизвестного механизма в положении нуклеотида 136 ORF, вызывая преобразование C в U и, таким образом, генерируя стоп-кодон, что приводит к трансляции отредактированных транскриптов в усеченный белок SDHB с аминогруппой R46X. кислотные изменения. Это редактирование было показано на моноцитах и некоторых линиях лимфоидных клеток человека. [ 19 ] и усиливается при гипоксии . [ 20 ]
Интерактивная карта маршрутов
[ редактировать ]Нажмите на гены, белки и метаболиты ниже, чтобы перейти к соответствующим статьям. [ § 1 ]
- ^ Интерактивную карту маршрутов можно редактировать на WikiPathways: «TCACycle_WP78» .
Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Версия Ensembl 89: ENSG00000117118 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000009863 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Jump up to: а б «Энтрез Ген: комплекс сукцинатдегидрогеназы» .
- ^ Кита К., Оя Х., Геннис Р.Б., Акрелл Б.А., Касахара М. (январь 1990 г.). «Человеческий комплекс II (сукцинат-убихинон оксидоредуктаза): клонирование кДНК железо-серной (Ip) субъединицы митохондрий печени». Биохим. Биофиз. Рез. Общий . 166 (1): 101–8. дои : 10.1016/0006-291X(90)91916-G . ПМИД 2302193 .
- ^ Ау ХК, Реам-Робинсон Д., Беллью Л.А., Брумфилд П.Л., Сагбини М., Шеффлер И.Е. (июль 1995 г.). «Структурная организация гена, кодирующего железо-серную субъединицу сукцинатдегидрогеназы человека». Джин . 159 (2): 249–53. дои : 10.1016/0378-1119(95)00162-Y . ПМИД 7622059 .
- ^ Зонг NC, Ли Х, Ли Х, Лам МП, Хименес Р.К., Ким С.С., Денг Н., Ким АК, Чой Дж.Х., Селайя И., Лием Д., Мейер Д., Одеберг Дж., Фанг С., Лу Х.Дж., Сюй Т., Вайс Дж. , Дуан Х., Улен М., Йейтс-младший, Апвейлер Р., Ге Дж., Хермякоб Х., Пинг П. (октябрь 2013 г.). «Интеграция биологии и медицины сердечного протеома с помощью специализированной базы знаний» . Исследование кровообращения . 113 (9): 1043–53. дои : 10.1161/CIRCRESAHA.113.301151 . ПМК 4076475 . ПМИД 23965338 .
- ^ «СДГБ - сукцинатдегидрогеназа [убихинон] железо-серная субъединица, митохондриальная» . База знаний Атласа органических белков сердца (COPaKB) . Архивировано из оригинала 19 июля 2018 г. Проверено 18 июля 2018 г.
- ^ Солнце, Ф; Хо, Х; Чжай, Ю; Ван, А; Сюй, Дж; Су, Д; Бартлам, М; Рао, З. (1 июля 2005 г.). «Кристаллическая структура белкового комплекса дыхательной мембраны митохондрий II» . Клетка . 121 (7): 1043–57. дои : 10.1016/j.cell.2005.05.025 . ПМИД 15989954 . S2CID 16697879 .
- ^ Хорсфилд, Р.; Янковская, В; Секстон, Дж; Уиттингем, В; Сиоми, К; Омура, С; Бирн, Б; Чеккини, Дж; Ивата, С. (17 марта 2006 г.). «Структурный и вычислительный анализ хинонсвязывающего сайта комплекса II (сукцинат-убихинон оксидоредуктаза): механизм переноса электрона и протонной проводимости при восстановлении убихинона» . Журнал биологической химии . 281 (11): 7309–16. дои : 10.1074/jbc.m508173200 . ПМИД 16407191 .
- ^ Jump up to: а б Нойманн Х.П., Павлу С., Печковска М., Бауш Б., Маквинни С.Р., Муресан М., Бухта М., Франке Г., Клиш Дж., Блей Т.А., Хогерле С., Бедекер CC, Опочер Г., Шиппер Дж., Янушевич А., Энг С. (август 2004 г.) ). «Отличные клинические особенности синдромов параганглиомы, связанных с мутациями генов SDHB и SDHD». ДЖАМА . 292 (8): 943–51. дои : 10.1001/jama.292.8.943 . ПМИД 15328326 . S2CID 21673619 .
- ^ Jump up to: а б Брауэрс Ф.М., Эйзенхофер Г., Тао Дж.Дж., Кант Дж.А., Адамс К.Т., Линехан В.М., Пачак К. (ноябрь 2006 г.). «Высокая частота мутаций зародышевой линии SDHB у пациентов со злокачественными параганглиомами, продуцирующими катехоламины: значение для генетического тестирования» . Дж. Клин. Эндокринол. Метаб . 91 (11): 4505–9. дои : 10.1210/jc.2006-0423 . ПМИД 16912137 .
- ^ Конференция: Национальный институт здравоохранения (США), «Феохромоцитома, связанная с SDHB: недавние открытия и современные диагностические и терапевтические подходы», 29 сентября 2006 г.
- ^ Готлиб Э., Томлинсон И.П. (ноябрь 2005 г.). «Митохондриальные опухолевые супрессоры: генетическое и биохимическое обновление». Нат. Преподобный Рак . 5 (11): 857–66. дои : 10.1038/nrc1737 . ПМИД 16327764 . S2CID 20851047 .
- ^ Селак М.А., Армор С.М., Маккензи Э.Д., Булабель Х., Уотсон Д.Г., Мэнсфилд К.Д., Пэн Ю., Саймон М.К., Томпсон С.Б., Готлиб Э. (январь 2005 г.). «Сукцинат связывает дисфункцию цикла ТСА с онкогенезом, ингибируя HIF-альфа-пролилгидроксилазу» . Раковая клетка . 7 (1): 77–85. дои : 10.1016/j.ccr.2004.11.022 . ПМИД 15652751 .
- ^ Маккензи Э.Д., Селак М.А., Теннант Д.А., Пейн Л.Дж., Кросби С., Фредериксен К.М., Уотсон Д.Г., Готлиб Э. (май 2007 г.). «Проникающие в клетки производные альфа-кетоглутарата облегчают псевдогипоксию в клетках с дефицитом сукцинатдегидрогеназы» . Мол. Клетка. Биол . 27 (9): 3282–9. дои : 10.1128/MCB.01927-06 . ЧВК 1899954 . ПМИД 17325041 .
- ^ Ли С., Накамура Э., Ян Х., Вэй В., Лингги М.С., Саджан М.П., Фарезе Р.В., Фриман Р.С., Картер Б.Д., Кэлин В.Г., Шлисио С. (август 2005 г.). «Апоптоз нейронов, связанный с пролилгидроксилазой EglN3 и генами семейной феохромоцитомы: отбраковка в процессе развития и рак» . Раковая клетка . 8 (2): 155–67. дои : 10.1016/j.ccr.2005.06.015 . ПМИД 16098468 .
- ^ Байсал Б.Е. (2007). «Рецидивирующая мутация стоп-кодона в гене субъединицы B сукцинатдегидрогеназы в нормальной периферической крови и остром Т-клеточном лейкозе у детей» . ПЛОС ОДИН . 2 (5): е436. Бибкод : 2007PLoSO...2..436B . дои : 10.1371/journal.pone.0000436 . ПМК 1855983 . ПМИД 17487275 .

- ^ Байсал Б.Е., Де Йонг К., Лю Б., Ван Дж., Патнаик С.К., Уоллес П.К., Таггарт RT (2013). «Индуцируемое гипоксией редактирование РНК, кодирующей C-to-U, подавляет SDHB в моноцитах» . ПерДж . 1 : е152. дои : 10.7717/peerj.152 . ПМЦ 3775634 . ПМИД 24058882 .
Дальнейшее чтение
[ редактировать ]- Милошевич Д., Лундквист П., Крадич К. и др. (2010). «Разработка и проверка комплексного анализа обнаружения мутаций и делеций для SDHB, SDHC и SDHD» . Клин. Биохим . 43 (7–8): 700–4. doi : 10.1016/j.clinbiochem.2010.01.016 . ПМК 3419008 . ПМИД 20153743 .
- Альрашди И., Бано Дж., Махер Э.Р., Ходжсон С.В. (2010). «Триада Карни против синдрома Карни Стратакиса: два случая, которые иллюстрируют сложность различения этих состояний у отдельных пациентов». Фам. Рак . 9 (3): 443–7. дои : 10.1007/s10689-010-9323-z . ПМИД 20119652 . S2CID 21792188 .
- Окада Ю., Каматани Ю., Такахаши А. и др. (2010). «Полногеномное исследование ассоциации с участием 19 633 японцев идентифицировало LHX3-QSOX2 и IGF1 как локусы роста взрослых» . Хм. Мол. Жене . 19 (11): 2303–12. дои : 10.1093/hmg/ddq091 . ПМИД 20189936 .
- Бэйли Дж.П. (2010). «Являются ли эти сложные гетерозиготные мутации SDHB действительно мутациями?». Детский рак крови . 55 (1): 211, ответ автора 212. doi : 10.1002/pbc.22455 . ПМИД 20213850 . S2CID 31378042 .
- Роуз Дж.Э., Бем Ф.М., Дргон Т. и др. (2010). «Персонализированное прекращение курения: взаимодействие между дозой никотина, зависимостью и оценкой генотипа успеха в отказе от курения» . Мол. Мед . 16 (7–8): 247–53. дои : 10.2119/molmed.2009.00159 . ПМЦ 2896464 . ПМИД 20379614 .
- Гилл А.Дж., Бенн Д.Е., Чоу А. и др. (2010). «Иммуногистохимия для сортировки SDHB, генетическое тестирование SDHB, SDHC и SDHD при синдромах параганглиомы-феохромоцитомы». Хм. Патол . 41 (6): 805–14. дои : 10.1016/j.humpath.2009.12.005 . ПМИД 20236688 .
- Мартин Т.П., Ирвинг Р.М., Махер Э.Р. (2007). «Генетика параганглиом: обзор» . Клин Отоларингол . 32 (1): 7–11. дои : 10.1111/j.1365-2273.2007.01378.x . ПМИД 17298303 .
- Энг С., Киуру М., Фернандес М.Дж., Аалтонен Л.А. (2003). «Роль митохондриальных ферментов в наследственной неоплазии и за ее пределами». Нат. Преподобный Рак . 3 (3): 193–202. дои : 10.1038/nrc1013 . ПМИД 12612654 . S2CID 20549458 .
- Ли Дж., Ван Дж., Торбенсон М. и др. (2010). «Потеря генов SDHB и NF1 в злокачественной листовидной опухоли молочной железы, обнаруженная с помощью сравнительной геномной гибридизации олигомассивов». Рак Генет. Цитогенет . 196 (2): 179–83. doi : 10.1016/j.cancergencyto.2009.09.005 . ПМИД 20082856 .
- Хермсен М.А., Севилья М.А., Льоренте Х.Л. и др. (2010). «Значение скрининга зародышевых мутаций как при семейных, так и при спорадических параганглиомах головы и шеи для ранней диагностики и клинического лечения» . Клетка. Онкол . 32 (4): 275–83. дои : 10.3233/CLO-2009-0498 . ПМЦ 4619289 . ПМИД 20208144 .
- Мусил З; Пучмаерова А; Крепелова А; и др. (2010). «Параганглиома у 13-летней девочки: новая мутация гена SDHB в семье?». Рак Генет. Цитогенет . 197 (2): 189–92. doi : 10.1016/j.cancergencyto.2009.11.010 . ПМИД 20193854 .
- Симада М., Миягава Т., Кавасима М. и др. (2010). «Подход, основанный на полногеномном исследовании ассоциаций, выявляет локусы-кандидаты на развитие нарколепсии». Хм. Жене . 128 (4): 433–41. дои : 10.1007/s00439-010-0862-z . ПМИД 20677014 . S2CID 24207887 .
- Бриер Ж.-Дж.; Фавье Ж; Эль Гузи V; и др. (2005). «Дефицит сукцинатдегидрогеназы у человека» . Клетка. Мягкий. Наука о жизни . 62 (19–20): 2317–24. дои : 10.1007/s00018-005-5237-6 . ПМЦ 11139140 . ПМИД 16143825 . S2CID 23793565 .
- Шимке Р.Н., Коллинз Д.Л., Столле, Калифорния (2010). «Парангглиома, нейробластома и мутация SDHB: разрешение загадки 30-летней давности». Являюсь. Дж. Мед. Жене. А. 152А (6): 1531–5. дои : 10.1002/ajmg.a.33384 . ПМИД 20503330 . S2CID 22768946 .
- Гилл А.Дж., Чоу А., Вилен Р. и др. (2010). «Иммуногистохимия SDHB делит желудочно-кишечные стромальные опухоли (ГИСО) на два различных типа». Являюсь. Дж. Сург. Патол . 34 (5): 636–44. дои : 10.1097/PAS.0b013e3181d6150d . ПМИД 20305538 . S2CID 2314622 .
- Хендриксон С.Л., Лаутенбергер Дж.А., Чинн Л.В. и др. (2010). «Генетические варианты кодируемых в ядре митохондриальных генов влияют на прогрессирование СПИДа» . ПЛОС ОДИН . 5 (9): e12862. Бибкод : 2010PLoSO...512862H . дои : 10.1371/journal.pone.0012862 . ПМЦ 2943476 . ПМИД 20877624 .

- Cerecer-Gil NY, Figuera LE, Llamas FJ и др. (2010). «Мутация SDHB является причиной высотной параганглиомы, связанной с гипоксией». Клин. Рак Рез . 16 (16): 4148–54. дои : 10.1158/1078-0432.CCR-10-0637 . ПМИД 20592014 . S2CID 12502978 .
- Кравчик А., Хассе-Лазар К., Павлачек А. и др. (2010). «Герминальные мутации генов RET, SDHB, SDHD и VHL у пациентов с явно спорадическими феохромоцитомами и параганглиомами». Эндокринол Пол . 61 (1): 43–8. ПМИД 20205103 .
- Hes FJ, Weiss MM, Woortman SA и др. (2010). «Низкая пенетрантность мутации SDHB в большом голландском семействе параганглиом» . БМК Мед. Жене . 11:92 . дои : 10.1186/1471-2350-11-92 . ПМЦ 2891715 . ПМИД 20540712 .

- Бэйли С.Д., Се С., До Р. и др. (2010). «Изменения в локусе NFATC2 увеличивают риск возникновения отека, вызванного тиазолидиндионом, в исследовании по оценке снижения диабета с помощью рамиприла и препарата росиглитазона (DREAM)» . Уход при диабете . 33 (10): 2250–3. дои : 10.2337/dc10-0452 . ПМЦ 2945168 . ПМИД 20628086 .
- Байсал Б.Е. (2007). «Рецидивирующая мутация стоп-кодона в гене субъединицы B сукцинатдегидрогеназы в нормальной периферической крови и детском остром Т-клеточном лейкозе» . ПЛОС ОДИН . 2 (5): е436. Бибкод : 2007PLoSO...2..436B . дои : 10.1371/journal.pone.0000436 . ПМК 1855983 . ПМИД 17487275 .

- Байсал Б.Е., Чон К.Д., Лю Б. и др. (2013). «Индуцируемое гипоксией редактирование РНК, кодирующей C-to-U, подавляет SDHB в моноцитах» . ПерДж . 1 : е152. дои : 10.7717/peerj.152 . ПМЦ 3775634 . ПМИД 24058882 .
Внешние ссылки
[ редактировать ]- База данных выявленных мутаций SDHB. Архивировано 21 апреля 2006 г. в Wayback Machine.