Электронпереносящая флавопротеиндегидрогеназа
| Электронпереносящая флавопротеиндегидрогеназа | |||
|---|---|---|---|
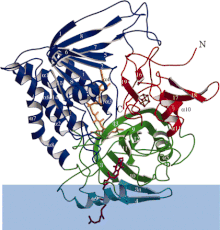 Ленточная диаграмма флавопротеиндегидрогеназы, переносящей электрон, где каждый функциональный домен по-разному окрашен. Синяя полоса — область мембраны. | |||
| Идентификаторы | |||
| Символ | ETFD | ||
| Альт. символы | ETF-QO | ||
| ген NCBI | 2110 | ||
| HGNC | 3483 | ||
| МОЙ БОГ | 231675 | ||
| ПДБ | 2ГМХ | ||
| RefSeq | НМ_004453 | ||
| ЮниПрот | Q16134 | ||
| Другие данные | |||
| Номер ЕС | 1.5.5.1 | ||
| Локус | Хр. 4 q4q32.1 | ||
| |||
Электронпереносящая флавопротеиндегидрогеназа ( ETF-дегидрогеназа или электронопереносящая флавопротеин-убихинон оксидоредуктаза , EC 1.5.5.1 ) представляет собой фермент, который переносит электроны от электронпереносящего флавопротеина в митохондриальном матриксе к пулу убихинона во внутренней мембране митохондрий . [1] [2] Это часть цепи переноса электронов . Фермент обнаружен как у прокариот, так и у эукариот и содержит кластер флавина и FE-S . [3] У человека он кодируется геном ETFDH . Дефицит дегидрогеназы ETF вызывает множественное генетическое заболевание человека , дефицит ацил-КоА-дегидрогеназы . [4]
Функция
[ редактировать ]ETQ-QO связывает окисление жирных кислот и некоторых аминокислот с окислительным фосфорилированием в митохондриях. В частности, он катализирует перенос электронов от электронпереносящего флавопротеина (ETF) к убихинону, восстанавливая его до убихинола. Вся последовательность реакций переноса следующая: [5]
Ацил-КоА → Ацил-КоА дегидрогеназа → ETF → ETF-QO → UQ → Комплекс III .
Катализируемая реакция
[ редактировать ]Общая реакция, катализируемая ETF-QO, выглядит следующим образом: [6]
ETF-QO(красный) + убихинон ↔ ETF-QO(ox) + убихинол
Ферментативную активность обычно оценивают спектрофотометрически по реакции с октаноил-КоА в качестве донора электронов и убихиноном-1 в качестве акцептора электронов. Фермент также можно анализировать путем диспропорционирования семихинона ETF. Обе реакции приведены ниже: [7] [8]
Октаноил-КоА + Q 1 ↔ Q 1 H 2 + Ок-2-еноил-КоА
2 ETF 1- ↔ ETF ox + ETF 2-
Структура
[ редактировать ]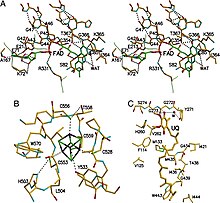
ETF-QO состоит из одного структурного домена с тремя функциональными доменами, расположенными в непосредственной близости: домен FAD, кластерный домен 4Fe4S и UQ-связывающий домен. [5] FAD находится в расширенной конформации и глубоко погружен в свою функциональную область. Множественные водородные связи и положительный спиральный диполь модулируют окислительно-восстановительный потенциал FAD и, возможно, могут стабилизировать анионное промежуточное соединение семихинон . Кластер 4Fe4S также стабилизируется за счет обширных водородных связей вокруг кластера и его цистеиновых компонентов. Связывание убихинона достигается через глубокий гидрофобный карман связывания, который отличается от других UQ-связывающих белков, таких как сукцинат-Q-оксидоредуктаза . Хотя ETF-QO является интегральным мембранным белком, он не проникает через всю мембрану в отличие от других UQ-связывающих белков. [5]
Механизм
[ редактировать ]Точный механизм снижения неизвестен, хотя существует два предполагаемых пути. Первый путь - это перенос электронов из одного электрона восстановленного ETF по одному в центр FAD с более низким потенциалом. Один электрон переносится из восстановленного FAD в кластер железа, в результате чего образуется двухэлектронное восстановленное состояние с одним электроном в доменах FAD и кластере. Затем связанный убихинон восстанавливается до убихинола, по крайней мере временно, образуя однократно восстановленный семиубихинон. Второй путь включает в себя донорство электронов от ETF к кластеру железа с последующими внутренними переходами между двумя электронными центрами. После уравновешивания остальная часть пути следует, как указано выше. [5]
Клиническое значение
[ редактировать ]Дефицит ETF-QO приводит к расстройству, известному как глутаровая ацидемия типа II (также известному как MADD для множественного дефицита ацил-КоА-дегидрогеназы), при котором происходит неправильное накопление жиров и белков в организме. [9] Осложнения могут включать ацидоз или гипогликемию , а также другие симптомы, такие как общая слабость, увеличение печени, усиление сердечной недостаточности и дефицит карнитина . Более тяжелые случаи включают врожденные дефекты и полный метаболический кризис. [10] [11] [12] Генетически это аутосомно-рецессивное заболевание, поэтому его возникновение довольно редко. Большинство пораженных пациентов являются результатом единичных точечных мутаций в интерфейсе убихинона FAD. [13] [14] Более легкие формы расстройства поддаются лечению рибофлавином и называются рибофлавин-зависимым MADD (RR-MADD), хотя из-за различных мутаций, вызывающих заболевание, лечение и симптомы могут значительно различаться. [15] [16]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Гисла С., Торп С. (февраль 2004 г.). «Ацил-КоА-дегидрогеназы. Механистический обзор» . Европейский журнал биохимии . 271 (3): 494–508. дои : 10.1046/j.1432-1033.2003.03946.x . ПМИД 14728676 .
- ^ Хе М., Ратледж С.Л., Келли Д.Р., Палмер К.А., Мердок Дж., Маджумдер Н., Николлс Р.Д., Пей З., Уоткинс П.А., Вокли Дж. (июль 2007 г.). «Новое генетическое нарушение бета-окисления митохондриальных жирных кислот: дефицит ACAD9» . Американский журнал генетики человека . 81 (1): 87–103. дои : 10.1086/519219 . ЧВК 1950923 . ПМИД 17564966 .
- ^ Уотмо, штат Нью-Джерси, Фрерман Ф.Е. (декабрь 2010 г.). «Флавопротеин переноса электронов: убихиноноксидоредуктаза» . Biochimica et Biophysica Acta (BBA) — Биоэнергетика . 1797 (12): 1910–6. дои : 10.1016/j.bbabio.2010.10.007 . ПМИД 20937244 .
- ^ Виани-Лио С., Диври П., Грегерсен Н., Матье М. (1987). «Врожденные ошибки окисления митохондриальных жирных кислот». Журнал наследственных метаболических заболеваний . 10 (Приложение 1): 159–200. дои : 10.1007/bf01812855 . ПМИД 3119938 . S2CID 9771779 .
- ^ Перейти обратно: а б с д Чжан Дж., Фрерман Ф.Е., Ким Дж.Дж. (октябрь 2006 г.). «Структура электронного переноса флавопротеин-убихинон-оксидоредуктазы и перенос электрона в митохондриальный пул убихинона» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (44): 16212–7. Бибкод : 2006PNAS..10316212Z . дои : 10.1073/pnas.0604567103 . ПМЦ 1637562 . ПМИД 17050691 .
- ^ Рамзи Р.Р., ди-джей Стинкамп, Хусейн М. (февраль 1987 г.). «Реакции электронпереносящего флавопротеина и электронпереносящего флавопротеина: убихинон оксидоредуктаза» . Биохимический журнал . 241 (3): 883–92. дои : 10.1042/bj2410883 . ПМЦ 1147643 . ПМИД 3593226 .
- ^ Бекманн Дж. Д., Фрерман Ф. Е. (июль 1985 г.). «Реакция электронпереносящего флавопротеина с электронпереносящей флавопротеин-убихинон оксидоредуктазой». Биохимия . 24 (15): 3922–5. дои : 10.1021/bi00336a017 . ПМИД 2996585 .
- ^ Уотмо, штат Нью-Джерси, Лоер Дж.П., Дрейк С.К., Фрерман Ф.Е. (февраль 1991 г.). «Флуоресценция триптофана во флавопротеине переноса электронов: убихинон оксидоредуктаза: тушение флуоресценции бромированным псевдосубстратом». Биохимия . 30 (5): 1317–23. дои : 10.1021/bi00219a023 . ПМИД 1991113 .
- ^ Фрерман, FE; Гудман, С.И. (1985). «Дефицит флавопротеина переноса электронов или флавопротеина переноса электронов: убихиноноксидоредуктазы в фибробластах глутаровой ацидемии типа II» . Труды Национальной академии наук . 82 (13): 4517–4520. Бибкод : 1985PNAS...82.4517F . дои : 10.1073/pnas.82.13.4517 . ПМЦ 391133 . ПМИД 2989828 .
- ^ Галлоуэй Дж. Х., Картрайт И. Дж., Беннетт М. Дж. (март 1987 г.). «Аномальный липидный состав миокарда у ребенка с глутаровой ацидурией II типа» . Журнал исследований липидов . 28 (3): 279–84. дои : 10.1016/S0022-2275(20)38707-1 . ПМИД 3572253 .
- ^ Сингла М., Гусман Г., Гриффин А.Дж., Бхарати С. (март 2008 г.). «Кардиомиопатия при множественном дефиците ацил-КоА-дегидрогеназы: клинико-патологическая корреляция и обзор литературы». Детская кардиология . 29 (2): 446–51. дои : 10.1007/s00246-007-9119-6 . ПМИД 17912479 . S2CID 370626 .
- ^ Тернбулл Д.М., Бартлетт К., Эйр Дж.А., Гарднер-Медвин Д., Джонсон М.А., Фишер Дж., Уотмо, штат Нью-Джерси (октябрь 1988 г.). «Миопатия накопления липидов из-за глутаровой ацидурии типа II: лечение потенциально смертельной миопатии». Медицина развития и детская неврология . 30 (5): 667–72. дои : 10.1111/j.1469-8749.1988.tb04806.x . ПМИД 3229565 . S2CID 33989343 .
- ^ Лян В.К., Окума А., Хаяши Ю.К., Лопес Л.К., Хирано М., Нонака И., Ногучи С., Чен Л.Х., Чон Ю.Дж., Нишино И. (март 2009 г.). «Мутации ETFDH, уровни CoQ10 и активность дыхательной цепи у пациентов с множественным дефицитом ацил-КоА-дегидрогеназы, реагирующим на рибофлавин» . Нервно-мышечные расстройства . 19 (3): 212–6. дои : 10.1016/j.nmd.2009.01.008 . ПМЦ 10409523 . ПМИД 19249206 . S2CID 28328495 .
- ^ Гудман С.И., Бинар Р.Дж., Вунтнер М.Р., Фрерман Ф.Е. (2002). «Глутаровая ацидемия типа II: структура гена и мутации гена флавопротеина переноса электронов: убихинон оксидоредуктазы (ETF: QO)». Молекулярная генетика и обмен веществ . 77 (1–2): 86–90. дои : 10.1016/S1096-7192(02)00138-5 . ПМИД 12359134 .
- ^ Олсен Р.К., Олпин С.Е., Андресен Б.С., Медзибродска Ж.Х., Пурфарзам М., Меринеро Б., Фрерман Ф.Е., Бересфорд М.В., Дин Дж.К., Корнелиус Н., Андерсен О., Олдфорс А., Холм Е., Грегерсен Н., Тернбулл Д.М., Моррис А.А. (август 2007 г.) ). «Мутации ETFDH как основная причина множественного дефицита дегидрирования ацил-КоА, реагирующего на рибофлавин». Мозг . 130 (Часть 8): 2045–54. дои : 10.1093/brain/awm135 . ПМИД 17584774 .
- ^ Рхед В., Реттгер В., Маршалл Т., Амендт Б. (февраль 1993 г.). «Множественное нарушение дегидрирования ацил-кофермента А, реагирующее на рибофлавин: окисление субстрата, метаболизм флавина и активность флавоферментов в фибробластах» . Педиатрические исследования . 33 (2): 129–35. дои : 10.1203/00006450-199302000-00008 . ПМИД 8433888 .