Трастузумаб дерукстекан
 | |
| Моноклональное антитело | |
|---|---|
| Тип | Цельное антитело |
| Источник | Гуманизированный |
| Цель | HER2 |
| Клинические данные | |
| Торговые названия | Энхерт |
| Другие имена | DS-8201a, фам-трастузумаб дерукстекан-nxki |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а620006 |
| Данные лицензии | |
| Беременность категория | |
| Маршруты администрация | внутривенный |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим SID | |
| Лекарственный Банк | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Химические и физические данные | |
| Формула | С 6460 Н 9972 Н 1724 О 2014 С 44. (С 52 Н 57 F 1 Н 9 О 13 ) 8 |
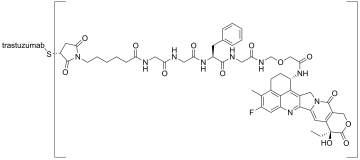
Трастузумаб дерукстекан , продаваемый под торговой маркой Enhertu , представляет собой конъюгат антитело-лекарственное средство, состоящий из гуманизированного моноклонального антитела трастузумаб (Герцептин), ковалентно связанного с ингибитором топоизомеразы I дерукстеканом (производным эксатекана ). [ 11 ] [ 12 ] Он лицензирован для лечения рака молочной железы , аденокарциномы желудка или гастроэзофагеальной аденокарциномы . [ 12 ] [ 13 ] Трастузумаб связывается и блокирует передачу сигналов через рецептор эпидермального фактора роста 2 (HER2/neu) при раке, рост которого зависит от него. Кроме того, после связывания с рецепторами HER2 антитело интернализируется клеткой, неся с собой связанный дерукстекан, где оно мешает способности клетки вносить структурные изменения ДНК и реплицировать свою ДНК во время клеточного деления , что приводит к повреждению ДНК, когда клетка пытается воспроизвести себя, разрушая клетку. [ 13 ]
Он был одобрен для медицинского использования в США в декабре 2019 года. [ 12 ] в Японии в марте 2020 года, [ 14 ] в Европейском Союзе в январе 2021 года, [ 8 ] [ 10 ] и в Австралии в октябре 2021 года. [ 1 ]
Трастузумаб дерукстекан — первый препарат, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), предназначенный для людей с подтипом HER2-низкого рака молочной железы HER2-негативного рака молочной железы. [ 15 ]
Медицинское использование
[ редактировать ]Трастузумаб дерукстекан показан для лечения взрослых с неоперабельным (не поддающимся хирургическому удалению) или метастатическим (когда раковые клетки распространяются на другие части тела) HER2-положительным раком молочной железы, получившим ранее два или более анти-HER2-содержащих препаратов. схемы лечения при метастазах и для взрослых с местно-распространенной или метастатической HER2-положительной аденокарциномой желудка или желудочно-пищеводного соединения, которые ранее получали схему на основе трастузумаба. [ 12 ] [ 13 ]
В мае 2022 года показания были пересмотрены и теперь включают лечение взрослых с неоперабельным или метастатическим HER2-положительным раком молочной железы, которые ранее получали схему лечения на основе анти-HER2 либо в случае метастазов, либо в неоадъювантном или адъювантном режиме, и у которых развился рецидив заболевания во время или в течение шести месяцев после завершения терапии. [ 16 ]
В августе 2022 года показания были пересмотрены и теперь включают лечение неоперабельного или метастатического рака молочной железы с низким уровнем HER2. [ 15 ]
В апреле 2024 года показания были пересмотрены и теперь включают лечение неоперабельных или метастатических HER2-положительных (IHC3+) солидных опухолей у взрослых, которые ранее получали системное лечение и не имеют удовлетворительных альтернативных вариантов лечения. [ 17 ]
Побочные эффекты и предупреждения на этикетке
[ редактировать ]Наиболее распространенными побочными эффектами являются тошнота, усталость, рвота, алопеция (выпадение волос), запор, снижение аппетита, анемия (гемоглобин в крови ниже референсного диапазона), снижение количества нейтрофилов (лейкоцитов, которые помогают руководить реакцией иммунной системы организма). для борьбы с инфекцией), диарея, лейкопения (другие лейкоциты, которые помогают иммунной системе), кашель и снижение количества тромбоцитов (компонент крови, функция которого состоит в том, чтобы реагировать на кровотечение из-за повреждения кровеносного сосуда путем слипания, тем самым инициируя образование тромба). [ 12 ]
Информация о назначении трастузумаба дерукстекана включает в себя предупреждение о риске интерстициального заболевания легких (группа заболеваний легких, вызывающих рубцевание тканей легких) и токсичности для эмбриона и плода. [ 12 ] интерстициальные заболевания легких и пневмониты , включая случаи, приведшие к летальному исходу. При применении трастузумаба дерукстекана были зарегистрированы [ 12 ]
История
[ редактировать ]FDA одобрило трастузумаб дерукстекан на основании результатов одного клинического исследования, в котором приняли участие 184 женщины-участницы с HER2-положительным, неоперабельным и/или метастатическим раком молочной железы, которые ранее получали два или более анти-HER2-терапии в случае метастатического поражения. [ 12 ] Эти участники прошли интенсивное предварительное лечение в случае метастазов, получив от 2 до 17 курсов терапии до приема трастузумаба дерукстекана. [ 12 ] Участники клинического исследования получали трастузумаб дерукстекан каждые три недели, а визуализацию опухоли проводили каждые шесть недель. [ 12 ] Общий уровень ответа составил 60,3%, что отражает процент участников, у которых наблюдалось определенное уменьшение опухоли при средней продолжительности ответа 14,8 месяцев. [ 12 ]
Эффективность оценивалась в многоцентровом открытом рандомизированном исследовании (DESTINY-Gastric01, NCT03329690) у участников с HER2-положительной местно-распространенной или метастатической аденокарциномой желудка или GEJ, у которых наблюдалось прогрессирование по крайней мере на двух предшествующих схемах лечения, включая трастузумаб, фторпиримидин- и платиносодержащая химиотерапия. [ 13 ] В общей сложности 188 участников были рандомизированы (2:1) для получения трастузумаба дерукстекана в дозе 6,4 мг/кг внутривенно каждые три недели или монотерапии иринотеканом или паклитакселом по выбору врача. [ 13 ]
Эффективность была основана на DESTINY-Breast03 (NCT03529110), многоцентровом открытом рандомизированном исследовании, в котором приняли участие 524 участника с HER2-положительным, неоперабельным и/или метастатическим раком молочной железы, которые ранее получали терапию трастузумабом и таксанами по поводу метастатического заболевания или развившегося заболевания. рецидив во время или в течение шести месяцев после завершения неоадъювантной или адъювантной терапии. [ 16 ] Участники были рандомизированы в соотношении 1:1 для получения трастузумаба дерукстекана или трастузумаба эмтанзина путем внутривенной инфузии каждые три недели до неприемлемой токсичности или прогрессирования заболевания. [ 16 ] Рандомизация была стратифицирована по статусу гормональных рецепторов, предшествующему лечению пертузумабом и истории висцеральных заболеваний. [ 16 ]
FDA одобрило трастузумаб дерукстекан для лечения рака молочной железы с низким уровнем HER2 на основании результатов рандомизированного многоцентрового открытого клинического исследования DESTINY-Breast04, в котором приняли участие 557 взрослых участников с неоперабельным или метастатическим раком молочной железы с низким уровнем HER2. [ 15 ] В исследовании приняли участие две когорты: 494 участника с положительными рецепторами гормонов (HR+) и 63 участника с отрицательными рецепторами гормонов (HR-). [ 15 ] Из этих участников 373 случайным образом получали трастузумаб дерукстекан внутривенно каждые три недели, а 184 случайным образом получали химиотерапию по выбору врача ( эрибулин , капецитабин , гемцитабин , паклитаксел или паклитаксел ). [ 15 ] Результаты показали улучшение как выживаемости без прогрессирования, так и общей выживаемости у людей с неоперабельным или метастатическим раком молочной железы с низким уровнем HER2. [ 15 ]
Великобритании В сентябре 2023 года Национальный институт здравоохранения и совершенствования медицинской помощи (NICE) опубликовал руководство о том, что он не будет рекомендовать использование трастузумаба дерукстекана, особенно под торговой маркой Enhertu, для лечения рака молочной железы Национальной службой здравоохранения Великобритании (NHS). , ссылаясь на то, что стоимость препарата слишком высока по сравнению с его преимуществами. После переговоров с производителями лекарств AstraZeneca и Daiichi Sankyo Национальная служба здравоохранения не смогла договориться о поставках по цене, которую она считала приемлемой, и в марте 2024 года объявила, что лечение не будет доступно пациентам Национальной службы здравоохранения. Примерно 1000 пациентов в Великобритании имели бы право на бесплатное лечение, если бы поставки были согласованы. Однако Энхерту был одобрен Шотландским консорциумом лекарственных средств для использования Национальной службой здравоохранения Шотландии в декабре 2023 года. [ 18 ]
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило трастузумаб дерукстекан в декабре 2019 года. [ 12 ] [ 19 ] Заявка на трастузумаб дерукстекан получила ускоренное одобрение , статус ускоренного рассмотрения и статус революционной терапии . [ 12 ] FDA предоставило компании Daiichi Sankyo одобрение на применение Enhertu . [ 12 ]
В декабре 2020 года Комитет по лекарственным средствам для применения человеком Европейского агентства по лекарственным средствам принял положительное заключение, рекомендовав выдать условное регистрационное удостоверение на лекарственный препарат Энхерту, предназначенный для лечения метастатического HER2-положительного рака молочной железы. [ 20 ] [ 21 ] Трастузумаб дерукстекан был рассмотрен в рамках программы ускоренной оценки EMA. Заявителем данного лекарственного средства является компания Daiichi Sankyo Europe GmbH. Трастузумаб дерукстекан был одобрен для медицинского применения в Европейском Союзе в январе 2021 года. [ 8 ] [ 10 ]
США В январе 2021 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало ускоренное одобрение трастузумабу дерукстекану для лечения взрослых с местно-распространенной или метастатической HER2-положительной аденокарциномой желудка или гастроэзофагеала (GEJ), которые ранее получали схему на основе трастузумаба. [ 13 ] [ 22 ]
В октябре 2021 года Австралийское управление терапевтических товаров одобрило предварительную регистрацию трастузумаба дерукстекана для лечения взрослых с неоперабельным или метастатическим HER2-положительным раком молочной железы, которые ранее получали две или более схемы лечения на основе анти-HER2. [ 1 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б с д «Энхерту» . Управление терапевтических товаров (TGA) . 18 октября 2021 года. Архивировано из оригинала 23 октября 2021 года . Проверено 22 октября 2021 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 21 декабря 2022 года. Архивировано из оригинала 3 апреля 2022 года . Проверено 2 января 2023 г.
- ^ «AusPAR: Трастузумаб дерукстекан» . Управление терапевтических товаров (TGA) . 27 июня 2022 года. Архивировано из оригинала 18 июля 2022 года . Проверено 17 июля 2022 г.
- ^ «Энхерту (AstraZeneca Pty Ltd)» . Управление терапевтических товаров (TGA) . 16 февраля 2023 года. Архивировано из оригинала 18 марта 2023 года . Проверено 9 апреля 2023 г.
- ^ «Краткая основа решения (SBD) для Энхерту» . Здоровье Канады . 23 октября 2014 г. Архивировано из оригинала 30 мая 2022 г. . Проверено 29 мая 2022 г.
- ^ «Энхерту 100 мг порошок для концентрата для приготовления раствора для инфузий – Краткая характеристика продукта (SmPC)» . (эмс) . 1 июля 2022 года. Архивировано из оригинала 19 апреля 2021 года . Проверено 1 июля 2022 г.
- ^ «Энгерту-фам-трастузумаб дерукстекан-нхки для инъекций, порошок, лиофилизированный, для приготовления раствора» . ДейлиМед . Архивировано из оригинала 22 января 2021 года . Проверено 15 января 2021 г.
- ^ Перейти обратно: а б с «Энхерту ЭПАР» . Европейское агентство лекарственных средств (EMA) . 9 декабря 2020 года. Архивировано из оригинала 23 марта 2021 года . Проверено 31 марта 2021 г.
- ^ «Информация о продукте Enhertu» . Союзный реестр лекарственных средств . Архивировано из оригинала 5 марта 2023 года . Проверено 3 марта 2023 г.
- ^ Перейти обратно: а б с «Enhertu одобрен в ЕС для лечения HER2-положительного метастатического рака молочной железы» (Пресс-релиз). АстраЗенека. 20 января 2021 года. Архивировано из оригинала 20 января 2021 года . Проверено 21 января 2021 г.
- ^ « Конъюгат антитело-лекарственное средство, нацеленное на HER2, трастузумаб дерукстекан (DS-8201a), усиливает противоопухолевый иммунитет на мышиной модели » (PDF) . Архивировано (PDF) из оригинала 24 сентября 2020 г. Проверено 23 декабря 2019 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н «FDA одобряет новый вариант лечения для пациентов с HER2-положительным раком молочной железы, у которых наблюдается прогресс при использовании доступных методов лечения» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 20 декабря 2019 года. Архивировано из оригинала 20 декабря 2019 года . Проверено 20 декабря 2019 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б с д и ж «FDA одобрило фам-трастузумаб дерукстекан-nxki для лечения HER2-положительных аденокарцином желудка» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 15 января 2021 года. Архивировано из оригинала 15 января 2021 года . Проверено 15 января 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Enhertu одобрено в Японии для лечения пациентов с HER2-положительным неоперабельным или метастатическим раком молочной железы» (пресс-релиз). Даичи Санкё. 25 марта 2020 года. Архивировано из оригинала 28 января 2021 года . Проверено 21 января 2021 г. - через Business Wire.
- ^ Перейти обратно: а б с д и ж «FDA одобрило первую таргетную терапию рака молочной железы с низким уровнем HER2» . США Управление по контролю за продуктами и лекарствами (FDA) (пресс-релиз). 5 августа 2022 года. Архивировано из оригинала 6 августа 2022 года . Проверено 5 августа 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б с д «FDA регулярно выдает одобрение на препарат фам-трастузумаб дерукстекан-нхки для лечения рака молочной железы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 4 мая 2022 года. Архивировано из оригинала 4 мая 2022 года . Проверено 5 мая 2022 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Сводка новостей FDA: 9 апреля 2024 г.» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (пресс-релиз). 9 апреля 2024 года. Архивировано из оригинала 10 апреля 2024 года . Проверено 12 апреля 2024 г.
- ^ «Спор о лекарстве от рака молочной железы, которое продлевает жизнь пациентов, заблокированных Национальной службой здравоохранения из-за завышенной стоимости» . Независимый . 5 марта 2024 года. Архивировано из оригинала 5 марта 2024 года . Проверено 6 марта 2024 г.
- ^ «Снимок испытаний лекарств: Энхерту» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 20 декабря 2019 г. Архивировано из оригинала 20 октября 2020 г. Проверено 24 января 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ «Энхерту: Ожидается решение ЕС» . Европейское агентство лекарственных средств (EMA) . 10 декабря 2020 года. Архивировано из оригинала 12 декабря 2020 года . Проверено 11 декабря 2020 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Трастузумаб дерукстекан рекомендован к одобрению CHMP в ЕС для лечения HER2-положительного метастатического рака молочной железы» (пресс-релиз). АстраЗенека. 14 декабря 2020 года. Архивировано из оригинала 20 января 2021 года . Проверено 21 января 2021 г.
- ^ «Энхерту одобрен в США для лечения пациентов с ранее леченным HER2-положительным раком желудка» (пресс-релиз). АстраЗенека. 18 января 2021 года. Архивировано из оригинала 23 января 2021 года . Проверено 22 января 2021 г.
Дальнейшее чтение
[ редактировать ]- Ивата Т.Н., Сугихара К., Вада Т., Агацума Т. (октябрь 2019 г.). «Противоопухолевый иммунитет, индуцированный [Fam-] трастузумабом дерукстеканом (DS-8201a), облегчается антителом против CTLA-4 на мышиной модели» . ПЛОС ОДИН . 14 (10): e0222280. Бибкод : 2019PLoSO..1422280I . дои : 10.1371/journal.pone.0222280 . ПМК 6772042 . ПМИД 31574081 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка ) - Моди С., Саура С., Ямасита Т., Пак Ю.Х., Ким С.Б., Тамура К. и др. (февраль 2020 г.). «Трастузумаб дерукстекан при ранее леченном HER2-положительном раке молочной железы» . Н. англ. Дж. Мед . 382 (7): 610–621. дои : 10.1056/NEJMoa1914510 . ПМЦ 7458671 . ПМИД 31825192 .
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка )
Внешние ссылки
[ редактировать ]- Дерукстекан показывает структуру
- Номер клинического исследования NCT03329690 для «DS-8201a при раке желудка, экспрессирующем рецептор эпидермального фактора роста 2 человека (HER2) [DESTINY-Gastric01]» на сайте ClinicalTrials.gov.
- Номер клинического исследования NCT03529110 для «DS-8201a в сравнении с T-DM1 для рецептора эпидермального фактора роста человека 2 (HER2)-положительного, неоперабельного и/или метастатического рака молочной железы, ранее лечившегося трастузумабом и таксаном [DESTINY-Breast03]» на сайте ClinicalTrials.gov