Лорлатиниб
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Лорбрена, Лорвиква |
| Другие имена | ПФ-6463922 |
| AHFS / Drugs.com | Монография |
| Медлайн Плюс | а619005 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Биодоступность | 81% |
| Связывание с белками | 66% |
| Метаболизм | В основном CYP3A4 и UGT1A4. |
| Период полувыведения | 24 часа (однократная доза) |
| Экскреция | 48% моча (<1% без изменений), 41% кал (9% без изменений) |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ЧЭБИ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.245.079 |
| Химические и физические данные | |
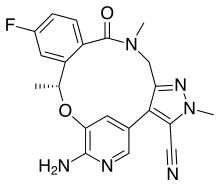
| Формула | С 21 Ч 19 Ф Н 6 О 2 |
| Молярная масса | 406.421 g·mol −1 |
| 3D model ( JSmol ) | |
Лорлатиниб , продаваемый под торговой маркой Лорбрена в США, Канаде и Японии, а также Лорвиква в Европейском Союзе, представляет собой противораковый препарат, используемый для лечения немелкоклеточного рака легких . [4] Это пероральный ингибитор киназы анапластической лимфомы (ALK) и онкогена C-ros 1 (ROS1), двух ферментов, которые играют роль в развитии рака. [6] Его разработала компания Pfizer . [7]
Наиболее частые побочные реакции включают отеки, периферическую невропатию, увеличение массы тела, когнитивные нарушения, утомляемость, одышку, артралгию, диарею, изменения настроения, гиперхолестеринемию, гипертриглицеридемию и кашель. [7]
Лорлатиниб был одобрен для медицинского применения в США в ноябре 2018 года. [8] [9] и в Европейском Союзе в мае 2019 года. [5]
Медицинское использование
[ редактировать ]Лорлатиниб показан для лечения взрослых с метастатическим немелкоклеточным раком легкого, опухоли которого являются киназой анапластической лимфомы (ALK)-положительными. [4] [5] [6] [7]
Противопоказания
[ редактировать ]Лорлатиниб нельзя комбинировать с сильными индукторами (т.е. активаторами) ферментов печени CYP3A4 / 5 , если этого можно избежать, поскольку серьезные случаи печеночной токсичности наблюдались при комбинации с индуктором CYP3A4/5 рифампицином . [4] [10]
Побочные эффекты
[ редактировать ]Наиболее частыми побочными эффектами в исследованиях были высокий уровень холестерина в крови (84% пациентов), высокий уровень триглицеридов в крови (67%), отеки (55%), периферическая нейропатия (48%), когнитивные эффекты (29%), утомляемость (28%). ), увеличение веса (26%) и влияние на настроение (23%). Серьезные побочные эффекты привели к снижению дозы у 23% пациентов и прекращению лечения лорлатинибом у 3% пациентов. [4] [10]
Взаимодействия
[ редактировать ]Лорлатиниб метаболизируется ферментами CYP3A4/5. Поэтому индукторы CYP3A4/5, такие как рифампицин, карбамазепин или зверобой, снижают его концентрацию в плазме крови и могут снижать его эффективность. Кроме того, в исследованиях комбинация лорлатиниба с рифампицином показала токсичность для печени. Ингибиторы этих ферментов, такие как кетоконазол или грейпфрутовый сок , повышают концентрацию лорлатиниба в плазме, что приводит к более высокой токсичности. Лорлатиниб также является (умеренным) индуктором CYP3A4/5, поэтому препараты, метаболизирующиеся этими ферментами, расщепляются быстрее в сочетании с лорлатинибом. Примеры включают мидазолам и циклоспорин . [4] [10]
Взаимодействия через другие ферменты изучались только in vitro . Согласно этим данным, лорлатиниб может ингибировать CYP2C9 , UGT1A1 и некоторые транспортные белки , индуцировать CYP2B6 и, вероятно, не оказывает значимого влияния на CYP1A2 . [10]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Лорлатиниб представляет собой низкомолекулярный ингибитор киназ ALK , и ROS1 а также ряда других киназ . Он активен in vitro в отношении многих мутировавших форм ALK. [4]
Фармакокинетика
[ редактировать ]
Лорлатиниб принимают внутрь и достигают максимальной концентрации в плазме крови через 1,2 часа после однократного приема или через 2 часа после приема при регулярном приеме. [ нужна медицинская ссылка ] Его абсолютная биодоступность составляет 80,8%. [ нужна медицинская ссылка ] Прием вместе с жирной пищей увеличивает ее доступность на 5%, что не считается клинически значимым. [ нужна медицинская ссылка ] При попадании в кровь 66% вещества связывается с белками плазмы . [4] [10] Лорлатиниб способен преодолевать гематоэнцефалический барьер . [12]
Лорлатиниб инактивируется путем окисления , в основном через CYP3A4, и глюкуронидации , главным образом, через UGT1A4 . [ нужна медицинская ссылка ] Другие CYP и UGT играют второстепенную роль. [ нужна медицинская ссылка ] Лорлатиниб и его метаболиты выводятся из организма с периодом полувыведения 23,6 часа после однократного приема; 47,7% попадает в мочу (из них менее 1% в неизмененном виде) и 40,9% в фекалии (9,1% в неизмененном виде). [10]
Химия
[ редактировать ]Лорлатиниб представляет собой порошок от белого до почти белого цвета. Он имеет высокую растворимость в 0,1 М соляной кислоте и очень низкую растворимость при pH выше 4,5. [11]
История
[ редактировать ]США В ноябре 2018 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) выдало ускоренное одобрение лорлатинибу для людей с метастатическим немелкоклеточным раком легкого, положительным по киназе анапластической лимфомы (ALK), у которых заболевание прогрессировало на фоне лечения кризотинибом и по крайней мере еще одним ингибитором ALK. метастатическое заболевание или заболевание которого прогрессировало при приеме алектиниба или церитиниба в качестве первой терапии ингибитором ALK при метастатическом заболевании. [8] Одобрение было основано на подгруппе из 215 участников с ALK-положительным метастатическим НМРЛ, ранее получавших один или несколько ингибиторов ALK-киназы, включенных в нерандомизированное многогрупповое многоцентровое исследование с подбором доз и оценкой активности (исследование B7461001). ; НКТ01970865). [8] Основными показателями эффективности были общая частота ответа (ЧОО) и внутричерепная ЧОО, согласно RECIST 1.1, по оценке независимого центрального наблюдательного комитета. [8]
В марте 2021 года FDA предоставило лорлатинибу регулярное одобрение на основании данных исследования B7461006 (NCT03052608), рандомизированного многоцентрового открытого исследования с активным контролем, проведенного с участием 296 участников с ALK-положительным метастатическим немелкоклеточным раком легких, у которых ранее не получали системной терапии по поводу метастатического заболевания. Участники должны были иметь ALK-положительные опухоли, обнаруженные с помощью CDx-анализа VENTANA ALK (D5F3). Участники были рандомизированы 1:1 для приема лорлатиниба 100 мг перорально один раз в день (n = 149) или кризотиниба 250 мг перорально два раза в день (n = 147).
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]В 2015 году FDA предоставило лорлатинибу статус орфанного препарата для лечения киназы анапластической лимфомы (ALK)-положительного или ROS1-положительного немелкоклеточного рака легкого. [13]
Лорлатиниб был одобрен для медицинского применения в США в ноябре 2018 года. [8] и в Европейском Союзе в мае 2019 года. [5] [14] [15]
Исследовать
[ редактировать ]В июне 2024 года компания Pfizer объявила о положительных долгосрочных результатах исследования III фазы CROWN по применению лорлатиниба при распространенном немелкоклеточном раке легкого, показавших, что 60% участников, получавших лорлатиниб, были живы без прогрессирования заболевания через пять лет. [16] [17] [18]
Ссылки
[ редактировать ]- ^ Jump up to: а б «Лорвиква АПМДС» . Управление терапевтических товаров (TGA) . 26 мая 2022 года. Архивировано из оригинала 10 марта 2024 года . Проверено 10 марта 2024 г.
- ^ «Информация о продукте Лорбрена» . Здоровье Канады . Архивировано из оригинала 30 мая 2022 года . Проверено 29 мая 2022 г.
- ^ «Краткая основа решения (SBD) по Лорбрене» . Здоровье Канады . 23 октября 2014 г. Архивировано из оригинала 31 мая 2022 г. Проверено 29 мая 2022 г.
- ^ Jump up to: а б с д и ж г час «Лорбрена-лорлатиниб таблетка, покрытая пленочной оболочкой» . ДейлиМед . 7 сентября 2023 года. Архивировано из оригинала 7 мая 2024 года . Проверено 4 июня 2024 г.
- ^ Jump up to: а б с д «Лорвиква ЭПАР» . Европейское агентство лекарственных средств (EMA) . 6 мая 2019 г. Архивировано из оригинала 14 ноября 2021 г. Проверено 4 июня 2024 г.
- ^ Jump up to: а б Нагасака М., Ге Ю., Сукари А., Кукрея Г., Оу СИ (июль 2020 г.). «Руководство пользователя по лорлатинибу» . Критические обзоры по онкологии/гематологии . 151 : 102969. doi : 10.1016/j.critrevonc.2020.102969 . ПМИД 32416346 .
- ^ Jump up to: а б с «FDA одобрило лорлатиниб для лечения метастатического ALK-позитивного НМРЛ» . США Управление по контролю за продуктами и лекарствами (FDA). 3 марта 2021 года. Архивировано из оригинала 11 сентября 2023 года . Проверено 4 июня 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ Jump up to: а б с д и «FDA одобряет лорлатиниб в качестве второй или третьей линии лечения ALK-положительного метастатического НМРЛ» . США Управление по контролю за продуктами и лекарствами (FDA). 14 декабря 2018 года. Архивировано из оригинала 1 июня 2024 года . Проверено 4 июня 2024 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Пакет одобрения препарата: Лорбрена (лорлатиниб)» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 10 декабря 2018 года. Архивировано из оригинала 8 ноября 2022 года . Проверено 4 июня 2024 г.
- ^ Jump up to: а б с д и ж «Лорвиква: EPAR – Информация о продукте» (PDF) . Европейское агентство по лекарственным средствам . 17 июня 2019 г. Архивировано (PDF) из оригинала 2 ноября 2021 г. Проверено 26 сентября 2019 г.
- ^ Jump up to: а б «Лорвиква: EPAR – Отчет об общественной оценке» (PDF) . Европейское агентство по лекарственным средствам . 17 июня 2019 г. Архивировано (PDF) из оригинала 2 ноября 2021 г. Проверено 26 сентября 2019 г.
- ^ «Лорлатиниб» . Словарь лекарств NCI . Национальный институт рака. 2 февраля 2011 г. Архивировано из оригинала 15 октября 2020 г. . Проверено 27 декабря 2020 г.
- ^ «Назначение и одобрение орфанного препарата Лорлатиниб» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . Архивировано из оригинала 29 марта 2023 года . Проверено 4 июня 2024 г.
- ^ «Европейская комиссия одобрила Лорвикву (лорлатиниб) для некоторых взрослых пациентов с ранее леченным ALK-положительным немелкоклеточным раком легких, PM Pfizer, 7 мая 2019 г.» . pfizer.com . Архивировано из оригинала 15 мая 2019 года . Проверено 15 мая 2019 г.
- ^ Сайед YY (январь 2019 г.). «Лорлатиниб: первое глобальное одобрение». Наркотики . 79 (1): 93–98. дои : 10.1007/s40265-018-1041-0 . ПМИД 30604291 . S2CID 57426966 .
- ^ «Исследование Pfizer Lorbrena CROWN показывает, что большинство пациентов с ALK-положительным раком легких на поздней стадии живут более пяти лет без прогрессирования заболевания» . Яху Финанс . 31 мая 2024 года. Архивировано из оригинала 3 июня 2024 года . Проверено 3 июня 2024 г.
- ^ «Исследование лорлатиниба в сравнении с кризотинибом в лечении первой линии пациентов с ALK-положительным НМРЛ» . ClinicalTrials.gov . 14 февраля 2024 года. Архивировано из оригинала 1 июня 2024 года . Проверено 4 июня 2024 г.
- ^ Соломон Б.Дж., Лю Г., Фелип Э., Мок Т.С., Су Р.А., Мазирес Дж. и др. (май 2024 г.). «Лорлатиниб по сравнению с кризотинибом у пациентов с распространенным ALK-положительным немелкоклеточным раком легких: 5-летние результаты исследования III фазы CROWN». Журнал клинической онкологии : JCO2400581. дои : 10.1200/JCO.24.00581 . ПМИД 38819031 .
Внешние ссылки
[ редактировать ]- Номер клинического исследования NCT01970865 «Исследование PF-06463922 ингибитора ALK/ROS1 у пациентов с распространенным немелкоклеточным раком легких со специфическими молекулярными изменениями» на сайте ClinicalTrials.gov