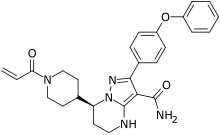
Занубрутиниб
 | |
| Клинические данные | |
|---|---|
| Торговые названия | Его брат |
| Другие имена | БГБ-3111 |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а620009 |
| Данные лицензии |
|
| Беременность категория | |
| Маршруты администрация | Через рот |
| Класс препарата | Ингибитор тирозинкиназы Брутона (БТК) |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| PDB-лиганд | |
| Химические и физические данные | |
| Формула | С 27 Н 29 Н 5 О 3 |
| Молярная масса | 471.561 g·mol −1 |
| 3D model ( JSmol ) | |
Занубрутиниб , продаваемый под торговой маркой Brukinsa , представляет собой противораковый препарат, используемый для лечения лимфомы мантийных клеток (MCL), макроглобулинемии Вальденстрема (WM), лимфомы маргинальной зоны (MZL) и хронического лимфоцитарного лейкоза (CLL). [ 6 ] [ 10 ] [ 11 ] [ 12 ] [ 13 ] Занубрутиниб классифицируется как ингибитор тирозинкиназы Брутона (БТК). [ 6 ] Его дают через рот . [ 6 ]
Он был одобрен для медицинского использования в США в ноябре 2019 года. [ 14 ] [ 10 ] [ 15 ] [ 16 ] [ 17 ]
Медицинское использование
[ редактировать ]Занубрутиниб показан для лечения мантийно-клеточной лимфомы у взрослых , получивших хотя бы один предшествующий курс лечения. [ 6 ] [ 10 ] [ 11 ] и для лечения макроглобулинемии Вальденстрема. [ 18 ] Он также показан для лечения взрослых с рецидивирующей или рефрактерной лимфомой маргинальной зоны, получивших хотя бы одну схему лечения на основе анти-CD20. [ 12 ]
США В январе 2023 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило занубрутиниб для лечения хронического лимфоцитарного лейкоза или малой лимфоцитарной лимфомы. [ 19 ]
В марте 2024 года FDA предоставило ускоренное одобрение занубрутинибу в сочетании с обинутузумабом для лечения рецидивирующей или рефрактерной фолликулярной лимфомы после двух или более линий системной терапии. [ 20 ]
Побочные эффекты
[ редактировать ]Наиболее частыми побочными эффектами (≥30%) являются: снижение количества нейтрофилов , инфекции верхних дыхательных путей , снижение количества тромбоцитов , кровотечения и скелетно-мышечные боли. [ 21 ]
История
[ редактировать ]Эффективность оценивалась в BGB-3111-206 (NCT03206970), открытом многоцентровом исследовании II фазы с участием 86 участников с мантийно-клеточной лимфомой (MCL), которые ранее получали хотя бы одну терапию. [ 15 ] Занубрутиниб назначали перорально по 160 мг два раза в день до прогрессирования заболевания или неприемлемой токсичности. [ 15 ] Эффективность также оценивалась в BGB-3111-AU-003 (NCT02343120), открытом фазе I/II, глобальном, многоцентровом, одиночном исследовании B-клеточных злокачественных новообразований с эскалацией дозы, включая 32 ранее проходивших лечение участников MCL. лечились занубрутинибом, назначаемым перорально в дозе 160 мг два раза в день или 320 мг один раз в день. [ 15 ] [ 16 ]
Первичным показателем эффективности в обоих исследованиях была общая частота ответа (ЧОО) по оценке независимого наблюдательного комитета. [ 15 ] В исследовании BGB-3111-206 требовалось сканирование ФДГ-ПЭТ, ЧОО составляло 84% (95% ДИ: 74, 91), с полной частотой ответа 59% (95% ДИ 48, 70) и медианным ответом. продолжительность 19,5 месяцев (95% ДИ: 16,6, не поддается оценке). [ 15 ] В исследовании BGB-3111-AU-003 сканирование ФДГ-ПЭТ не требовалось, а ЧОО составляло 84% (95% ДИ: 67, 95) с полным ответом 22% (95% ДИ: 9, 40). и медианная продолжительность ответа 18,5 месяцев (95% ДИ: 12,6, не поддается оценке). [ 15 ] Испытание 1 проводилось в 13 центрах в Китае, а испытание 2 — в 25 центрах в США, Великобритании, Австралии, Новой Зеландии, Италии и Южной Корее. [ 16 ]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) предоставило занубрутинибу приоритетное рассмотрение , ускоренное одобрение , революционную терапию и статус орфанного препарата . [ 10 ] [ 15 ] [ 22 ] FDA одобрило занубрутиниб в ноябре 2019 года и предоставило заявку на Брукинсу компании BeiGene USA Inc. [ 10 ] [ 15 ] [ 23 ]
В августе 2021 года FDA одобрило занубрутиниб для лечения макроглобулинемии Вальденстрема, а в сентябре 2021 года — для лечения лимфомы маргинальной зоны (МЗЛ). [ 18 ] [ 24 ] [ 8 ] [ 12 ] [ 25 ]
Занубрутиниб исследовался при макроглобулинемии Вальденстрема в ASPEN (NCT03053440), рандомизированном открытом исследовании с активным контролем, в котором сравнивались занубрутиниб и ибрутиниб у участников с мутацией MYD88 L265P (MYD88MUT) WM. [ 18 ] Участники когорты 1 (n=201) были рандомизированы 1:1 для приема занубрутиниба по 160 мг два раза в день или ибрутиниба по 420 мг один раз в день до прогрессирования заболевания или неприемлемой токсичности. [ 18 ] В когорту 2 были включены участники с диким типом MYD88 (MYD88WT) или неизвестной мутацией MYD88 WM (n=26 и 2 соответственно) и получали занубрутиниб по 160 мг два раза в день. [ 18 ]
Одобрение занубрутиниба для лечения лимфомы маргинальной зоны основано на двух открытых многоцентровых одногрупповых исследованиях: BGB-3111-214 (NCT03846427), в которых оценивали 66 участников с MZL, которые ранее получали хотя бы одну терапию на основе анти-CD20, и BGB-3111-AU-003 (NCT02343120), в который вошли 20 участников с ранее лечившимися МЗЛ. [ 12 ]
В марте 2024 года FDA предоставило ускоренное одобрение занубрутинибу в сочетании с обинутузумабом для лечения рецидивирующей или рефрактерной фолликулярной лимфомы после двух или более линий системной терапии. [ 20 ] Режим оценивался в исследовании BGB-3111-212 (ROSEWOOD; NCT03332017), открытом многоцентровом рандомизированном исследовании, в котором приняли участие 217 взрослых участников с рецидивирующей или рефрактерной фолликулярной лимфомой после как минимум двух предшествующих системных курсов лечения. [ 20 ] Участники были рандомизированы (2:1) для приема либо занубрутиниба в дозе 160 мг перорально два раза в день до прогрессирования заболевания или неприемлемой токсичности плюс обинутузумаб (ZO), либо только обинутузумаб. [ 20 ] Среднее количество предшествующих линий терапии составило 3 (диапазон 2–11). [ 20 ] Заявке был предоставлен ускоренный режим рассмотрения и статус орфанного препарата. [ 20 ]
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]В сентябре 2021 года Комитет по лекарственным средствам для применения человеком (CHMP) Европейского агентства по лекарственным средствам (EMA) принял положительное заключение, рекомендовав выдачу регистрационного удостоверения на лекарственный препарат Brukinsa, предназначенный для лечения макроглобулинемии Вальденстрема. [ 26 ] Заявителем данного лекарственного препарата является компания BeiGene Ireland Ltd. [ 26 ] Занубрутиниб был одобрен для медицинского применения в Европейском Союзе в ноябре 2021 года. [ 7 ] [ 27 ]
Ссылки
[ редактировать ]- ^ Перейти обратно: а б «Брукинса» . Управление терапевтических товаров (TGA) . 15 октября 2021 года. Архивировано из оригинала 23 октября 2021 года . Проверено 22 октября 2021 г.
- ^ Перейти обратно: а б «Брукинса» . Управление терапевтических товаров (TGA) . 20 октября 2021 года. Архивировано из оригинала 23 октября 2021 года . Проверено 22 октября 2021 г.
- ^ «Обновления базы данных о назначении лекарственных средств при беременности» . Управление терапевтических товаров (TGA) . 12 мая 2022 года. Архивировано из оригинала 3 апреля 2022 года . Проверено 13 мая 2022 г.
- ^ «Брукинса (Beigene Aus Pty Ltd)» . Управление терапевтических товаров (TGA) . 5 декабря 2022 года. Архивировано из оригинала 18 марта 2023 года . Проверено 29 апреля 2023 г.
- ^ «Краткая основа решения (SBD) для Брукинса» . Здоровье Канады . 23 октября 2014 г. Архивировано из оригинала 30 мая 2022 г. . Проверено 29 мая 2022 г.
- ^ Перейти обратно: а б с д и «Брукинса-занубрутиниб капсулы, покрытые желатиновой оболочкой» . ДейлиМед . Архивировано из оригинала 19 марта 2021 года . Проверено 1 сентября 2021 г.
- ^ Перейти обратно: а б «Брукинса ЭПАР» . Европейское агентство лекарственных средств (EMA) . 19 июля 2021 года. Архивировано из оригинала 19 декабря 2021 года . Проверено 18 декабря 2021 г.
- ^ Перейти обратно: а б «FDA США предоставляет одобрение Брукинзы (занубрутиниба) при макроглобулинемии Вальденстрема» (пресс-релиз). БэйДжин. 1 сентября 2021 года. Архивировано из оригинала 2 сентября 2021 года . Проверено 1 сентября 2021 г. - через Business Wire.
- ^ «Занубрутиниб» . Наркобанк . Архивировано из оригинала 15 ноября 2019 года . Проверено 15 ноября 2019 г. .
- ^ Перейти обратно: а б с д и «FDA одобрило терапию для лечения пациентов с рецидивирующей и рефрактерной мантийно-клеточной лимфомой, что подтверждается результатами клинических испытаний, показывающими высокую скорость уменьшения опухоли» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 14 ноября 2019 г. Архивировано из оригинала 15 ноября 2019 г. . Проверено 15 ноября 2019 г. .
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б Савалья Ю., Бонд Д.А., Алинари Л. (2020). «Оценка терапевтического потенциала занубрутиниба в лечении рецидивирующей/рефрактерной мантийноклеточной лимфомы: имеющиеся на сегодняшний день данные» . Онкомишени и терапия . 13 : 6573–6581. дои : 10.2147/OTT.S238832 . ПМК 7351990 . ПМИД 32753893 .
- ^ Перейти обратно: а б с д «FDA предоставляет ускоренное одобрение занубрутинибу для лечения лимфомы маргинальной зоны» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 16 сентября 2021 года. Архивировано из оригинала 17 сентября 2021 года . Проверено 16 сентября 2021 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «FDA принимает SNDA на использование занубрутиниба для лечения ХЛЛ/ЛЛ» . АЖМК . 23 февраля 2022 года. Архивировано из оригинала 28 июля 2022 года . Проверено 28 июля 2022 г.
- ^ «Пакет одобрения препарата: Брукинса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 27 ноября 2019 г. Архивировано из оригинала 28 ноября 2019 г. . Проверено 28 марта 2020 г.
- ^ Перейти обратно: а б с д и ж г час я «FDA выдает ускоренное одобрение занубрутинибу для лечения мантийноклеточной лимфомы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 15 ноября 2019 года. Архивировано из оригинала 28 ноября 2019 года . Проверено 27 ноября 2019 г. .
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б с «Снимки испытаний наркотиков Брукинса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 14 ноября 2019 года. Архивировано из оригинала 23 января 2021 года . Проверено 26 января 2020 г. .
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Сайед YY (январь 2020 г.). «Занубрутиниб: первое одобрение». Наркотики . 80 (1): 91–97. дои : 10.1007/s40265-019-01252-4 . ПМИД 31933167 . S2CID 210158252 .
- ^ Перейти обратно: а б с д и «FDA одобрило занубрутиниб для лечения макроглобулинемии Вальденстрема» . США Управление по контролю за продуктами и лекарствами (FDA). 1 сентября 2021 года. Архивировано из оригинала 1 сентября 2021 года . Проверено 1 сентября 2021 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «FDA одобрило занубрутиниб для лечения хронического лимфолейкоза или малой лимфоцитарной лимфомы» . США Управление по контролю за продуктами и лекарствами (FDA). 19 января 2023 года. Архивировано из оригинала 25 января 2023 года . Проверено 26 января 2023 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ Перейти обратно: а б с д и ж «FDA предоставляет ускоренное одобрение занубрутинибу для лечения рецидивирующей или рефрактерной фолликулярной лимфомы» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 7 марта 2024 г. Проверено 9 марта 2024 г.
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «ОСНОВНАЯ ИНФОРМАЦИЯ ПО НАЗНАЧЕНИЮ» (PDF) . Управление по контролю за продуктами и лекарствами США . Проверено 2 апреля 2024 г.
- ^ «Назначение и одобрение орфанного препарата занубрутиниб» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 28 ноября 2019 г. Архивировано из оригинала 28 ноября 2019 г. . Проверено 27 ноября 2019 г. .
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «Пакет одобрения препарата: Брукинса» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 27 ноября 2019 г. Архивировано из оригинала 28 ноября 2019 г. . Проверено 27 ноября 2019 г. .
 В данной статье использован текст из этого источника, находящегося в свободном доступе .
В данной статье использован текст из этого источника, находящегося в свободном доступе .
- ^ «FDA США предоставляет одобрение Брукинзы (занубрутиниба) при макроглобулинемии Вальденстрема» (пресс-релиз). БэйДжин. 1 сентября 2021 года. Архивировано из оригинала 2 сентября 2021 года . Проверено 1 сентября 2021 г.
- ^ «FDA США предоставляет ускоренное одобрение препарата Брукинза (занубрутиниб) при рецидивирующей или рефрактерной лимфоме маргинальной зоны» . БэйДжин. 15 сентября 2021 года. Архивировано из оригинала 16 сентября 2021 года . Проверено 16 сентября 2021 г. - через Business Wire.
- ^ Перейти обратно: а б «Брукинса: Ожидается решение ЕС» . Европейское агентство по лекарственным средствам . 17 сентября 2021 года. Архивировано из оригинала 17 сентября 2021 года . Проверено 17 сентября 2021 г. Текст был скопирован из этого источника, авторские права которого принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ «Информация о продукции Brukinsa» . Союзный реестр лекарственных средств . Архивировано из оригинала 4 марта 2023 года . Проверено 3 марта 2023 г.
Внешние ссылки
[ редактировать ]- «Занубрутиниб» . Словарь лекарств NCI . Национальный институт рака.
- «Занубрутиниб» . Национальный институт рака .
- Номер клинического испытания NCT03206970 «Исследование оценки эффективности и безопасности BGB-3111 у участников с рецидивирующей или рефрактерной мантийноклеточной лимфомой (MCL)» на сайте ClinicalTrials.gov
- Номер клинического исследования NCT02343120 «Исследование безопасности и фармакокинетики BGB-3111 у субъектов с B-клеточными лимфоидными злокачественными новообразованиями» на сайте ClinicalTrials.gov.
- Номер клинического исследования NCT03053440 «Исследование, сравнивающее BGB-3111 и ибрутиниб у участников с макроглобулинемией Вальденстрема (WM) (ASPEN)» на ClinicalTrials.gov
- Номер клинического исследования NCT03846427 «Исследование занубрутиниба (BGB-3111) у участников с лимфомой маргинальной зоны (MAGNOLIA)» на сайте ClinicalTrials.gov.
- Номер клинического исследования NCT02343120 «Исследование безопасности и фармакокинетики BGB-3111 у субъектов с B-клеточными лимфоидными злокачественными новообразованиями» на сайте ClinicalTrials.gov.