Мантийноклеточная лимфома
| Мантийноклеточная лимфома | |
|---|---|
 | |
| Микрофотография, показывающая лимфому из мантийных клеток (внизу изображения) в биопсии терминального отдела подвздошной кишки . Пятно H&E . | |
| Специальность | Гематология и онкология |
Мантийно-клеточная лимфома ( МКЛ ) — разновидность неходжкинской лимфомы , составляющая около 6% случаев. [1] [2] Он назван в честь мантийной зоны лимфатических узлов, где он развивается. [3] [4] Термин «мантийноклеточная лимфома» впервые был принят Раффельдом и Яффе в 1991 году. [5]
MCL представляет собой подтип B-клеточной лимфомы , обусловленный наличием CD5- положительных антиген-наивных B-клеток прегерминального центра в мантийной зоне, которая окружает нормальные фолликулы зародышевого центра . Клетки MCL обычно сверхэкспрессируют циклин D1 из-за транслокации t(11:14) . [6] хромосомная транслокация в ДНК .
Признаки и симптомы
[ редактировать ]У людей с мантийноклеточной лимфомой симптомы обычно появляются в более позднем возрасте, средний возраст начала заболевания составляет от 60 до 70 лет. [7] В западных странах MCL составляет около 7% неходжкинских лимфом у взрослых, при этом ежегодно диагностируется от 4 до 8 случаев на миллион. Заболеваемость MCL увеличивается с возрастом. В Соединенных Штатах средний возраст постановки диагноза составляет 68 лет. Три четверти пациентов — мужчины. Кроме того, пациенты чаще принадлежат к европеоидной расе. [5]
У людей обычно наблюдается нелокализованная лимфаденопатия (увеличение лимфатических узлов) с симптомами B, включая лихорадку, озноб и ночную потливость, иногда присутствующими. [7] У 80% пациентов на момент постановки диагноза заболевание находится на стадии 3 или 4 (поздняя стадия заболевания) с поражением костного мозга, печени или желудочно-кишечного тракта. [7] [8] У 25% пациентов наблюдается объемная лимфаденопатия, характеризующаяся размерами лимфатических узлов более 10 см. [7] У других пациентов может наблюдаться поражение центральной нервной системы (ЦНС), что связано с очень плохим прогнозом. [7] Однако на момент постановки диагноза поражение ЦНС встречается редко. [9]
Редкий подтип, известный как неузловая мантийноклеточная лимфома, проявляется без увеличения лимфатических узлов (неузловой) с циркулирующими клетками лимфомы (лейкемическая картина). [10] Этот тип мантийно-клеточной лимфомы характеризуется более вялым, бессимптомным и медленно прогрессирующим течением, однако возможна злокачественная трансформация в агрессивные формы. [11] [7]
Сообщалось, что лимфома из мантийных клеток в редких случаях ассоциировалась с тяжелыми аллергическими реакциями на укусы комаров . Эти реакции включают в себя обширные аллергические реакции на укусы комаров, которые варьируются от сильно увеличенных мест укусов, которые могут быть болезненными и сопровождаются некрозом, до системных симптомов (например, лихорадка, увеличение лимфатических узлов, боль в животе и диарея) или, в крайне редких случаях, до жизни. - угрожающая анафилаксия. В некоторых из этих случаев реакция аллергии на укус комара возникла до постановки диагноза MCL, что позволяет предположить, что аллергия на укус комара может быть проявлением раннеразвивающейся мантийноклеточной лимфомы. [12] [13]
Патогенез
[ редактировать ]
MCL, как и большинство видов рака , возникает в результате приобретения комбинации (ненаследственных) генетических мутаций в соматических клетках . Это приводит к клональной экспансии злокачественных В-лимфоцитов. Факторы, которые инициируют генетические изменения, обычно не поддаются выявлению и обычно возникают у людей, не имеющих особых факторов риска развития лимфомы. Поскольку это приобретенное генетическое заболевание, MCL не заразен. [14] и не наследуется. [15]
Определяющей характеристикой MCL является мутация и сверхэкспрессия циклина D1, гена клеточного цикла , который способствует аномальной пролиферации злокачественных клеток. , вызванному лекарствами Клетки MCL также могут быть устойчивы к апоптозу , что затрудняет их лечение с помощью химиотерапии или радиации. Клетки, пораженные MCL, пролиферируют по узловому или диффузному типу с двумя основными цитологическими вариантами: типичными и бластными . Типичными случаями являются клетки малого и среднего размера с нерегулярными ядрами . Бластические (также известные как бластоидные ) варианты имеют клетки среднего и крупного размера с мелкодисперсным хроматином и более агрессивны по своей природе. [16] Опухолевые клетки накапливаются в лимфоидной системе, включая лимфатические узлы и селезенку, а бесполезные клетки в конечном итоге приводят к дисфункции системы. MCL также может заменять нормальные клетки костного мозга, что ухудшает нормальное производство клеток крови. [17]
Диагностика
[ редактировать ]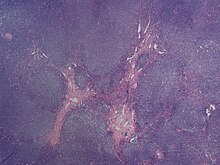



Сбор анамнеза и физическое обследование могут выявить некоторые признаки и симптомы, характерные для лимфомы мантийных клеток. Биопсия пораженных тканей (таких как лимфатические узлы, костный мозг, желудочно-кишечный тракт, селезенка или другие области) показывает характерные гистопатологические изменения MCL. При биопсии наблюдаются отчетливые закономерности роста MCL; к ним относятся диффузный тип, узловой тип, лимфома мантийной зоны и лимфома мантийных клеток in situ. [7] При диффузном росте наблюдается диффузный рост клеток лимфомы по всему лимфатическому узлу, что приводит к стиранию архитектуры лимфатического узла. [7] При узловом типе в лимфатическом узле имеются крупные узелки клеток MCL без каких-либо зародышевых центров. [7] При МКЛ с расширением мантийной зоны клетки лимфомы вызывают расширение мантийной зоны вокруг нормальных зародышевых центров. [7] А при MCL in situ клетки лимфомы содержатся в мантийной зоне без расширения. [7] Гистологически клетки лимфомы при классическом MCL характеризуются как лимфоциты малого и среднего размера со скудной цитоплазмой и слипшимся хроматином с выраженными ядерными щелями, а ядрышки не видны. [7] Существуют цитологические подтипы; бластоидный подтип характеризуется круглыми ядрами, тонким хроматином с отчетливыми ядрышками. [7] Плеоморфный подтип характеризуется ядрами, которые различаются по размеру и форме, некоторые имеют расщепленную форму. [7] Бластоидный и плеоморфный подтипы MCL характеризуются более агрессивным течением. [7]
Наиболее распространенным типом B-клеток, наблюдаемым при MCL, являются клетки прегерминального центра (которые еще не подверглись реакции зародышевого центра), то есть CD5 , CD20 , CD19- положительные с экспрессией IgM и IgD с моноклональными каппа- и гамма-легкими цепями. . [18] CD23 и CD200 обычно отрицательны, а циклин-D1 (белок, регулирующий клеточный цикл, контролирующий переход из фазы G1 в фазу S в клеточном цикле ) классически сверхэкспрессируется в MCL. [18] SOX11 (фактор транскрипции, контролирующий гены, участвующие в выживании клеток) также характерно сверхэкспрессируется в MCL. [18] Ki-67 , маркер клеточной пролиферации, если его повышенный уровень (экспрессия более 30%), связан с агрессивным течением MCL. [18]
Хромосомная оценка с использованием флуоресцентной гибридизации in situ показывает характерную хромосомную транслокацию t(11;14)(q13;q32), которая присутствует в 90–95% случаев MCL. [18] Визуализация с использованием компьютерной томографии (КТ) или позитронно-эмиссионной томографии необходима для оценки любого экстраузлового или дистального поражения. [18]
МРТ головного мозга и позвоночника проводят при МКЛ с подозрением на поражение ЦНС. [18] А поскольку в 40–80% случаев MCL на момент постановки диагноза присутствует поражение желудочно-кишечного тракта, эндоскопия ( колоноскопия и эзофагогастродуоденоскопия (ЭГДС)) с биопсией также может помочь в диагностике, но они не всегда необходимы для диагностики MCL. [18]
Диагноз может быть затруднен, поскольку в меньшинстве случаев множественной миеломы , хронического лимфоцитарного лейкоза и плазмоцитарного лейкоза также может присутствовать транслокация t(11;14)(q13;q32). [18] Диагностика может быть еще более затруднена, поскольку некоторые случаи MCL проявляются атипично; эти редкие подтипы включают CD10-положительный MCL, CD5-отрицательный MCL, циклин-D1-отрицательный MCL, CD200-положительный MCL, SOX-11-отрицательный MCL и CD23-положительный MCL. [18] Циклин-D1-негативные подтипы MCL обычно приводят к лимфомогенезу за счет сверхэкспрессии циклина D2 , циклина D3 или циклина E , что также приводит к гиперактивности клеточного цикла и имеет прогноз, аналогичный основному варианту циклин-D1 MCL. [7]
Системы Лугано и Анн-Арбора — это два широко используемых клинических критерия стадирования, используемые для определения стадии заболевания, позволяющие принимать решения в отношении лечения, прогноза и спасательной терапии . [18]
Лечение
[ редактировать ]Не существует проверенных стандартов лечения MCL, и среди специалистов нет единого мнения о том, как его лечить оптимально. [19] Доступно множество схем, и часто они дают хорошие результаты, но у пациентов почти всегда наблюдается прогрессирование заболевания после химиотерапии. Каждый рецидив, как правило, труднее лечить, и рецидив обычно протекает быстрее. По состоянию на 2023 год он неизлечим, хотя некоторые пациенты могут прожить много лет после первоначального диагноза. [5] Доступны схемы лечения рецидивов, а новые подходы проходят испытания. Из-за вышеупомянутых факторов многие пациенты с MCL участвуют в клинических исследованиях, чтобы получить новейшие методы лечения. Исследование, проведенное в специализированном лечебном центре в Великобритании, показало, что в общей сложности 58,7% пациентов, проходивших лечение в больнице, были зарегистрированы по крайней мере в одном клиническом исследовании. пробный. [20] Действительно, это вполне может быть рекомендацией команды по уходу за пациентами в надежде, что это даст им доступ к последним достижениям. [9]
Обычно используются четыре класса методов лечения: химиотерапия , иммунотерапия , радиоиммунотерапия и биологические агенты. Обычно выделяют следующие этапы лечения: первая линия, после постановки диагноза, консолидация, после первой линии (для продления ремиссии) и рецидив. Рецидив обычно наблюдается несколько раз. [21]
Химиотерапия
[ редактировать ]Химиотерапия широко используется в качестве лечения первой линии и часто не повторяется при рецидиве из-за побочных эффектов. Альтернативная химиотерапия иногда используется при первом рецидиве. Для лечения первой линии CHOP с ритуксимабом является наиболее распространенной химиотерапией, которую часто назначают амбулаторно внутривенно. Более мощная химиотерапия с более выраженными побочными эффектами (в основном гематологическими) — это HyperCVAD , часто назначаемая в условиях больницы с ритуксимабом и обычно пациентам в хорошей физической форме (некоторые из которых старше 65 лет). HyperCVAD становится популярным и показывает многообещающие результаты, особенно при использовании ритуксимаба. Его можно использовать у некоторых пожилых пациентов (старше 65 лет), но он кажется полезным только в том случае, если исходный анализ крови на бета-2-МГ был нормальным. Он демонстрирует лучшие показатели полной ремиссии (CR) и выживаемости без прогрессирования (PFS), чем схемы CHOP. Менее интенсивный вариант — бендамустин с ритуксимабом. [22]
Лечение второй линии может включать флударабин в сочетании с циклофосфамидом и/или митоксантроном , обычно с ритуксимабом. Кладрибин и клофарабин — два других препарата, исследуемых в MCL. Относительно новая схема, в которой используются старые лекарства, — это ПКП-С, которая включает относительно небольшие ежедневные дозы преднизолона , этопозида , прокарбазина и циклофосфамида, принимаемые перорально, и доказала свою эффективность у пациентов с рецидивами. По словам доктора Джона Леонарда, PEP-C может обладать антиангиогенными свойствами. [23] [24] то, что он и его коллеги тестируют в ходе продолжающихся испытаний препарата. [25]
Другой подход предполагает использование очень высоких доз химиотерапии, иногда в сочетании с общим облучением тела (ЧМТ), в попытке уничтожить все признаки заболевания. Обратной стороной этого является разрушение всей иммунной системы пациента, что требует спасения путем трансплантации новой иммунной системы ( трансплантация гемопоэтических стволовых клеток ), используя либо трансплантацию аутологичных стволовых клеток , либо трансплантацию от соответствующего донора ( аллогенные стволовые клетки). трансплантация ). Презентация Кристиана Гейслера, председателя Скандинавской группы лимфомы, на конференции Американского общества гематологов (ASH) в декабре 2007 г. [26] утверждал, что, согласно результатам испытаний, лимфома из мантийных клеток потенциально излечима с помощью очень интенсивной химиоиммунотерапии с последующей трансплантацией стволовых клеток при лечении при первом появлении заболевания. [27] [28]
Эти результаты, по-видимому, подтверждаются крупным исследованием Европейской сети мантийных клеток лимфомы, показывающим, что схемы индукции, содержащие моноклональные антитела и высокие дозы цитарабина с последующей трансплантацией аутологичных стволовых клеток, должны стать стандартом лечения пациентов с MCL в возрасте примерно до 65 лет. . [29] [30]
Исследование, опубликованное в апреле 2013 года, показало, что у пациентов с ранее не леченной индолентной лимфомой бендамустин в сочетании с ритуксимабом может рассматриваться в качестве предпочтительного подхода к лечению первой линии по сравнению с R-CHOP из-за увеличения выживаемости без прогрессирования и меньшего количества токсических эффектов. [31]
Иммунотерапия
[ редактировать ]В иммунотерапии преобладает использование моноклональных антител ритуксимаба , продаваемых под торговым названием Ритуксан (или Мабтера в Европе и Австралии). Ритуксимаб может обладать хорошей активностью против MCL в качестве отдельного препарата, но обычно его назначают в сочетании с химиотерапией, что продлевает продолжительность ответа. Есть более новые [ когда? ] варианты моноклональных антител в сочетании с радиоактивными молекулами, известные как радиоиммунотерапия . К ним относятся Зевалин и Бексар . Ритуксимаб также применялся у небольшого числа пациентов в сочетании с талидомидом с некоторым эффектом. [32] В отличие от «пассивной» иммунотерапии на основе антител, область «активной» иммунотерапии пытается активировать иммунную систему пациента для целенаправленного уничтожения собственных опухолевых клеток. Примеры активной иммунотерапии включают противораковые вакцины , адоптивный перенос клеток и иммунотрансплантацию , которая сочетает в себе вакцинацию и трансплантацию аутологичных стволовых клеток . По состоянию на 2023 год активная иммунотерапия не является стандартом лечения. [5] но многочисленные клинические испытания продолжаются. [33] [34] [35]
Таргетная терапия
[ редактировать ]Два ингибитора тирозинкиназы Брутона (BTKi), один в ноябре 2013 года ибрутиниб (торговая марка Imbruvica , Pharmacyclics LLC) и один в октябре 2017 года акалабрутиниб (торговая марка Calquence, AstraZeneca Pharmaceuticals LP) были одобрены в США для лечения мантийноклеточной лимфомы. . [36] Однако, хотя эти лекарства и полезны, их продолжительность непродолжительна, и у пациентов обычно возникает рецидив. [5]
В ноябре 2019 года занубрутиниб (Брукинса) был одобрен в США с показанием для лечения взрослых с мантийно-клеточной лимфомой, которые ранее получали хотя бы один курс терапии. [37]
Пиртобрутиниб (Джайпирка) был одобрен для медицинского применения в США в январе 2023 года. [38]
Генная терапия
[ редактировать ]Брексукабтагеновый аутолейцел (Tecartus) был одобрен для медицинского применения в США в июле 2020 года с показанием для лечения взрослых с рецидивирующей или рефрактерной мантийноклеточной лимфомой. [39] [40] [41] Он был одобрен для медицинского использования в Европейском Союзе в декабре 2020 года. [42]
Каждая доза аутолейцела брексукабтагена представляет собой индивидуальное лечение, созданное с использованием собственной иммунной системы реципиента для борьбы с лимфомой. [39] реципиента ( Т-клетки тип лейкоцитов) собираются и генетически модифицируются для включения нового гена, который облегчает нацеливание и уничтожение клеток лимфомы. [39] Эти модифицированные Т-клетки затем вводятся обратно реципиенту. [39]
Прогноз
[ редактировать ]Недавний [ когда? ] Клинические достижения в области мантийно-клеточной лимфомы (MCL) привели к изменению стандартных алгоритмов лечения. Передовая комбинированная терапия ритуксимабом, индукция на основе цитарабина в высоких дозах у более молодых пациентов и, в последнее время, [ когда? ] Все ингибиторы тирозинкиназы Брутона (BTK) в условиях рецидива продемонстрировали преимущество в выживаемости в клинических исследованиях (Wang et al., 2013; Eskelund et al., 2016; Rule et al., 2016). За последнее [ когда? ] За 15 лет эти методы постепенно вошли в клиническую практику, и реальные данные свидетельствуют о соответствующем улучшении выживаемости пациентов (Abrahamsson et al., 2014; Leux et al., 2014). [43]
Общая 5-летняя выживаемость при MCL обычно составляет 50%. [44] (продвинутая стадия MCL) до 70% [45] (для MCL ограниченной стадии).
Прогноз для людей с MCL проблематичен, а индексы не работают должным образом, поскольку у большинства пациентов заболевание находится на поздней стадии. [9] Используется определение стадий, но оно не очень информативно, поскольку злокачественные В-клетки могут свободно перемещаться по лимфатической системе, и поэтому большинство пациентов на момент постановки диагноза находятся на стадии III или IV. Стадия MCL не сильно влияет на прогноз, и концепция метастазирования на самом деле не применима. [46]
Международный прогностический индекс мантийноклеточной лимфомы (MIPI) был получен на основе набора данных о 455 пациентах с поздней стадией MCL, проходивших лечение в серии клинических исследований в Германии/Европе. Из поддающейся оценке популяции примерно 18% лечились высокими дозами терапии и трансплантацией стволовых клеток в первой ремиссии. MIPI позволяет разделить пациентов на три группы риска: низкий риск (медиана выживаемости не достигается после медианы 32-месячного наблюдения и 5-летняя выживаемость 60%), промежуточный риск (медиана выживаемости 51 месяц) и высокий риск (медиана выживаемости 51 месяц). выживаемость 29 месяцев). Было показано, что в дополнение к 4 независимым прогностическим факторам, включенным в модель, индекс пролиферации клеток (Ki-67) также имеет дополнительную прогностическую значимость. Когда Ki67 доступен, можно рассчитать биологический MIPI. [47]
MCL — одна из немногих неходжкинских лимфом, которые могут проникать в мозг, но в этом случае ее можно лечить. [ нужна медицинская ссылка ]
Был изучен ряд прогностических показателей. Нет единого мнения об их важности или полезности для прогноза. [46]
Ki-67 является индикатором того, насколько быстро созревают клетки, и выражается в диапазоне примерно от 10% до 90%. Чем ниже процент, тем ниже скорость созревания и более вялотекущая болезнь. Катценбергер и др. графики выживаемости от времени для подгрупп пациентов с различными индексами Ki-67. Он показывает среднее время выживания около одного года для 61–90% Ki-67 и почти 4 года для 5–20% индекса Ki-67. [48]
Типы клеток MCL могут субъективно помочь в прогнозе. Бластик — более крупный тип клеток. Диффузный распространяется по узлу. Узелковые — это небольшие группы собранных клеток, разбросанные по узлу. Диффузный и узловой по своему поведению схожи. Бластик растет быстрее и добиться длительной ремиссии труднее. Было высказано предположение, что со временем некоторые небластические MCL трансформируются в бластические; однако в этой модели предполагается, что увеличение генетических изменений приводит к потере контроля клеточного цикла, более высокой скорости пролиферации и, следовательно, к бластоидным особенностям. Однако у некоторых пациентов при первоначальном обращении часто наблюдаются бластоидные признаки, тогда как в других случаях классический MCL остается морфологически стабильным на протяжении всего заболевания. [49] Хотя выживаемость большинства бластных пациентов короче, некоторые данные показывают, что 25% пациентов с бластным MCL доживают до 5 лет. [49] Это дольше, чем диффузный тип, и почти такой же, как узловой (почти 7 лет). [ нужна медицинская ссылка ]
Бета-2-микроглобулин является еще одним фактором риска при MCL, который используется преимущественно у пациентов, перенесших трансплантацию. Значения менее трех дают 95% общей выживаемости до шести лет для ауто-СКТ, тогда как более трех дают медиану максимальной общей выживаемости в 44 года для ауто-СКТ (Хури 03). Это еще не [ когда? ] полностью валидирован. [ нужна медицинская ссылка ]
Тестирование на высокий уровень лактатдегидрогеназы у пациентов с неходжкинской лимфомой полезно, поскольку она высвобождается при разрушении тканей организма по какой-либо причине. Хотя его нельзя использовать в качестве единственного средства диагностики неходжкинской лимфомы, он является маркером для отслеживания опухолевой нагрузки у тех, кто диагностирован другими методами. Нормальный диапазон составляет примерно от 140 до 280 Ед/л. [50] но клиническая интерпретация будет зависеть от симптомов пациента.
Эпидемиология
[ редактировать ]6% случаев неходжкинской лимфомы представляют собой мантийноклеточную лимфому. [2] По состоянию на 2015 год [update]соотношение заболевших мужчин и женщин составляет примерно 4:1. [2]
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ «Факты о мантийноклеточной лимфоме» (PDF) . lls.org . Архивировано из оригинала (PDF) 9 февраля 2015 года . Проверено 10 апреля 2018 г.
- ^ Перейти обратно: а б с Скарбник А.П., Гой А.Х. (январь 2015 г.). «Мантийноклеточная лимфома: современное состояние». Clin Adv Гематол Онкол . 13 (1): 44–55. ПМИД 25679973 .
- ^ «Мантийноклеточная лимфома» . www.cancerresearchuk.org . Проверено 8 октября 2023 г.
- ^ «Действие лимфомы | Мантийноклеточная лимфома» . Действие лимфомы . 26 февраля 2021 г. Проверено 8 октября 2023 г.
- ^ Перейти обратно: а б с д и Хуан, Цзуфан; Чавда, Вивек П.; Безбаруа, Раджашри; Дхамне, Хемант; Ян, Дун-Хуа; Чжао, Хун-Бин (31 марта 2023 г.). «CAR T-клеточная терапия для лечения мантийноклеточной лимфомы» . Молекулярный рак . 22 (1): 67. дои : 10.1186/s12943-023-01755-5 . ISSN 1476-4598 . ПМЦ 10064560 . ПМИД 37004047 .
- ^ "t(11;14)(q13;q32) IGH/CCND1" . atlasgeneticsoncology.org . Проверено 10 апреля 2018 г.
- ^ Перейти обратно: а б с д и ж г час я дж к л м н тот п Армитидж, Джеймс О.; Лонго, Дэн Л. (30 июня 2022 г.). «Мантийноклеточная лимфома». Медицинский журнал Новой Англии . 386 (26): 2495–2506. дои : 10.1056/NEJMra2202672 . PMID 35767440 .
- ^ Общество лейкемии и лимфомы (2014). «Факты о мантийноклеточной лимфоме» (PDF) . www.LLS.org . Архивировано из оригинала (PDF) 9 февраля 2015 года . Проверено 21 августа 2013 г.
- ^ Перейти обратно: а б с Маккей, Памела; Лич, Майк; Джексон, Боб; Робинсон, Стивен; Рул, Саймон (16 мая 2018 г.). «Руководство по лечению мантийноклеточной лимфомы» . Британский журнал гематологии . 182 (1): 46–62. дои : 10.1111/bjh.15283 . hdl : 10026.1/11531 . ISSN 0007-1048 . ПМИД 29767454 . S2CID 21725055 .
- ^ Чепмен-Фредрикс, Дженнифер; Сандовал-Сус, Хосе; Вега, Франциско; Лоссос, Изидор С. (1 августа 2014 г.). «Прогрессирующая лейкемическая неузловая мантийноклеточная лимфома, связанная с делециями TP53, ATM и/или 13q14». Анналы диагностической патологии . 18 (4): 214–219. doi : 10.1016/j.anndiagpath.2014.03.006 . ПМИД 24852242 .
- ^ Орчард, Дженни; Гаранд, Ричард; Дэвис, Зейди; Бэббидж, Гэвин; Сахота, Суриндер; Матутес, Эстелла; Катовский, Даниэль; Томас, Питер В.; Аве-Луазо, Эрве; Осье, Дэвид (15 июня 2003 г.). «Подгруппа лимфом t(11;14) с признаками мантийных клеток демонстрирует мутированные гены IgVH и включает пациентов с хорошим прогнозом и неузловым заболеванием» . Кровь . 101 (12): 4975–4981. дои : 10.1182/кровь-2002-06-1864 . ПМИД 12609845 .
- ^ Тацуно К., Фудзияма Т., Мацуока Х., Симаучи Т., Ито Т., Токура Ю. (июнь 2016 г.). «Клинические категории усиленных кожных реакций на укусы комаров и их патофизиология». Журнал дерматологической науки . 82 (3): 145–52. дои : 10.1016/j.jdermsci.2016.04.010 . ПМИД 27177994 .
- ^ Кириакидис И, Василиу Э, Карастрати С, Трагианнидис А, Гомпакис Н, Хацистилиану М (декабрь 2016 г.). «Первичная инфекция ВЭБ и повышенная чувствительность к укусам комаров: описание случая» . Вирусология Синика . 31 (6): 517–520. дои : 10.1007/s12250-016-3868-4 . ПМК 8193400 . ПМИД 27900557 . S2CID 7996104 .
- ^ «Понимание мантийноклеточной лимфомы» . www.macmillan.org.uk . Проверено 8 октября 2023 г.
- ^ «Мантийноклеточная лимфома (МКЛ)» . сайт лимфомации . Проверено 8 октября 2023 г.
- ^ Гой, Андре. «Мантийноклеточная лимфома: информация для врачей» . Медскейп . Проверено 18 октября 2007 г.
- ^ «Факты о мантийноклеточной лимфоме» . Общество лейкемии и лимфомы . 8 октября 2023 г. Проверено 8 октября 2023 г.
- ^ Перейти обратно: а б с д и ж г час я дж к Джайн, Притеш; Ван, Майкл Л. (май 2022 г.). «Мантийноклеточная лимфома в 2022 году — комплексная обновленная информация о молекулярном патогенезе, стратификации риска, клиническом подходе, а также современных и новых методах лечения». Американский журнал гематологии . 97 (5): 638–656. дои : 10.1002/ajh.26523 . ПМИД 35266562 . S2CID 247362063 .
- ^ Раджаби Б., Суитенхэм Дж.В. (2015). «Мантийноклеточная лимфома: от наблюдения до трансплантации» . Тер Адв Гематол . 6 (1): 37–48. дои : 10.1177/2040620714561579 . ПМЦ 4298490 . ПМИД 25642314 .
- ^ Маккалок, Рори; Смит, Александра; Кросби, Никола; Патмор, Рассел; Рул, Саймон (26 ноября 2018 г.). «Лечение в специализированном центре увеличивает общую выживаемость пациентов с мантийно-клеточной лимфомой» . Британский журнал гематологии . 185 (5): 1002–1004. дои : 10.1111/bjh.15696 . ISSN 0007-1048 . ПМИД 30474177 . S2CID 53731469 .
- ^ «Варианты терапии рецидивирующей/рефрактерной мантийноклеточной лимфомы» . ashpublications.org . Проверено 8 октября 2023 г.
- ^ «Архивная копия» (PDF) . Архивировано из оригинала (PDF) 23 июня 2017 года . Проверено 18 марта 2015 г.
{{cite web}}: CS1 maint: архивная копия в заголовке ( ссылка ) - ^ «Комбинированная пероральная химиотерапия Pep-C (C3) при мантийно-клеточной лимфоме (MCL): ежедневный преднизолон, этопозид, прокарбазин и циклофосфамид – ASCO» . Архивировано из оригинала 29 сентября 2008 года . Проверено 15 января 2008 г. [ нужна полная цитата ]
- ^ «Доктор Джон Леонард» . Архивировано из оригинала 17 апреля 2008 года . Проверено 24 февраля 2008 г. [ нужна полная цитата ]
- ^ «Испытание фазы II антиангиогенной терапии с помощью RT-PEPC у пациентов с рецидивирующей мантийноклеточной лимфомой» . 26 июня 2018 г.
- ^ "Фон" . Архивировано из оригинала 16 апреля 2008 года . Проверено 15 февраля 2008 г.
- ^ «Мантийноклеточная лимфома излечима с помощью интенсивной иммунохимиотерапии» . ДокГид .
- ^ «Просмотр содержимого результатов» . Архивировано из оригинала 17 апреля 2008 года.
- ^ Йе Х., Десаи А., Хуан С. и др. (июль 2018 г.). «Первостепенная терапия для молодых и здоровых пациентов с мантийно-клеточной лимфомой: стратегии терапии первой линии» . Дж. Эксп. Клин. Рак Рез . 37 (1): 150. дои : 10.1186/s13046-018-0800-9 . ПМК 6044039 . ПМИД 30005678 .
- ^ Йе Х., Десаи А., Цзэн Д. и др. (ноябрь 2018 г.). «Первое лечение пожилых пациентов с мантийно-клеточной лимфомой» . Онколог . 23 (11): 1337–1348. doi : 10.1634/теонколог.2017-0470 . ПМК 6291324 . ПМИД 29895632 .
- ^ Раммель М.Дж., Нидерле Н., Машмейер Г. и др. (апрель 2013 г.). «Бендамустин плюс ритуксимаб в сравнении с CHOP плюс ритуксимаб в качестве лечения первой линии для пациентов с индолентными и мантийно-клеточными лимфомами: открытое, многоцентровое, рандомизированное исследование 3-й фазы не меньшей эффективности». Ланцет . 381 (9873): 1203–10. дои : 10.1016/S0140-6736(12)61763-2 . ПМИД 23433739 . S2CID 27886488 .
- ^ Кауфманн Х., Радерер М., Верер С. и др. (октябрь 2004 г.). «Противоопухолевая активность ритуксимаба плюс талидомида у пациентов с рецидивирующей/рефрактерной мантийноклеточной лимфомой» . Кровь . 104 (8): 2269–71. дои : 10.1182/кровь-2004-03-1091 . ПМИД 15166030 . S2CID 24548471 .
- ^ «Химиотерапия плюс вакцинация для лечения мантийноклеточной лимфомы - NCT00101101» . ClinicalTrials.gov . Проверено 28 февраля 2016 г. .
- ^ «Химиотерапия плюс вакцинация для лечения мантийноклеточной лимфомы - NCT00005780» . ClinicalTrials.gov . Проверено 28 февраля 2016 г. .
- ^ «Химиотерапия плюс вакцинация для лечения мантийноклеточной лимфомы - NCT00490529» . ClinicalTrials.gov . Проверено 28 февраля 2016 г. .
- ^ «FDA одобряет Имбрувику для лечения редких видов рака крови». США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 13 ноября 2013 г. «FDA одобряет Calquence. 31 октября 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов предоставило ускоренное одобрение акалабрутинибу (AstraZeneca Pharmaceuticals Inc. по лицензии Acerta Pharma BV) с показанием для лечения взрослых с лимфомой мантийных клеток (MCL), прошли хотя бы один предшествующий курс терапии» (пресс-релиз). Архивировано из оригинала 16 февраля 2017 года . Проверено 15 ноября 2019 г. .
- ^ «FDA одобрило терапию для лечения пациентов с рецидивирующей и рефрактерной мантийно-клеточной лимфомой, что подтверждается результатами клинических испытаний, показывающими высокую скорость уменьшения опухоли» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) (пресс-релиз). 14 ноября 2019 года . Проверено 15 ноября 2019 г. .
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «FDA США одобрило Джейпирку (пиртобрутиниб), первый и единственный нековалентный (обратимый) ингибитор BTK, для взрослых пациентов с рецидивирующей или рефрактерной мантийно-клеточной лимфомой после как минимум двух линий системной терапии, включая ингибитор BTK» (пресс-релиз) . Эли Лилли. 27 января 2023 г. Проверено 31 января 2023 г. - через PR Newswire.
- ^ Перейти обратно: а б с д «FDA одобрило первую клеточную генную терапию для взрослых пациентов с рецидивирующим или рефрактерным MCL» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 24 июля 2020 г. Проверено 24 июля 2020 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе . - ^ «Текарт» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 24 июля 2020 г. СТН: BL 125703 . Проверено 24 июля 2020 г.
- ^ «FDA США одобрило Tecartus Кайта, первое и единственное средство CAR T для лечения рецидивирующей или рефрактерной мантийноклеточной лимфомы» (пресс-релиз). Кайт Фарма. 24 июля 2020 г. Проверено 24 июля 2020 г. - через Business Wire.
- ^ «Текартус ЭПАР» . Европейское агентство лекарственных средств (EMA) . 13 октября 2020 г. Проверено 25 января 2021 г.
- ^ Британский журнал гематологии, 20 ноября 2018 г.
- ^ Самые последние значения в: Херрманн А., Хостер Э., Цвингерс Т. и др. (февраль 2009 г.). «Улучшение общей выживаемости при лимфоме из мантийных клеток поздней стадии» . Дж. Клин. Онкол . 27 (4): 511–8. дои : 10.1200/JCO.2008.16.8435 . ПМИД 19075279 .
- ^ Лейтч Х.А., Гаскойн Р.Д., Чханабхай М., Восс Н.Дж., Класа Р., Коннорс Дж.М. (октябрь 2003 г.). «Мантийноклеточная лимфома ограниченной стадии» . Энн. Онкол . 14 (10): 1555–61. дои : 10.1093/annonc/mdg414 . ПМИД 14504058 .
- ^ Перейти обратно: а б Ван, Ю; Ма, Шуанге (22 февраля 2014 г.). «Факторы риска этиологии и прогноза мантийноклеточной лимфомы» . Экспертное обозрение гематологии . 7 (2): 233–243. дои : 10.1586/17474086.2014.889561 . ISSN 1747-4086 . ПМЦ 4465399 . ПМИД 24559208 .
- ^ Хостер Э., Дрейлинг М., Клэппер В. и др. (январь 2008 г.). «Новый прогностический индекс (MIPI) для пациентов с поздней стадией мантийноклеточной лимфомы» . Кровь . 111 (2): 558–65. дои : 10.1182/blood-2007-06-095331 . ПМИД 17962512 . S2CID 19785998 .
- ^ Катценбергер, Тьемо (15 апреля 2006 г.). «Индекс пролиферации Ki67 является количественным показателем клинического риска мантийноклеточной лимфомы» . Кровь . 107 (8): 3407. doi : 10.1182/blood-2005-10-4079 . ПМИД 16597597 . Проверено 9 октября 2023 г.
- ^ Перейти обратно: а б Дрейлинг, Мартин; Клаппер, Вольфрам; Правило, Саймон (2018). «Бластоидная и плеоморфная мантийноклеточная лимфома: все еще остается сложной диагностической и терапевтической проблемой!» . Кровь . 132 (26): 2722–2729. дои : 10.1182/blood-2017-08-737502 . ПМИД 30385481 . S2CID 54433020 . Проверено 9 октября 2023 г.
- ^ Фархана, Аиша; Лаппин, Сара Л. (2023), «Биохимия, лактатдегидрогеназа» , StatPearls , Остров сокровищ (Флорида): StatPearls Publishing, PMID 32491468 , получено 9 октября 2023 г.
Дальнейшее чтение
[ редактировать ]- Коэн Дж.Б., Зейн Дж.М., Каль Б.С. (2017). «Современные подходы к мантийноклеточной лимфоме: диагностика, прогноз и лечение». Учебная книга Am Soc Clin Oncol . 37 (37): 512–25. дои : 10.1200/EDBK_175448 . ПМИД 28561694 .
- Дрейлинг М., Ферреро С., Эрмин О. (ноябрь 2014 г.). «Как лечить лимфому из мантийных клеток». Лейкемия . 28 (11): 2117–30. дои : 10.1038/leu.2014.171 . ПМИД 24854989 . S2CID 22105743 .
- Шибер М., Гордон Л.И., Кармали Р. (2018). «Современный обзор и лечение лимфомы мантийных клеток» . F1000Рес . 7 : 1136. doi : 10.12688/f1000research.14122.1 . ПМК 6069726 . ПМИД 30109020 .