Тихо
 | |
| Клинические данные | |
|---|---|
| Торговые названия | На полу |
| Другие имена | АВ-951 |
| AHFS / Drugs.com | Монография |
| МедлайнПлюс | а621018 |
| Данные лицензии | |
| Маршруты администрация | Через рот |
| код АТС | |
| Юридический статус | |
| Юридический статус | |
| Фармакокинетические данные | |
| Связывание с белками | >99% |
| Период полувыведения | 4,5–5,1 дня |
| Экскреция | 79% кала , 12% мочи |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| ИЮФАР/БПС | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| КЭБ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Химические и физические данные | |
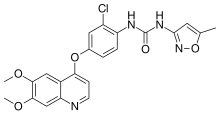
| Формула | С 22 Н 19 Cl N 4 О 5 |
| Молярная масса | 454.87 g·mol −1 |
| 3D model ( JSmol ) | |
Тивозаниб , продаваемый под торговой маркой Фотивда , представляет собой препарат, используемый для лечения распространенной почечно-клеточной карциномы (рака почки). [ 3 ] Это пероральный рецептора VEGF ингибитор тирозинкиназы . [ 3 ]
Наиболее распространенные побочные эффекты включают усталость (усталость), гипертонию (высокое кровяное давление), диарею , снижение аппетита , тошноту , дисфонию (изменение голоса), гипотиреоз , кашель и стоматит . [ 4 ] [ 3 ] [ 5 ]
Тивозаниб был одобрен для медицинского применения в Европейском Союзе в августе 2017 года. [ 4 ] и в США в марте 2021 года. [ 3 ] [ 5 ]
Медицинское использование
[ редактировать ]В США тивозаниб показан для лечения взрослых с рецидивирующим или рефрактерным распространенным почечно-клеточным раком после двух или более предшествующих системных терапий. [ 3 ]
В Европейском Союзе он показан для лечения взрослых с распространенным почечно-клеточным раком; и для лечения первой линии взрослых с распространенной почечно-клеточной карциномой и для взрослых, которые ранее не получали ингибиторы путей VEGFR и mTOR после прогрессирования заболевания после одного предшествующего лечения цитокиновой терапией по поводу распространенной почечно-клеточной карциномы. [ 4 ]
Противопоказания
[ редактировать ]Тивозаниб нельзя сочетать со зверобоем , индуктором печеночного фермента CYP3A4 . Его не следует принимать во время беременности, поскольку он тератогенен , эмбриотоксичен и фетотоксичен для крыс. [ 6 ]
Побочные эффекты
[ редактировать ]Наиболее частыми побочными эффектами в исследованиях были гипертония (высокое кровяное давление у 48% пациентов), дисфония (хриплость голоса у 27%), утомляемость и диарея (оба по 26%). Гипертонический криз возник у 1% больных. [ 6 ]
Взаимодействия
[ редактировать ]Введение однократной дозы тивозаниба с рифампицином , сильным индуктором фермента CYP3A4, сокращает биологический период полувыведения и общую экспозицию ( площадь под кривой ) тивозаниба вдвое, но не оказывает значимого влияния на самые высокие концентрации в крови. Комбинация с кетоконазолом , сильным ингибитором CYP3A4, не оказывает существенного эффекта. Клиническое значение этих результатов не известно. [ 6 ]
Фармакология
[ редактировать ]Механизм действия
[ редактировать ]Тивозаниб ангиогенез , , производное хинолинмочевины, подавляет избирательно ингибируя фактор роста эндотелия сосудов (VEGF). [ 7 ] Он предназначен для ингибирования всех трех рецепторов VEGF. [ 8 ]
Фармакокинетика
[ редактировать ]После перорального приема тивозаниба самые высокие уровни в сыворотке крови достигаются через 2–24 часа. Общая площадь под кривой не зависит от приема пищи. В кровотоке более 99% вещества связывается с белками плазмы , преимущественно с альбумином . Хотя ферменты CYP3A4 и CYP1A1 и некоторые УГТ способны метаболизировать препарат, более 90% циркулируют в неизмененной форме. Метаболитами являются деметилирования , гидроксилирования и N-окисления продукты и глюкурониды . [ 6 ]
Биологический период полураспада составляет от 4,5 до 5,1 дней; 79% выводится с калом , в основном в неизмененном виде, и 12% — с мочой, полностью в неизмененном виде. [ 6 ]
Химия
[ редактировать ]Тивозаниб используется в форме гидрохлорида моногидрата , который представляет собой порошок от белого до светло-коричневого цвета. Он практически нерастворим в воде и плохо растворяется в водных кислотах, этаноле и метаноле . Он не гигроскопичен и не оптически активен . [ 9 ]
История
[ редактировать ]Он был обнаружен в Кёва Кирин и разработан Aveo Pharmaceuticals. [ 10 ] [ нужен неосновной источник ]
США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило тивозаниб на основании данных одного клинического исследования с участием 350 взрослых участников с распространенным раком почки (почечно-клеточный рак), которые ранее лечились двумя или более лекарствами и вернулись или не ответили на лечение. уход. [ 5 ] В исследовании сравнивали участников, которые случайным образом были распределены на прием тивозаниба или сорафениба. [ 5 ] И участники, и медицинские работники знали, какое лечение им проводилось. [ 5 ] Лечение продолжалось до тех пор, пока заболевание не прогрессировало или побочные эффекты не стали слишком токсичными. [ 5 ] В ходе исследования сравнивали продолжительность жизни участников без прогрессирования заболевания между двумя группами. [ 5 ] Исследование проводилось в 120 центрах в 12 странах Северной Америки и Европы. [ 5 ] Число участников, представляющих данные об эффективности, может отличаться от количества пациентов, представляющих данные о безопасности, из-за различных групп участников исследования, проанализированных на предмет эффективности и безопасности. [ 5 ]
Клинические испытания
[ редактировать ]Результаты III фазы лечения распространенной почечно-клеточной карциномы позволили предположить улучшение медианы выживаемости без прогрессирования на 30% или 3 месяца по сравнению с сорафенибом , но показали меньшую общую выживаемость в экспериментальной группе по сравнению с контрольной группой. [ 8 ] [ 11 ] В мае 2013 года Консультативный комитет по онкологическим препаратам Управления по санитарному надзору за качеством пищевых продуктов и медикаментов проголосовал 13 против 1 против рекомендации об утверждении тивозаниба для лечения почечно-клеточного рака. Комитет счел, что препарат не продемонстрировал благоприятного соотношения риска и пользы, и поставил под сомнение сбалансированность дизайна исследования, которое позволяло пациентам контрольной группы, принимавшим сорафениб , перейти на тивозаниб после прогрессирования заболевания, но не пациентам из экспериментальной группы, принимавшим тивозаниб, перейти на тивозаниб. сорафениб . Заявка . была официально отклонена FDA в июне 2013 года, заявив, что для одобрения потребуются дополнительные клинические исследования [ 11 ]
В 2016 году Aveo Oncology объявила о начале второго клинического исследования фазы III у пациентов с поздним ПКР третьей линии. [ 12 ] [ нужен неосновной источник ]
Общество и культура
[ редактировать ]Юридический статус
[ редактировать ]В августе 2017 года Европейская комиссия одобрила тивозаниб для медицинского применения в Европейском Союзе. [ 4 ] [ 13 ]
Ссылки
[ редактировать ]- ^ «Фотивда 890 мкг твердые капсулы. Краткое описание характеристик продукта (SmPC)» . (эмс) . 4 апреля 2023 года. Архивировано из оригинала 6 апреля 2023 года . Проверено 23 июля 2023 г.
- ^ «Фотивдативозаниб капсула» . ДейлиМед . Архивировано из оригинала 13 сентября 2021 года . Проверено 12 сентября 2021 г.
- ^ Jump up to: а б с д и ж «FDA одобряет тивозаниб для лечения рецидивирующих или рефрактерных распространенных почечных клеток» . Управление по контролю за продуктами и лекарствами США . 10 марта 2021 года. Архивировано из оригинала 11 марта 2021 года . Проверено 16 марта 2021 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с д и «Фотивда ЭПАР» . Европейское агентство лекарственных средств (EMA) . Архивировано из оригинала 13 мая 2021 года . Проверено 16 марта 2021 г. Текст скопирован из источника, права на который принадлежат Европейскому агентству по лекарственным средствам. Воспроизведение разрешено при условии указания источника.
- ^ Jump up to: а б с д и ж г час я «Снимок испытаний наркотиков: Фотивда» . США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) . 10 марта 2021 года. Архивировано из оригинала 23 июля 2023 года . Проверено 23 июля 2023 г.
 В данную статью включен текст из этого источника, находящегося в свободном доступе .
В данную статью включен текст из этого источника, находящегося в свободном доступе .
- ^ Jump up to: а б с д и «Фотивда: EPAR – Информация о продукте» (PDF) . Европейское агентство по лекарственным средствам . 22 ноября 2017 г. Архивировано (PDF) из оригинала 18 июня 2018 г. . Проверено 18 июня 2018 г.
- ^ Кампас С., Болос Дж., Кастанер Р. (октябрь 2009 г.). «Тивозаниб VEGFR, ингибитор тирозинкиназы, ингибитор ангиогенеза, онколитический». Наркотики будущего . 34 (10): 793–6. дои : 10.1358/dof.2009.034.10.1417872 . S2CID 261245175 .
- ^ Jump up to: а б «Результаты фазы III побудили Aveo и Astellas спланировать подачу документов в регулирующие органы по Тивозанибу» . 3 января 2012 г. Архивировано из оригинала 18 июня 2018 г. Проверено 8 февраля 2012 года .
- ^ «Фотивда: EPAR – Отчет об общественной оценке» (PDF) . Европейское агентство по лекарственным средствам . 22 ноября 2017 г. Архивировано (PDF) из оригинала 18 июня 2018 г. . Проверено 18 июня 2018 г.
- ^ «Тивозаниб (VEGFR TKI)» . Aveo Pharmaceuticals, Inc. Архивировано из оригинала 4 августа 2021 года . Проверено 24 июля 2023 г.
- ^ Jump up to: а б «FDA отвергает лекарство от рака почек Тивозаниб» . МедПейдж сегодня. 30 июня 2013 г. Архивировано из оригинала 10 мая 2019 г. . Проверено 15 июля 2013 г.
- ^ «Aveo объявляет о дозировании первого пациента в основной фазе 3 исследования TIVO-3 тивозаниба при почечно-клеточном раке» (пресс-релиз). Aveo Pharmaceuticals, Inc. Архивировано из оригинала 11 июня 2016 года . Проверено 8 июля 2016 г.
- ^ «Фотивда» . Союзный реестр лекарственных средств . 29 августа 2017 года. Архивировано из оригинала 24 июля 2023 года . Проверено 23 июля 2023 г.
Внешние ссылки
[ редактировать ]- Номер клинического исследования NCT02627963 «Исследование по сравнению тивозаниба гидрохлорида с сорафенибом у участников с рефрактерной распространенной почечно-клеточной карциномой (ПКР)» на сайте ClinicalTrials.gov