Рецептор 1 фактора роста фибробластов
| ФГФР1 | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||||||||||||||||||||||||||
| Псевдонимы | FGFR1 , BFGFR, CD331, CEK, FGFBR, FGFR-1, FLG, FLT-2, FLT2, HBGFR, HH2, HRTFDS, KAL2, N-SAM, OGD, bFGF-R-1, ECCL, рецептор фактора роста фибробластов 1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Внешние идентификаторы | Опустить : 136350 ; МГИ : 95522 ; Гомологен : 69065 ; Генные карты : FGFR1 ; ОМА : FGFR1 — ортологи | ||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
Рецептор 1 фактора роста фибробластов ( FGFR-1 ), также известный как рецептор 1 основного фактора роста фибробластов , fms-связанная тирозинкиназа-2 / синдром Пфайффера и CD 331, представляет собой рецепторную тирозинкиназу , лиганды которой являются специфическими участниками роста фибробластов. семейство факторов . Было показано, что FGFR-1 связан с синдромом Пфайффера . [ 5 ] и клональные эозинофилии . [ 6 ]
Ген
[ редактировать ]Ген FGFR1 расположен на хромосоме 8 человека в положении p11.23 (т.е. 8p11.23), имеет 24 экзона и кодирует мРНК-предшественник , которая альтернативно сплайсируется в экзонах 8A или 8B, тем самым генерируя две мРНК, кодирующие две изоформы FGFR1 . FGFR1-IIIb (также называемый FGFR1b) и FGFR1-IIIc (также называемый FGFR1c) соответственно. Хотя эти две изоформы имеют различное распределение в тканях и аффинность связывания FGF, FGFR1-IIIc, по-видимому, отвечает за большинство функций гена FGFR1, тогда как FGFR1-IIIb, по-видимому, играет лишь незначительную, несколько дублирующую функциональную роль. [ 7 ] [ 8 ] Есть еще четыре члена семейства генов FGFR1 : FGFR2 , FGFR3 , FGFR4 и рецептор-подобный фактору роста фибробластов 1 (FGFRL1). Ген FGFR1 , подобно генам FGFR2-4, обычно активируется при раке человека в результате их дупликации , слияния с другими генами и точечной мутации ; поэтому их классифицируют как протоонкогены . [ 9 ]
Белок
[ редактировать ]Рецептор
[ редактировать ]FGFR1 является членом семейства рецепторов фактора роста фибробластов (FGFR), которое помимо FGFR1 включает FGFR2, FGFR3, FGFR4 и FGFRL1. FGFR1-4 представляют собой рецепторы клеточной поверхности , обладающие тирозинкиназной активностью. Полноразмерный представитель этих четырех рецепторов состоит из внеклеточной области, состоящей из трех иммуноглобулиноподобных доменов, которые связывают свои собственные лиганды , факторов роста фибробластов (FGF), одного гидрофобного участка, который проходит через поверхностную мембрану клетки, и цитоплазматического участка. тирозинкиназный домен. При связывании с FGF эти рецепторы образуют димеры с любым из четырех других FGFR, а затем перекрестно фосфорилируют ключевые тирозиновые остатки на своих партнерских димерах. Эти новые фосфорилированные сайты связывают цитозольные стыковочные белки, такие как FRS2 , PRKCG и GRB2, которые активируют клеточные сигнальные пути, которые приводят к клеточной дифференцировке , росту, пролиферации, длительному выживанию, миграции и другим функциям. У FGFRL1 отсутствует выраженный внутриклеточный домен и тирозинкиназная активность; он может служить рецептором-ловушкой, связываясь с FGF и тем самым ослабляя его действие. [ 9 ] [ 10 ] Существует 18 известных FGF, которые связываются с одним или несколькими FGFR и активируют их: от FGF1 до FGF10 и от FGF16 до FGF23. Четырнадцать из них, от FGF1 до FGF6, FGF8, FGF10, FGF17 и от FGF19 до FGF23, связываются и активируют FGFR1. [ 11 ] Связыванию FGF с FGFR1 способствует их взаимодействие с гепарансульфатными протеогликанами клеточной поверхности и, в отношении FGF19, FGF20 и FGR23, с трансмембранным белком Klotho . [ 11 ]
Активация клеток
[ редактировать ]FGFR1, когда он связан с соответствующим FGF, вызывает клеточные реакции путем активации сигнальных путей, которые включают: а) фосфолипазу C / PI3K/AKT , b) подсемейство Ras / ERK , c) протеинкиназу C , d) IP3-индуцированное повышение уровня цитозоля. Калифорния 2+ , и д) Ca 2+ / кальмодулин -активируемые элементы и пути. Точные пути и активируемые элементы зависят от типа стимулируемых клеток, а также от других факторов, таких как микроокружение стимулируемых клеток и предыдущая, а также одновременная история стимуляции. [ 9 ] [ 10 ]

Активация гамма-изоформ фосфолипазы C (PLCγ) (см. PLCG1 и PLCG2 иллюстрирует один механизм, с помощью которого FGFR1 активирует пути клеточной стимуляции. После связывания с собственным FGF и последующего спаривания с другим FGFR FGFR1 фосфорилируется своим партнером FGFR на высококонсервативный остаток тирозина (Y766) на его С-конце. Это создает связывание или. сайт «стыковки» для рекрутирования PLCγ через тандемные домены nSH2 и cSH2 PLCγ , а затем фосфорилирования PLCγ. При фосфорилировании PLCγ освобождается от своей структуры автоингибирования и становится активным в метаболизации близлежащего фосфатидилинозитол-4,5-бисфосфата (PIP2) до двух вторичных мессенджеров. , инозитол-1,4,5-трифосфат (IP3) и диациглицерин (DAG). Эти вторичные мессенджеры мобилизуют другие агенты, передающие сигналы клеткам, и агенты, активирующие клетки: IP3 повышает уровень цитозольного кальция. 2+ и, следовательно, различные Ca 2+ -чувствительные элементы, тогда как ДАГ активирует различные протеинкиназы С. изоформы [ 11 ]
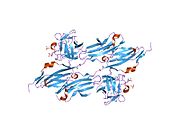
Недавняя публикация о кристаллической структуре PLCγ размером 2,5 Å в комплексе с киназой FGFR1 (PDB: 3GQI) дает новое понимание молекулярного механизма рекрутирования FGFR1 PLCγ с помощью его доменов SH2. На рисунке 1 справа показан киназный комплекс PLCγ-FGFR1 с доменом c-SH2, окрашенным в красный цвет, доменом n-SH2, окрашенным в синий цвет, и междоменным линкером, окрашенным в желтый цвет. Структура содержит типичный домен SH2 с двумя α-спиралями и тремя антипараллельными β-цепями в каждом домене SH2. В этом комплексе фосфорилированный тирозин (pY766) на С-концевом хвосте киназы FGFR1 преимущественно связывается с доменом nSH2 PLCγ. Фосфорилирование остатка тирозина 766 на киназы FGFR1 образует водородные связи с n-SH2 для стабилизации комплекса. Водородные связи в кармане связывания помогают стабилизировать киназный комплекс PLCγ-FGFR1. Молекула воды, как показано, опосредует взаимодействие аспарагина 647 (N647) и аспартата 768 (D768) для дальнейшего увеличения аффинности связывания киназного комплекса n-SH2 и FGFR1. (рис. 2). Фосфорилирование тирозина 653 и тирозина 654 в конформации активной киназы вызывает значительные конформационные изменения в сегменте активации киназы FGFR1. Треонин 658 перемещается на 24 Å из неактивной формы (рис. 3) в активированную форму киназы FGFR1 (рис. 4). Движение заставляет закрытую конформацию в неактивной форме открываться, обеспечивая связывание субстрата. Это также позволяет открытой конформации координировать Mg2+ с AMP-PCP (аналог АТФ). Кроме того, pY653 и pY654 в активной форме помогают поддерживать открытую конформацию киназного комплекса SH2 и FGFR1. Однако механизм, с помощью которого фосфорилирование Y653 и Y654 помогает рекрутировать домен SH2 в его C-концевой хвост при фосфорилировании Y766, остается неясным. На рисунке 5 показана наложенная структура активной и неактивной форм киназы FGFR1. На рис. 6 показаны точки и контакты на фосфорилированных остатках тирозина 653 и 654. Зеленые точки показывают весьма благоприятные контакты между pY653 и pY654 с окружающими остатками. Красные шипы показывают неблагоприятные контакты в сегменте активации. Рисунок генерируется с помощью расширения Molprobity для Pymol.

Тирозинкиназная область FGFR1 связывается с доменом N-SH2 PLCγ преимущественно через заряженные аминокислоты. Остаток аргинина (R609) в домене N-SH2 образует солевой мостик с аспартатом 755 (D755) в домене FGFR1. Пары кислотных оснований, расположенные в середине границы раздела, почти параллельны друг другу, что указывает на весьма благоприятное взаимодействие. Домен N-SH2 образует дополнительный полярный контакт посредством опосредованного водой взаимодействия, которое происходит между доменом N-SH2 и киназной областью FGFR1. Остаток аргинина 609 (R609) киназы FGFR1 также образует солевой мостик с остатком аспартата (D594) в домене N-SH2. Кислотно-основные пары взаимодействуя друг с другом осуществляют реакцию восстановления-окисления , стабилизирующую комплекс (рис. 7). Предыдущие исследования были проведены для выяснения аффинности связывания домена n-SH2 с киназным комплексом FGFR1 путем мутации этих аминокислот фенилаланина или валина. Результаты изотермической титровальной калориметрии показали, что аффинность связывания комплекса снизилась в 3–6 раз, не затрагивая фосфорилирование тирозиновых остатков. [ 12 ]
Ингибирование клеток
[ редактировать ]FGF-индуцированная активация FGFR1 также стимулирует активацию ростковых белков SPRY1 , SPRY2 , SPRY3 и/или SPRY4, которые, в свою очередь, взаимодействуют с GRB2, SOS1 и/или c-Raf, чтобы уменьшить или ингибировать дальнейшую стимуляцию клеток активированным FGFR1. как и другие тирозинкиназные рецепторы, такие как рецептор эпидермального фактора роста . Эти взаимодействия служат петлями отрицательной обратной связи, ограничивая степень клеточной активации. [ 11 ]
Функция
[ редактировать ]Мыши, генетически модифицированные без функционального гена Fgfr1 ( ортолога человеческого гена FGFR1 ), умирают внутриутробно до 10,5 дней беременности. Эмбрионы обнаруживают значительные недостатки в развитии и организации тканей мезодермального происхождения и скелетно-мышечной системы . Ген Fgfr1 имеет решающее значение для усечения эмбриональных структур и формирования мышечной и костной тканей и, следовательно, для нормального формирования конечностей, черепа, наружного, среднего и внутреннего уха, нервной трубки , хвоста и нижней части позвоночника, а также нормального слуха. [ 11 ] [ 13 ] [ 14 ]
Клиническое значение
[ редактировать ]Врожденные заболевания
[ редактировать ]Наследственные мутации гена FGFR1 связаны с различными врожденными пороками развития опорно-двигательного аппарата . Интерстициальные делеции хромосомы 8p12-p11 человека, аргинин до стоп- нонсенс-мутации в аминокислоте 622 FGFR1 (обозначенной как R622X) и многочисленные другие аутосомно-доминантные инактивирующие мутации в FGFR1 ответственны за ~ 10% случаев синдрома Каллмана . Этот синдром представляет собой форму гипогонадотропного гипогонадизма, связанного в разном проценте случаев с аносмией или гипосмией ; расщелина неба и другие черепно-лицевые дефекты; сколиоз и другие пороки развития опорно-двигательного аппарата . Активирующая мутация в FGFR1, а именно P232R (замена пролина на аргинин в 232-й аминокислоте белка), ответственна за тип 1 или классическую форму синдрома Пфайффера, заболевания, характеризующегося краниосиностозом и деформациями средней части лица. Мутация замены тирозина на цистеин в 372-й аминокислоте FGFR1 (Y372C) ответственна за некоторые случаи остеоглофонической дисплазии. Эта мутация приводит к краниосиностоз , прогнатизм нижней челюсти , гипертелоризм , брахидактилия и спондилодез межфаланговых суставов. Другие наследственные дефекты, связанные с мутациями FGFR1 , также включают пороки развития скелетно-мышечной системы: к ним относятся синдром Джексона-Вейсса (замена пролина на arg в аминокислоте 252), синдром Антли-Бикслера (изолейцин на треонин в аминокислоте 300 (I300T) и Тригоноцефалия (мутация такая же, как и при синдроме Антли-Бикслера, а именно, И300Т). [ 10 ] [ 11 ] [ 15 ]
Рак
[ редактировать ]Соматические мутации и эпигенетические изменения в экспрессии гена FGFR1 происходят и, как полагают, способствуют развитию различных типов рака легких, молочной железы, гематологических и других типов рака.
Рак легких
[ редактировать ]Амплификация гена FGFR1 (четыре и более копий) присутствует у 9–22% пациентов с немелкоклеточным раком легких (НМРЛ). Амплификация FGFR1 тесно коррелировала с историей курения табака и оказалась единственным крупнейшим прогностическим фактором в когорте пациентов, страдающих этим заболеванием. Около 1% пациентов с другими типами рака легких обнаруживают усиление FGFR1. [ 9 ] [ 10 ] [ 16 ] [ 17 ]
Рак молочной железы
[ редактировать ]Амплификация FGFR1 также происходит примерно в 10% случаев рака молочной железы с положительным рецептором эстрогена , особенно при подтипа B. люминальной форме рака молочной железы Наличие амплификации FGFR1 коррелирует с резистентностью к терапии, блокирующей гормоны , и считается плохим прогностическим фактором заболевания. [ 9 ] [ 10 ]
Гематологические раковые заболевания
[ редактировать ]При некоторых редких гематологических раковых заболеваниях слияние FGFR1 приводит к образованию генов , с различными другими генами вследствие хромосомных транслокаций или интерстициальных делеций которые кодируют химерные слитые белки FGFR1 . Эти белки имеют постоянно активную тирозинкиназу , производную от FGFR1 , и тем самым постоянно стимулируют рост и пролиферацию клеток. Эти мутации возникают на ранних стадиях миелоидных и/или лимфоидных клеточных линий и являются причиной или способствуют развитию и прогрессированию определенных типов гематологических злокачественных новообразований , которые характеризуются увеличением количества циркулирующих эозинофилов в крови , увеличением количества эозинофилов в костном мозге и /или инфильтрация эозинофилов в ткани. Эти новообразования первоначально рассматривались как эозинофилии , гиперэозинофилии , миелолейкозы , миелопролиферативные новообразования , миелоидные саркомы , лимфоидные лейкозы или неходжкинские лимфомы . На основании их связи с эозинофилами, уникальными генетическими мутациями и известной или потенциальной чувствительностью к ингибитору тирозинкиназы. терапии, теперь их классифицируют вместе как клональные эозинофилии . [ 6 ] Эти мутации описываются путем соединения хромосомного участка гена FGFR1 , 8p11 (т.е. короткого плеча 8-й хромосомы человека [т.е. p] в положении 11) с другим геном, таким как MYO18A , сайт которого представляет собой 17q11 (т.е. длинное плечо 17-й хромосомы человека [т.е. q] в положении 11) с получением слитого гена, обозначенного как t(8;17)(p11;q11). Эти мутации FGFR1 вместе с хромосомным расположением FGFR1A гена- партнера и аннотацией слитого гена приведены в следующей таблице. [ 18 ] [ 19 ] [ 20 ]
| Ген | локус | обозначение | ген | локус | обозначение | Ген | локус | обозначение | ген | локус | обозначение | ген | локус | обозначение | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| МИО18А | 17q11 | т(8;17)(p11;q11) | CPSF6 | 12q15 | т(8;12)(p11;q15) | ТПР | 1q25 | t(1;8)(q25p11;; | ГЕРВ-К | 10q13 | т(8;13)(p11-q13) | ФГФР1ОП2 | 12п11 | т(8;12)(p11;q12) | ||||
| ЗМИМ2 | 13q12 | т(8;13)(p11;q12) | CUTL1 | 7q22 | t(7;8)(q22;p11) | SQSTM1 | 5q35 | t(5;8)(q35;p11 | РАНБП2 | 2q13 | т(2;8)(q13;p11) | ЛРРФИП1 | 2q37 | т(8;2)(p11;q37) | ||||
| ЦНТРЛ | 9q33 | т(8;9)(p11;q33) | ФГФР1ОП | 6q27 | t(6;8)(q27;p11) | БЦР | 22q11 | t(8;22)(p11;q11 | НУП98 | 11п15 | т(8;11)(р11-р15) | МИСТ3 | 8п11.21 | несколько [ 21 ] | ||||
| CEP110 | 16п12 | т(8;16)(р11;р12) |
Эти виды рака иногда называют 8p11 миелопролиферативными синдромами на основании хромосомного расположения гена FGFR1 . Транслокации с участием ZMYM2 , CNTRL и FGFR1OP2 являются наиболее распространенными формами синдромов 8p11. В целом средний возраст пациентов с любым из этих заболеваний составляет 44 года, у них наблюдается утомляемость, ночная потливость , потеря веса, лихорадка, лимфаденопатия и увеличение печени и/или селезенки. Обычно они свидетельствуют о гематологических признаках миелопролиферативного синдрома с умеренным или значительно повышенным уровнем эозинофилов в крови и костном мозге. Однако пациенты, несущие: а) ZMYM2-FGFR1, слитые гены часто проявляются как Т-клеточные лимфомы с распространением на нелимфоидную ткань; б) FGFR1-BCR слитые гены обычно присутствуют при хронических миелогенных лейкозах ; в) слитые гены CEP110 могут проявляться как хронический миеломоноцитарный лейкоз с поражением миндалин; и d) FGFR1-BCR или FGFR1-MYST3 слитые гены часто присутствуют с небольшой эозинофилией или без нее. Для диагностики требуется традиционная цитогенетика. использование situ#Вариации зондов и анализ FGFR1 флуоресцентной гибридизации in . [ 19 ] [ 21 ]
В отличие от многих других миелоидных новообразований с эозинофилами, например, вызванных слитыми генами рецептора тромбоцитарного фактора роста A или слитыми генами рецептора B тромбоцитарного фактора роста , синдромы миелодисплазии, вызванные слитыми генами FGFR 1, в целом не реагируют на ингибиторы тирозинкиназы . агрессивный и быстро прогрессирующий, требующий лечения химиотерапевтическими препаратами с последующей трансплантацией костного мозга для улучшения выживаемости. [ 19 ] [ 18 ] Ингибитор тирозинкиназы понатиниб использовался в качестве монотерапии, а затем использовался в сочетании с интенсивной химиотерапией для лечения миелодисплазии, вызванной слитым геном FGFR1-BCR . [ 19 ]
Фосфатурическая мезенхимальная опухоль
[ редактировать ]Фосфатурические мезенхимальные опухоли характеризуются гиперваскулярной пролиферацией явно незлокачественных веретенообразных клеток, связанных с переменным количеством «мутного» кальцинированного матрикса, но небольшая часть этих опухолей демонстрирует злокачественные гистологические особенности и может вести себя клинически злокачественно. Из 15 пациентов с этим заболеванием у 9 были обнаружены опухоли, несущие слияния гена FGFR1 и гена FN1 , расположенного на хромосоме 2 человека в положении q35. [ 22 ] Слитый ген FGFR1 -FN1 был снова идентифицирован у 16 из 39 (41%) пациентов с фосфатурическими мезенхимальными опухолями. [ 23 ] Роль слитого гена (2;8)(35;11) FGFR1-FN1 в этом заболевании неизвестна.
Рабдомиосаркома
[ редактировать ]Повышенная экспрессия белка FGFR1 была обнаружена в 10 из 10 опухолей рабдомиосаркомы человека и в 4 из 4 клеточных линий человека, полученных из рабдомиокаркомы. Случаи опухолей включали 6 случаев альвеолярной рабдомиосаркомы , 2 случая эмбриональной рабдомиосаркомы и 2 случая плеоморфной рабдомиосаркомы . Рабдомиосаркома — это высокозлокачественная форма рака, которая развивается из незрелых предшественников клеток скелетных мышц, а именно миобластов , которые не смогли полностью дифференцироваться . Активация FGFR1 вызывает пролиферацию миобластов, одновременно ингибируя их дифференцировку, - двойной эффект, который может привести к предположению о злокачественном фенотипе этих клеток. В 10 опухолях рабдомиосаркомы человека наблюдалось снижение уровня метилирования CpG-островков выше первого экзона FGFR1 . Островки CpG обычно подавляют экспрессию соседних генов, в то время как их метилирование ингибирует это подавление. Предполагается, что гипометилирование CpG-островков выше FGFR1 по крайней мере частично ответственно за сверхэкспрессию FGFR1 и злокачественное поведение этих рабдомиосаркомных опухолей. [ 24 ] Кроме того, в одном случае опухоли рабдомиосаркомы была обнаружена экспрессия коамплифицированного гена FOXO1 в 13q14 и гена FGFR1 в 8p11, т.е. t(8;13)(p11;q14), что указывает на образование, амплификацию и злокачественную активность химерного Слитый ген FOXO1-FGFR1 этой опухоли. [ 9 ] [ 25 ]
Другие виды рака
[ редактировать ]Приобретенные аномалии, если ген FGFR1 обнаружен в: ~ 14% случаев переходно-клеточного рака мочевого пузыря (почти все являются амплификациями); ~10% плоскоклеточного рака головы и шеи (~80% амплификации, 20% других мутаций); ~7% случаев рака эндометрия (половина с амплификациями, половина с другими типами мутаций); ~6% случаев рака простаты (половина амплификации, половина – другие мутации); ~5% папиллярной серозной цистаденокарциномы яичника (почти все амплификации); ~5% колоректального рака (~60 амплификаций, 40% других мутаций); ~4% сарком (в основном амплификации); <3% глиобластом (слияние генов FGFR1 и TACC1 (8p11)); <3% рака слюнной железы (все усиления); и <2% при некоторых других видах рака. [ 11 ] [ 26 ] [ 27 ]
Ингибиторы ФРФР
[ редактировать ]Препараты, нацеленные на FGFR, оказывают как прямое, так и непрямое противораковое действие благодаря тому, что FGFR на раковых клетках и эндотелиальных клетках участвуют в онкогенезе и васкулогенезе соответственно. [ 9 ] Терапия FGFR активна, поскольку FGF влияет на многочисленные характеристики рака, такие как инвазивность , стволовость и выживаемость клеток . Основными среди таких препаратов являются антагонисты. Небольшие молекулы, которые помещаются между АТФ-связывающими карманами тирозинкиназных доменов рецепторов. Для FGFR1 было одобрено множество таких небольших молекул для воздействия на АТФ-карман TKI. К ним относятся довитиниб и бриваниб . В таблице ниже представлены IC50 (наномолярные) низкомолекулярных соединений, нацеленных на FGFR. [ 9 ]
| PD173074 | Довитиниб | Ки23057 | Ленватиниб | Бриваниб | Нинтеданиб | Понатиниб | МК-2461 | Лючитаниб | AZD4547 |
|---|---|---|---|---|---|---|---|---|---|
| 26 | 8 | ЧТО | 46 | 148 | 69 | 2.2 | 65 | 18 | 0.2 |
Мутация FGFR1 при раке молочной железы и легких в результате генетической чрезмерной амплификации эффективно воздействует на довитиниб и понатиниб соответственно. [ 28 ] Лекарственная устойчивость является весьма актуальной темой в области разработки лекарств для целей FGFR. Ингибиторы FGFR позволяют повысить чувствительность опухоли к цитотоксическим противораковым препаратам, таким как паклитаксел и этопозид, в раковых клетках человека, тем самым снижая антиапоптотический потенциал, основанный на неправильной активации FGFR. [ 9 ] Поскольку ингибирование передачи сигналов FGF резко снижает реваскуляризацию, оно препятствует одному из признаков рака — ангиогенезу . Он также снижает опухолевую нагрузку в опухолях человека, которые зависят от аутокринной передачи сигналов FGF, на основе повышения регуляции FGF2 после обычной терапии VEGFR-2 при раке молочной железы. Таким образом, FGFR1 может действовать синергически с терапией, предотвращая возобновление клонального рака, устраняя потенциальные пути будущего рецидива. Более того, ингибирование передачи сигналов FGF резко снижает реваскуляризацию. [ 29 ] [ 30 ]
Было предсказано, что ингибиторы FGFR будут эффективны при рецидивирующих опухолях из-за клональной эволюции меньшей субпопуляции, активированной FGFR, после терапии, нацеленной на EGFR или VEGFR. Поскольку существует множество механизмов действия ингибиторов FGFR для преодоления лекарственной устойчивости рака человека, терапия, нацеленная на FGFR, может быть многообещающей стратегией лечения рефрактерного рака. [ 31 ]
AZD4547 прошел II фазу клинических испытаний при раке желудка и сообщил о некоторых результатах. [ 32 ]
Лютаниб является ингибитором FGFR1 и FGFR2 и прошел клинические испытания при лечении солидных опухолей на поздних стадиях. [ 33 ]
Довитиниб (TKI258), ингибитор FGFR1, FGFR2 и FGFR3 , прошел клинические испытания на раке молочной железы, усиленном FGFR. [ 28 ]
Взаимодействия
[ редактировать ]Было показано, что рецептор 1 фактора роста фибробластов взаимодействует с:
См. также
[ редактировать ]Ссылки
[ редактировать ]- ^ Jump up to: а б с GRCh38: Ensembl, выпуск 89: ENSG00000077782 – Ensembl , май 2017 г.
- ^ Jump up to: а б с GRCm38: выпуск Ensembl 89: ENSMUSG00000031565 – Ensembl , май 2017 г.
- ^ «Ссылка на Human PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Ито Н., Терачи Т., Охта М., Со МК (июнь 1990 г.). «Полная аминокислотная последовательность более короткой формы рецептора основного фактора роста фибробластов человека, выведенная из его кДНК». Связь с биохимическими и биофизическими исследованиями . 169 (2): 680–685. дои : 10.1016/0006-291X(90)90384-Y . ПМИД 2162671 .
- ^ Jump up to: а б Готлиб Дж. (ноябрь 2015 г.). «Эозинофильные расстройства, определенные Всемирной организацией здравоохранения: обновленная информация о диагностике, стратификации риска и лечении за 2015 год» . Американский журнал гематологии . 90 (11): 1077–1089. дои : 10.1002/ajh.24196 . ПМИД 26486351 . S2CID 42668440 .
- ^ «Рецептор 1 фактора роста фибробластов FGFR1 [Homo sapiens (человек)] - Ген - NCBI» .
- ^ Гонсалвеш С., Бастос М., Пиньятелли Д., Борхес Т., Арагюэс Х.М., Фонсека Ф. и др. (ноябрь 2015 г.). «Новые мутации FGFR1 при синдроме Каллмана и нормосмическом идиопатическом гипогонадотропном гипогонадизме: доказательства участия альтернативно сплайсированной изоформы» . Фертильность и бесплодие . 104 (5): 1261–7.e1. doi : 10.1016/j.fertnstert.2015.07.1142 . hdl : 10400.17/2465 . ПМИД 26277103 .
- ^ Jump up to: а б с д и ж г час я Като М., Накагама Х. (март 2014 г.). «Рецепторы FGF: биология и терапия рака». Обзоры медицинских исследований . 34 (2): 280–300. дои : 10.1002/мед.21288 . ПМИД 23696246 . S2CID 27412585 .
- ^ Jump up to: а б с д и Келлехер, О'Салливан Х, Смит Э, Макдермотт Р, Витербо А (октябрь 2013 г.). «Рецепторы фактора роста фибробластов, нарушения развития и злокачественные заболевания» . Канцерогенез . 34 (10): 2198–2205. дои : 10.1093/carcin/bgt254 . ПМИД 23880303 .
- ^ Jump up to: а б с д и ж г Хелстен Т., Швадерле М., Курцрок Р. (сентябрь 2015 г.). «Передача сигналов рецептора фактора роста фибробластов при наследственных и неопластических заболеваниях: биологические и клинические последствия» . Обзоры рака и метастазов . 34 (3): 479–496. дои : 10.1007/s10555-015-9579-8 . ПМЦ 4573649 . ПМИД 26224133 .
- ^ Бэ Дж.Х., Лью Э.Д., Юзава С., Томе Ф., Лакс И., Шлессинджер Дж. (август 2009 г.). «Избирательность передачи сигналов тирозинкиназы рецептора контролируется вторичным сайтом связывания домена SH2» . Клетка . 138 (3): 514–524. дои : 10.1016/j.cell.2009.05.028 . ПМК 4764080 . ПМИД 19665973 .
- ^ Дэн С., Бедфорд М., Ли С., Сюй X, Ян X, Данмор Дж., Ледер П. (май 1997 г.). «Рецептор фактора роста фибробластов-1 (FGFR-1) необходим для нормального развития нервной трубки и конечностей» . Биология развития . 185 (1): 42–54. дои : 10.1006/dbio.1997.8553 . ПМИД 9169049 .
- ^ Калверт Дж.А., Дедос С.Г., Хоукер К., Флеминг М., Льюис М.А., Стил К.П. (июнь 2011 г.). «Миссенс-мутация Fgfr1 вызывает дефекты ушей и черепа у мышей-щенков» . Геном млекопитающих . 22 (5–6): 290–305. дои : 10.1007/s00335-011-9324-8 . ПМК 3099004 . ПМИД 21479780 .
- ^ «Запись OMIM - * 136350 - РЕЦЕПТОР ФАКТОРА РОСТА ФИБРОБЛАСТОВ 1; FGFR1» .
- ^ «Изменения FGFR1» . Архивировано из оригинала 27 апреля 2015 г. Проверено 21 апреля 2015 г. [ нужна полная цитата ]
- ^ Ким Х.Р., Ким Д.Д., Кан Д.Р., Ли Дж.Г., Лим С.М., Ли С.И. и др. (февраль 2013 г.). «Амплификация гена рецептора 1 фактора роста фибробластов связана с плохой выживаемостью и дозировкой курения у пациентов с резецированным плоскоклеточным раком легких». Журнал клинической онкологии . 31 (6): 731–737. дои : 10.1200/JCO.2012.43.8622 . ПМИД 23182986 .
- ^ Jump up to: а б Вега Ф, Медейрос Л.Дж., Буэсо-Рамос С.Э., Арболеда П., Миранда Р.Н. (сентябрь 2015 г.). «Гематолимфоидные новообразования, связанные с перестройками PDGFRA, PDGFRB и FGFR1» . Американский журнал клинической патологии . 144 (3): 377–392. дои : 10.1309/AJCPMORR5Z2IKCEM . ПМИД 26276769 . S2CID 10435391 .
- ^ Jump up to: а б с д Рейтер А., Готлиб Дж. (февраль 2017 г.). «Миелоидные новообразования с эозинофилией» . Кровь . 129 (6): 704–714. дои : 10.1182/blood-2016-10-695973 . ПМИД 28028030 .
- ^ Аппиа-Куби К., Лан Т., Ван Й., Цянь Х., Ву М., Яо Х. и др. (январь 2017 г.). «Участие слитых генов рецепторов фактора роста тромбоцитов (PDGFR) в гематологических злокачественных новообразованиях». Критические обзоры по онкологии/гематологии . 109 : 20–34. дои : 10.1016/j.critrevonc.2016.11.008 . ПМИД 28010895 .
- ^ Jump up to: а б Патнаик М.М., Гангат Н., Кнудсон Р.А., Киф Дж.Г., Хансон К.А., Парданани А. и др. (апрель 2010 г.). «Транлокации хромосомы 8p11.2: распространенность, FISH-анализ на FGFR1 и MYST3, а также клинико-патологические корреляты в последовательной когорте из 13 случаев из одного учреждения» . Американский журнал гематологии . 85 (4): 238–242. дои : 10.1002/ajh.21631 . ПМИД 20143402 . S2CID 5256456 .
- ^ Lee JC, Jeng YM, Su SY, Wu CT, Tsai KS, Lee CH и др. (март 2015 г.). «Идентификация нового генетического слияния FN1-FGFR1 как частого явления при фосфатурической мезенхимальной опухоли». Журнал патологии . 235 (4): 539–545. дои : 10.1002/путь.4465 . ПМИД 25319834 . S2CID 9887919 .
- ^ Ли Дж.К., Су С.Ю., Чангоу К.А., Ян Р.С., Цай К.С., Коллинз М.Т. и др. (ноябрь 2016 г.). «Характеристика FN1-FGFR1 и новых слитых генов FN1-FGF1 в большой серии фосфатурических мезенхимальных опухолей» . Современная патология . 29 (11): 1335–1346. дои : 10.1038/modpathol.2016.137 . ПМИД 27443518 .
- ^ Гольдштейн М., Меллер И., Орр-Уртрегер А. (ноябрь 2007 г.). «Сверхэкспрессия FGFR1 в первичных опухолях рабдомиосаркомы связана с гипометилированием 5'-островка CpG и аномальной экспрессией генов AKT1, NOG и BMP4». Гены, хромосомы и рак . 46 (11): 1028–1038. дои : 10.1002/gcc.20489 . ПМИД 17696196 . S2CID 8865648 .
- ^ Лю Дж., Гузман М.А., Пезановски Д., Патель Д., Хауптман Дж., Кейслинг М. и др. (октябрь 2011 г.). «Слияние и амплификация FOXO1-FGFR1 при солидном варианте альвеолярной рабдомиосаркомы» . Современная патология . 24 (10): 1327–1335. дои : 10.1038/modpathol.2011.98 . ПМИД 21666686 .
- ^ Сингх Д., Чан Дж.М., Зопполи П., Ниола Ф., Салливан Р., Кастано А. и др. (сентябрь 2012 г.). «Трансформация слияний генов FGFR и TACC в глиобластоме человека» . Наука . 337 (6099): 1231–1235. Бибкод : 2012Sci...337.1231S . дои : 10.1126/science.1220834 . ПМЦ 3677224 . ПМИД 22837387 .
- ^ Ач Т., Шварц-Фурлан С., Ах С., Агайми А., Геркен М., Рормайер С. и др. (август 2016 г.). «Геномные аберрации MDM2, MDM4, FGFR1 и FGFR3 связаны с плохим исходом у пациентов с раком слюнной железы» . Журнал патологии полости рта и медицины . 45 (7): 500–509. дои : 10.1111/jop.12394 . ПМИД 26661925 .
- ^ Jump up to: а б Андре Ф., Бачело Т., Кампоне М., Даленк Ф., Перес-Гарсия Х.М., Хурвиц С.А. и др. (июль 2013 г.). «Нацеливание на FGFR с помощью довитиниба (TKI258): доклинические и клинические данные при раке молочной железы» . Клинические исследования рака . 19 (13): 3693–3702. дои : 10.1158/1078-0432.CCR-13-0190 . ПМИД 23658459 .
- ^ Репетто М., Кримини Э., Джулиано Ф., Морганти С., Белли К., Курильяно Дж. (октябрь 2021 г.). «Селективные ингибиторы пути FGFR/FGF: стратегии ингибирования, клиническая деятельность, мутации устойчивости и будущие направления». Экспертное обозрение клинической фармакологии . 14 (10): 1233–1252. дои : 10.1080/17512433.2021.1947246 . ПМИД 34591728 . S2CID 238231910 .
- ^ Чиони А.М., Гроуз Р.П. (ноябрь 2021 г.). «Биологическое значение и направленность оси FGFR при раке» . Раки . 13 (22): 5681. doi : 10.3390/cancers13225681 . ПМЦ 8616401 . ПМИД 34830836 .
- ^ Асаи Н., Окуни Ю., Канеко Н., Ямагути Э., Кубо А. (март 2014 г.). «Рецидив мелкоклеточного рака легкого: варианты лечения и новейшие разработки» . Терапевтические достижения в медицинской онкологии . 6 (2): 69–82. дои : 10.1177/1758834013517413 . ПМЦ 3932054 . ПМИД 24587832 .
- ^ «Рандомизированное открытое исследование II фазы AZD4547 (AZD) по сравнению с паклитакселом (P) у ранее лечившихся пациентов с распространенным раком желудка (AGC) с полисомией рецептора фактора роста фибробластов 2 (FGFR2) или амплификацией гена (amp): исследование SHINE " . Архивировано из оригинала 24 марта 2016 г. Проверено 7 июля 2016 г.
- ^ Сория Х.К., ДеБро Ф., Бахледа Р., Адамо Б., Андре Ф., Динцманн Р. и др. (ноябрь 2014 г.). «Исследование фазы I/IIa по оценке безопасности, эффективности, фармакокинетики и фармакодинамики люцитаниба при распространенных солидных опухолях» . Анналы онкологии . 25 (11): 2244–2251. дои : 10.1093/annonc/mdu390 . ПМИД 25193991 .
- ^ Шлессингер Дж., Плотников А.Н., Ибрагими О.А., Елисеенкова А.В., Йе Б.К., Яён А. и др. (сентябрь 2000 г.). «Кристаллическая структура тройного комплекса FGF-FGFR-гепарин демонстрирует двойную роль гепарина в связывании и димеризации FGFR» . Молекулярная клетка . 6 (3): 743–750. дои : 10.1016/s1097-2765(00)00073-3 . ПМИД 11030354 .
- ^ Сантос-Окампо С., Колвин Дж.С., Челлайя А., Орниц Д.М. (январь 1996 г.). «Экспрессия и биологическая активность фактора роста фибробластов мыши-9» . Журнал биологической химии . 271 (3): 1726–1731. дои : 10.1074/jbc.271.3.1726 . ПМИД 8576175 .
- ^ Ян К.С., Кути М., Ян С., Муджтаба С., Фарук А., Гольдфарб М.П., Чжоу М.М. (май 2002 г.). «Конформация домена FRS2 PTB регулирует взаимодействие с дивергентными нейротрофическими рецепторами» . Журнал биологической химии . 277 (19): 17088–17094. дои : 10.1074/jbc.M107963200 . ПМИД 11877385 .
- ^ Онг Ш., Гай Г.Р., Хадари Ю.Р., Лакс С., Гото Н., Шлессингер Дж., Лакс И. (февраль 2000 г.). «Белки FRS2 рекрутируют внутриклеточные сигнальные пути путем связывания с различными мишенями на рецепторах фактора роста фибробластов и фактора роста нервов» . Молекулярная и клеточная биология . 20 (3): 979–989. дои : 10.1128/mcb.20.3.979-989.2000 . ПМК 85215 . ПМИД 10629055 .
- ^ Сюй Х, Ли К.В., Гольдфарб М. (июль 1998 г.). «Новый мотив узнавания на рецепторе фактора роста фибробластов опосредует прямую ассоциацию и активацию адаптерных белков SNT» . Журнал биологической химии . 273 (29): 17987–17990. дои : 10.1074/jbc.273.29.17987 . ПМИД 9660748 .
- ^ Дхаллуин Дж., Ян К.С., Плотникова О., Ли К.В., Цзэн Л., Кути М. и др. (октябрь 2000 г.). «Структурная основа взаимодействия домена SNT PTB с различными нейротрофическими рецепторами» . Молекулярная клетка . 6 (4): 921–929. дои : 10.1016/S1097-2765(05)00087-0 . ПМЦ 5155437 . ПМИД 11090629 .
- ^ Уракава И., Ямазаки Ю., Симада Т., Иидзима К., Хасегава Х., Окава К. и др. (декабрь 2006 г.). «Клото преобразует канонический рецептор FGF в специфический рецептор FGF23». Природа . 444 (7120): 770–774. Бибкод : 2006Natur.444..770U . дои : 10.1038/nature05315 . ПМИД 17086194 . S2CID 4387190 .
- ^ Рейли Дж. Ф., Микки Дж., Махер П. А. (март 2000 г.). «Ассоциация рецептора 1 фактора роста фибробластов с адаптерным белком Grb14. Характеристика нового партнера по связыванию рецептора» . Журнал биологической химии . 275 (11): 7771–7778. дои : 10.1074/jbc.275.11.7771 . ПМИД 10713090 .
- ^ Карлссон Т., Сонгян З., Ландгрен Э., Лавернь С., Ди Фиоре П.П., Анафи М. и др. (апрель 1995 г.). «Молекулярные взаимодействия белка Shb 2-го домена гомологии Src с остатками фосфотирозина, рецепторами тирозинкиназы и белками 3-го домена Src-гомологии». Онкоген . 10 (8): 1475–1483. ПМИД 7537362 .
Дальнейшее чтение
[ редактировать ]- Вайс Дж., Сос М.Л., Зайдель Д., Пайфер М., Зандер Т., Хойкманн Дж.М. и др. (декабрь 2010 г.). «Частая и очаговая амплификация FGFR1 связана с терапевтически поддающейся лечению зависимостью от FGFR1 при плоскоклеточном раке легкого» . Наука трансляционной медицины . 2 (62): 62ра93. doi : 10.1126/scitranslmed.3001451 . ПМК 3990281 . ПМИД 21160078 .
- Джонсон Д.Э., Уильямс Л.Т. (1992). Структурное и функциональное разнообразие в мультигенном семействе рецепторов FGF . Достижения в области исследований рака. Том. 60. стр. 1–41. дои : 10.1016/S0065-230X(08)60821-0 . ISBN 978-0-12-006660-5 . ПМИД 8417497 .
- Макдональд Д., Рейтер А., Кросс, Северная Каролина (2002). «Миелопролиферативный синдром 8p11: отдельная клиническая форма, вызванная конститутивной активацией FGFR1». Акта гематологическая . 107 (2): 101–107. дои : 10.1159/000046639 . ПМИД 11919391 . S2CID 9582122 .
- Грот С., Ларделли М. (2002). «Структура и функция рецептора 1 фактора роста фибробластов позвоночных». Международный журнал биологии развития . 46 (4): 393–400. ПМИД 12141425 .
- Уилки А.О. (апрель 2005 г.). «Плохие кости, отсутствие запаха, эгоистичные яички: плейотропные последствия мутаций рецептора FGF человека». Обзоры цитокинов и факторов роста . 16 (2): 187–203. doi : 10.1016/j.cytogfr.2005.03.001 . ПМИД 15863034 .
Внешние ссылки
[ редактировать ]- Запись GeneReviews/NIH/NCBI/UW о синдромах краниосиностоза, связанных с FGFR
- Запись GeneReviews/NCBI/NIH/UW о синдроме Каллмана
- FGFR1+белок+человек Национальной медицинской библиотеки США по медицинским предметным рубрикам (MeSH)
- Рецептор 1 фактора роста фибробластов в Атласе генетики и онкологии
- FGFR1 Расположение человеческого гена в браузере генома UCSC .
- Подробности о гене человека FGFR1 в браузере генома UCSC .
- Обзор всей структурной информации, доступной в PDB для UniProt : P11362 (рецептор 1 фактора роста фибробластов человека) на PDBe-KB .
- Обзор всей структурной информации, доступной в PDB для UniProt : P16092 (рецептор фактора роста фибробластов мыши 1) на PDBe-KB .
Эта статья включает текст из Национальной медицинской библиотеки США , который находится в свободном доступе .