Апоптоз
| Апоптоз | |
|---|---|
 DU145 Обрабоченная этопозидом взрывалась раковая клетка простаты в каскад апоптотических тел. Суб-изображения были извлечены из 61-часовой видеопользовательской микроскопии , созданного с использованием количественной фазовой микроскопии . Оптическая толщина имеет цветовую кодировку. С увеличением толщины цвет меняется от серого на желтый, красного, фиолетового и, наконец, черный. Смотрите видео в ячейке: библиотека изображений | |
| Идентификаторы | |
| Сетка | D017209 |
| Анатомическая терминология | |
Апоптоз от древнегреческого : ἀπόπτωσις , романизированный : апоптозис , горит . ( [ 1 ] Биохимические события приводят к характерным изменениям клеток ( морфология ) и смерти. [ 2 ] Эти изменения включают в себя блеббинг , усадку клеток , ядерную фрагментацию , конденсацию хроматина , фрагментацию ДНК и распад мРНК . Средний взрослый человек теряет от 50 до 70 миллиардов клеток каждый день из -за апоптоза. [ А ] Для среднего ребенка от 8 до 14 лет каждый день приблизительная потеря составляет от 20 до 30 миллиардов клеток. [ 4 ]
В отличие от некроза , который является формой травматической гибели клеток, которая является результатом острого повреждения клеток, апоптоз является высокорегулируемым и контролируемым процессом, который дает преимущества в течение жизненного цикла организма. Например, разделение рук и ног у развивающегося эмбриона человека происходит потому, что клетки между цифрами подвергаются апоптозу. В отличие от некроза, апоптоз вырабатывает фрагменты клеток, называемые апоптотическими телами , которые фагоциты способны поглощать и удалять до того, как содержимое клетки сможет выбросить на окружающие клетки и нанести ущерб им. [ 5 ]
Поскольку апоптоз не может остановиться, как только он начал, это высокорегулируемый процесс. Апоптоз может быть инициирован через один из двух путей. В внутреннем пути клетка убивает себя, потому что ощущает клеточное стресс , в то время как в внешнем пути клетка убивает себя из -за сигналов из других клеток. Слабые внешние сигналы могут также активировать внутренний путь апоптоза. [ 6 ] Оба пути вызывают гибель клеток, активируя каспазы , которые являются протеазами , или ферментов, которые разлагают белки. Два пути оба активируют каспазы инициатора, которые затем активируют каспазы исполнителей, которые затем убивают клетку путем без разбора разлагая белки.
В дополнение к его важности в качестве биологического явления, дефектные апоптотические процессы участвовали в самых разных заболеваниях. Чрезмерный апоптоз вызывает атрофию , тогда как недостаточное количество приводит к неконтролируемой пролиферации клеток, такой как рак . Некоторые факторы, такие как рецепторы Fas и каспазы, способствуют апоптозу, в то время как некоторые члены BCL-2 ингибируют апоптоз. семейства белков [ 7 ]
Открытие и этимология
[ редактировать ]Немецкий ученый Карл Фогт был первым, чтобы описать принцип апоптоза в 1842 году. В 1885 году анатомист Уолтер Флемминг дал более точное описание процесса запрограммированной гибели клеток. Однако только в 1965 году эта тема была воскресена. Во время изучения тканей с использованием электронной микроскопии Джон Керр из Университета Квинсленда смог отличить апоптоз от травматической гибели клеток. [ 8 ] После публикации статьи, описывающей это явление, Керр был приглашен присоединиться к Аластеру Керри , а также Эндрю Уилли , который был аспирантом Керри. [ 9 ] в университете Абердина . В 1972 году трио опубликовало оригинальную статью в Британском журнале рака . [ 10 ] Керр первоначально использовал термин запрограммированный некроз клеток, но в статье процесс природной гибели клеток назывался апоптоз . Керр, Уайлли и Керри приписывали Джеймса Кормаку, профессору греческого языка в Университете Абердина, и предположил термин апоптоз. Керр получил премию Пола Эрлиха и Людвига Дармштадтера 14 марта 2000 года за его описание апоптоза. Он поделился призом с Бостонским биологом Х. Робертом Хорвицем . [ 11 ]
В течение многих лет ни «апоптоз», ни «запрограммированная гибель клеток» не были высоко цитируемым термином. Два открытия привели к гибели клеток от безвестности в основную область исследований: выявление первого компонента контроля гибели клеток и эффекторных механизмов, а также связь аномалий в гибели клеток с заболеванием человека, в частности, раком. Это произошло в 1988 году, когда было показано, что BCL2, ген, ответственный за фолликулярную лимфому, кодировал белок, который ингибировал гибель клеток. [ 12 ]
Нобелевская премия в 2002 году в области медицины была награждена Сидни Бреннером , Х. Робертом Хорвицам и Джону Сулстону за их работу, идентифицирующие гены, которые контролируют апоптоз. Гены были идентифицированы путем исследований в нематоде C. elegans и гомологи этих генов функционируют у людей для регулирования апоптоза.

На греческом языке апоптоз переводится на «падение» листьев с дерева. [ 13 ] Кормак, профессор греческого языка, вновь ввел термин для медицинского использования, поскольку он имел медицинское значение для греков более двух тысяч лет назад. Гиппократ использовал этот термин для «падения с костей». Гален расширил свое значение на «падение струпье». Кормак, без сомнения, знал об этом использовании, когда предложил имя. произношением типа вторым со , , по разделенным с Дебаты мнением произношения продолжаются правильного поводу между [ 14 ] [ 15 ] ) и второй p произносится ( / eɪ p ə p ˈ t oʊ s ɪ s / ). [ 14 ] [ 16 ] На английском языке P из греческого -пт -согласного кластера , как правило, тихо в начале слова (например, птеродактил , птолемей ), но сформулирован при использовании при сочетании форм, которым предшествует гласный, как в вертолете или приказах насекомых: Diptera , Lepidoptera и т. Д.
В оригинальном Paper, Wyllie & Currie Paper, [ 10 ] есть сноска в отношении произношения:
Мы наиболее благодарны профессору Джеймсу Кормаку из кафедры греческого университета Абердина, за предложение этого срока. Слово «апоптоз» ( ἀπόπτωσις ) используется на греческом языке, чтобы описать «отбросы» или «падение» лепестков из цветов или листьев из деревьев. Чтобы ясно показать вывод, мы предполагаем, что стресс должен быть в предпоследнем слоге, вторая половина слова произносится как «птоз» (с «p» безмолвным), который исходит от того же корня «падать», », и уже используется для описания опадения верхнего века.
Механизмы активации
[ редактировать ]

Инициирование апоптоза жестко регулируется механизмами активации, поскольку после начала апоптоза он неизбежно приводит к гибели клетки. [ 17 ] [ 2 ] Двумя наиболее понятными механизмами активации являются внутренний путь (также называемый митохондриальным путем) и внешний путь. [ 18 ] Внутренний путь активируется внутриклеточными сигналами, генерируемыми, когда клетки напряжены и зависит от высвобождения белков из межмембранного пространства митохондрий. [ 19 ] Внешний путь активируется внеклеточными лигандами, связывающими рецепторы смерти клеточной поверхности, что приводит к образованию сигнального комплекса, вызывающего смерть (DISC). [ 20 ]
Клетка инициирует внутриклеточную апоптотическую передачу сигналов в ответ на стресс, [ 21 ] что может привести к самоубийству клеток. Связывание ядерных рецепторов глюкокортикоидами , [ 22 ] нагревать, [ 22 ] радиация [ 22 ] лишение питательных веществ, [ 22 ] вирусная инфекция, [ 22 ] гипоксия , [ 22 ] Повышенная внутриклеточная концентрация свободных жирных кислот [ 23 ] и повышенная внутриклеточная кальция , концентрация [ 24 ] [ 25 ] Например, путем повреждения мембраны, все могут вызвать высвобождение внутриклеточных апоптотических сигналов поврежденной ячейкой. Ряд клеточных компонентов, таких как политимераза рибозы Poly ADP , также может помочь регулировать апоптоз. [ 26 ] Одноклеточные колебания наблюдались в экспериментальных исследованиях стресса, вызванного апоптозом. [ 27 ] [ 28 ]
До того, как фактический процесс гибели клеток осаждается ферментами, апоптотические сигналы должны вызывать регуляторные белки для инициирования пути апоптоза. Этот шаг позволяет этим сигналам вызывать гибель клеток или процесс, который должен быть остановлен, если ячейка больше не нужно умирать. Участвуют несколько белков, но были идентифицированы два основных метода регуляции: нацеливание функциональности митохондрий , [ 29 ] или непосредственно преобразование сигнала через адаптерные белки в апоптотические механизмы. Внешним путем для инициации, выявленного в нескольких исследованиях токсина, является увеличение концентрации кальция в клетке, вызванной активностью лекарственного средства, что также может вызвать апоптоз через кальпаин, связывающий кальций .
Внутренний путь
[ редактировать ]Внутренний путь также известен как митохондриальный путь. Митохондрии необходимы для многоклеточной жизни. Без них ячейка перестает дышать аэробно и быстро умирать. Этот факт формирует основу для некоторых апоптотических путей. Апоптотические белки, которые нацелены на митохондрии, влияют на них по -разному. Они могут вызвать отек митохондрий посредством образования пор мембран, или они могут увеличить проницаемость митохондриальной мембраны и вызвать утечку апоптотических эффекторов. [ 22 ] [ 30 ] Существует также растущее количество доказательств, указывающих на то, что оксид азота способен вызвать апоптоз, помогая рассеять мембранную потенциал митохондрий и, следовательно, сделать его более проницаемым. [ 31 ] Оксид азота участвует в инициировании и ингибировании апоптоза посредством его возможного действия в качестве сигнальной молекулы последующих путей, которые активируют апоптоз. [ 32 ]
Во время апоптоза цитохром С выделяется из митохондрий посредством действия белков Bax и Bak . Механизм этого высвобождения загадочен, но, по-видимому, связан с множеством гомо- и гетеро-димеров Bax/Bak Bax/Bak, вставленных во внешнюю мембрану. [ 33 ] Как только цитохром С высвобождается, он связывается с активирующим фактором апоптотической протеазы-1 ( APAF-1 ) и АТФ , которые затем связываются с прокаспазой-9, чтобы создать белковый комплекс, известный как апоптосома . Апоптосома расщепляет про-каспазу по своей активной форме каспазы-9 , которая, в свою очередь, расщепляет и активирует прокаспазу в эффекторную каспазу-3 .
Митохондрии также высвобождают белки, известные как SMAC (второй митохондрий, активируемый каспазами клетки ) в цитозол после увеличения проницаемости мембран митохондрий. SMAC связывается с белками, которые ингибируют апоптоз (IAP), тем самым деактивируя их, и предотвращают остановку IAPS процесса и, следовательно, позволяя апоптозу продолжаться. IAP также обычно подавляет активность группы цистеиновых протеаз, называемых каспазами , [ 34 ] которые выполняют деградацию ячейки. Следовательно, фактические ферменты деградации можно увидеть косвенно регулируемыми митохондриальной проницаемостью.
Внешний путь
[ редактировать ]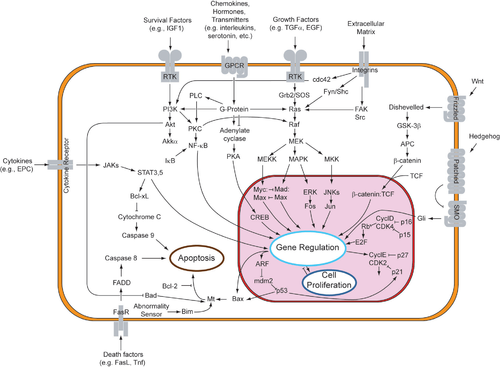
Были предложены две теории прямого инициации апоптотических механизмов у млекопитающих: модель TNF-индуцированная ( фактор некроза опухоли ) и -Fas Fas модель , опосредованная , оба с участием рецепторов семейства рецепторов TNF (TNFR). [ 35 ] в сочетании с внешними сигналами.
TNF путь
[ редактировать ]TNF-альфа является цитокином, продуцируемым в основном активированными макрофагами , и является основным внешним медиатором апоптоза. Большинство клеток в организме человека имеют два рецептора для TNF-альфа: TNFR1 и TNFR2 . Было показано, что связывание TNF-альфа с TNFR1 инициирует путь, который приводит к активации каспазы посредством промежуточных мембранных белков TNF-рецептора, ассоциированного с доменом смерти ( TRADD ) и FAS-ассоциированного белка домена смерти ( FADD ). CIAP1 /2 может ингибировать передачу сигналов TNF-α путем связывания с TRAF2 . FLIP ингибирует активацию каспазы-8. [ 36 ] Связывание этого рецептора также может косвенно привести к активации факторов транскрипции, участвующих в выживании клеток и воспалительных реакциях. [ 37 ] Однако передача сигналов через TNFR1 может также вызывать апоптоз независимым от каспазы. [ 38 ] Связь между TNF-альфа и апоптозом показывает, почему ненормальная продукция TNF-Alpha играет фундаментальную роль в нескольких заболеваниях человека, особенно при аутоиммунных заболеваниях . Суперсемейство рецептора TNF-альфа также включает в себя смертельные рецепторы (DRS), такие как DR4 и DR5 . Эти рецепторы связываются с белковым следом и опосредуют апоптоз. Известно, что апоптоз является одним из основных механизмов целевой терапии рака. [ 39 ] Недавно были разработаны люминесцентные гибриды комплекса-пептидов иридий (IPH), которые имитируют след и связываются с рецепторами смерти на раковых клетках, тем самым вызывая их апоптоз. [ 40 ]
Fas Pathway
[ редактировать ]Рецептор FAS (первый сигнал апоптоза)-(также известный как APO-1 или CD95 ) является трансмембранным белком семейства TNF, который связывает Fas-лиганд (FASL). [ 35 ] Взаимодействие между FA и FASL приводит к образованию сигнального комплекса, вызывающего смерть (DISC), который содержит FADD, каспазу-8 и каспазу-10. В некоторых типах клеток (тип I) обработанная каспаза-8 напрямую активирует других членов семейства каспазы и запускает выполнение апоптоза клетки. В других типах ячеек (тип II) Fas -Disc запускает петлю обратной связи, которая спираль в увеличение высвобождения проапоптотических факторов из митохондрий и амплифицированной активации каспазы -8. [ 41 ]
Общие компоненты
[ редактировать ]После активации TNF-R1 и FAS в клетках млекопитающих [ Цитация необходима ] баланс между проапоптотическим ( Bax , [ 42 ] BID , BAK , или плохой ) и антиапоптотические ( BCL-XL и BCL-2 ) члены семейства BCL-2 . Этот баланс представляет собой долю проапоптотических гомодимеров , которые образуются во внешней мембране митохондриона. Проапоптотические гомодимеры обязаны сделать митохондриальную мембрану проницаемой для высвобождения активаторов каспазы, таких как цитохрома C и SMAC. Контроль проапоптотических белков в нормальных клеточных условиях неапоптотических клеток не полностью понят, но в целом BAX или BAK активируются активацией белков только BH3, частью семейства BCL-2 . [ 43 ]
Каспазы
[ редактировать ]Каспазы играют центральную роль в трансдукции ER -апоптотических сигналов. Каспазы-это белки, которые являются высококонсервативными, цистеин-зависимыми аспартат-специфическими протеазами. Существует два типа каспаз: каспазы инициатора (каспазы 2, 8, 9, 10, 11 и 12) и эффекторные каспазы (каспазы 3, 6 и 7). Активация каспаз инициатора требует связывания с специфическим олигомерным белком активатора . Затем эффекторные каспазы активируются этими активными каспазами инициатора посредством протеолитического расщепления. Активные эффекторные каспазы затем протеолитически разлагают множество внутриклеточных белков для проведения программы гибели клеток.
Каспаза-независимый апоптотический путь
[ редактировать ]Также существует апоптотический путь, независимый от каспазы, который опосредуется AIF ( фактор, вызывающий апоптоз ). [ 44 ]
Модель апоптоза у амфибий
[ редактировать ]Frog Xenopus laevis служит идеальной системой моделей для изучения механизмов апоптоза. Фактически, йод и тироксин также стимулируют впечатляющий апоптоз клеток личиночных жабра, хвоста и плавников при метаморфозе амфибия и стимулируют эволюцию их нервной системы, превращая воду, вегетарианскую голова в землеядную плотоядную щипу . [ 45 ] [ 46 ] [ 47 ] [ 48 ]
Негативные регуляторы апоптоза
[ редактировать ]Негативная регуляция апоптоза ингибирует сигнальные пути гибели клеток, помогая опухолям уклоняться от гибели клеток и развития лекарственной устойчивости . Отношение между антиапоптотическими (BCL-2) и проапоптотическими (BAX) белками определяет, живет ли клетка или умирает. [ 49 ] [ 50 ] Многие семейства белков действуют как негативные регуляторы, классифицируемые либо на антиапоптотические факторы, такие как IAPS и белки Bcl-2, или факторы проживания, такие как CFLIP , BNIP3 , FADD , AKT и NF-κB . [ 51 ]
Протеолитическая каскада касказы: убийство клетки
[ редактировать ]Многие пути и сигналы приводят к апоптозу, но они сходятся по одному механизму, который фактически вызывает смерть клетки. После того, как клетка получает стимул, она подвергается организованной деградации клеточных органеллов с помощью активированных протеолитических каспаз . В дополнение к разрушению клеточных органеллов, мРНК быстро и глобально деградируется механизмом, который еще не полностью охарактеризован. [ 52 ] Распад мРНК запускается очень рано при апоптозе.
Клетка, перенесшая апоптоз, показывает серию характерных морфологических изменений. Ранние изменения включают:
- Усадка клеток и округление возникают из -за отвлечения ламеллиподий и расщепления белкового цитоскелета каспазами. [ 53 ]
- Цитоплазма выглядит плотной, а органелл кажутся плотно упакованными.
- Хроматин подвергается конденсации в компактные участки против ядерной оболочки (также известной как перинуклеарная оболочка) в процессе, известном как Pyknosis , признак апоптоза. [ 54 ] [ 55 ]
- Ядерная оболочка становится прерывистой, а ДНК внутри ее фрагментируется в процессе, называемом кариоррексисом . Ядро разбивается на несколько дискретных хроматиновых тел или нуклеосомных единиц из -за деградации ДНК. [ 56 ]
Апоптоз прогрессирует быстро, и его продукты быстро удаляются, что затрудняет обнаружение или визуализацию в классических разделах гистологии. Во время кариоррексиса активация эндонуклеазы оставляет короткие фрагменты ДНК, регулярно расположенные по размеру. Они дают характерное «лестничное» появление на агара геле после электрофореза . [ 57 ] Тесты на лестницу ДНК дифференцируют апоптоз от ишемической или токсичной гибели клеток. [ 58 ]
Апоптотическая клеточная разборка
[ редактировать ]
Перед тем, как апоптотическая ячейка утилизирована, существует процесс разборки. Есть три распознанных шага в разборке апоптотических клеток: [ 60 ]
- Мембранная пузырь: клеточная мембрана показывает нерегулярные пород, известные как пузырьки . Первоначально это меньшие поверхностные пузырьки. Позже они могут превратиться в более крупные так называемые динамические мембранные пузырьки. [ 60 ] Важным регулятором апоптотической клеточной мембраны является Rock1 (Rho, связанная с спиральной катушкой, содержащей протеинкиназу 1). [ 61 ] [ 62 ]
- Образование мембранных выступов: некоторые типы клеток в определенных условиях могут развивать различные типы длинных, тонких расширений клеточной мембраны, называемых мембранными вытяжением. Было описано три типа: микротрубочки , апоптоподию ( ноги смерти ) и апоптоподия из бисера (последняя с видом бусины на строке). [ 63 ] [ 64 ] [ 65 ] Паннексин 1 является важным компонентом мембранных каналов, участвующих в формировании апоптоподии и апоптоподии из бисера. [ 64 ]
- Фрагментация : клетка разбивается на множественные пузырьки, называемые апоптотическими телами , которые подвергаются фагоцитозу . Плазматические мембраны могут помочь приблизить апоптотические тела ближе к фагоцитам.
Удаление мертвых клеток
[ редактировать ]Удаление мертвых клеток соседними фагоцитарными клетками было названо эфроцитозом . [ 66 ] Умирающие клетки, которые подвергаются конечным стадиям апоптоза, показывают фагоцитотические молекулы, такие как фосфатидилсерин , на их клеточной поверхности. [ 67 ] Фосфатидилсерин обычно обнаруживается на внутренней листовой поверхности плазматической мембраны, но перераспределяется во время апоптоза на внеклеточную поверхность белком, известным как скремблаза . [ 68 ] Эти молекулы отмечают клетку для фагоцитоза клетками, обладающими соответствующими рецепторами, такими как макрофаги. [ 69 ] Снятие умирающих клеток фагоцитами происходит упорядоченным образом, не выявляя воспалительного ответа . [ 70 ] Во время апоптоза клеточная РНК и ДНК отделяются друг от друга и сортируют по разным апоптотическим телам; Разделение РНК инициируется как нуклеолярная сегрегация. [ 71 ]
Нокауты пути
[ редактировать ]Многие нокауты были сделаны в путях апоптоза, чтобы проверить функцию каждого из белков. Несколько каспаз, в дополнение к APAF1 и FADD , были мутированы, чтобы определить новый фенотип. Чтобы создать нокаут фактора некроза опухоли (TNF), экзон, содержащий нуклеотиды 3704–5364, был удален из гена. [ 72 ] Этот экзон кодирует часть зрелого домена TNF, а также последовательность лидеров, которая является высоко консервативной областью, необходимой для правильной внутриклеточной обработки. TNF-/- мыши развиваются нормально и не имеют грубых структурных или морфологических нарушений. Однако после иммунизации SRBC (овечьей эритроциты) эти мыши продемонстрировали дефицит созревания ответа антител; Они смогли генерировать нормальные уровни IGM, но не могли развивать определенные уровни IgG. [ 73 ] APAF-1-это белок, который включает каспазу 9 путем расщепления, чтобы начать каскад каспазы, который приводит к апоптозу. [ 74 ] Поскольку мутация A-/-в гене APAF-1 является эмбриональной летальной, была использована стратегия ловушки генов для создания мыши APAF-1-/-. Этот анализ используется для нарушения функции генов путем создания слияния внутриагенного гена. Когда ловушка гена APAF-1 вводится в клетки, происходит много морфологических изменений, таких как расщелина позвоночника, стойкость межпроводных сетей и открытый мозг. [ 75 ] Кроме того, после эмбрионального дня 12.5 мозг эмбрионов показал несколько структурных изменений. Клетки APAF-1 защищены от стимулов апоптоза, таких как облучение. У нокаутирующей мыши Bax-1 наблюдается нормальное образование переднего мозга и уменьшенную запрограммированную гибель клеток в некоторых нейрональных популяциях и в спинном мозге, что приводит к увеличению моторных нейронов. [ 76 ]
Белки каспазы являются неотъемлемой частью пути апоптоза, поэтому следует, что сделанные нокауты имеют различные поврежденные результаты. Нокаут каспазы 9 приводит к тяжелой пороке мозга [ Цитация необходима ] Полем Нокаут каспазы 8 приводит к сердечной недостаточности и, следовательно, эмбриональной летальности [ Цитация необходима ] Полем Однако при использовании технологии Cre-Lox был создан нокаут каспазы 8, который демонстрирует увеличение периферических Т-клеток, нарушение реакции Т-клеток и дефект в закрытии нервной трубки [ Цитация необходима ] Полем Было обнаружено, что эти мыши устойчивы к апоптозу, опосредованному CD95, TNFR и т. Д., Но не устойчивы к апоптозу, вызванному ультрафиолетовым излучением, химиотерапевтическими препаратами и другими стимулами. Наконец, нокаут каспазы 3 характеризовался эктопическими клеточными массами в мозге и аномальные апоптотические признаки, такие как мембранная пул или ядерная фрагментация [ Цитация необходима ] Полем Замечательной особенностью этих мышей KO является то, что у них есть очень ограниченный фенотип: CASP3, 9, у мышей APAF-1 KO деформации нервной ткани, а FADD и CASP 8 KO показали дефектное развитие сердца, однако, в обоих типах ДО других органов. Обычно развивались, и некоторые типы клеток все еще были чувствительны к апоптотическим стимулам, что позволяет предположить, что существуют неизвестные проапоптотические пути.
Методы отличия апоптотика от некротических клеток
[ редактировать ]
Для сравнения апоптотических и визуализацию живых клеток , микроскопия по времени , фтороцитометрия потока и просвечивающая электронная микроскопия некроцитометрических клеток можно использовать . Существуют также различные биохимические методы для анализа маркеров клеточной поверхности (воздействие фосфатидилсерина в сравнении с проницаемостью клеток с помощью проточной цитометрии), клеточные маркеры, такие как фрагментация ДНК [ 77 ] (проточная цитометрия), [ 78 ] Активация каспазы, расщепление предложений и высвобождение цитохрома С ( вестерн -блоттинг ). Скрининг супернатанта для каспаз, HMGB1 и Cytokeratin 18 высвобождения может идентифицировать первичную из вторичных некротических клеток. Тем не менее, пока нет отдельных поверхностных или биохимических маркеров некротической гибели клеток, и доступны только негативные маркеры. К ним относятся отсутствие апоптотических маркеров (активация каспазы, высвобождение цитохрома С и фрагментацию олигонуклеосомной ДНК) и дифференциальная кинетика маркеров гибели клеток (воздействие фосфатидилсерина и пермеабилизация клеточной мембраны). Выбор методов, которые можно использовать для различения апоптоза от некроптотических клеток, можно найти в этих ссылках. [ 79 ] [ 80 ] [ 81 ] [ 82 ]
Значение при заболевании
[ редактировать ]


Дефектные пути
[ редактировать ]Многие различные типы апоптотических путей содержат множество различных биохимических компонентов, многие из которых еще не поняты. [ 83 ] В качестве пути более или менее последовательный характер, удаление или модификация одного компонента приводит к эффекту в другом. В живом организме это может иметь катастрофические эффекты, часто в форме заболевания или расстройства. Обсуждение каждого заболевания, вызванного модификацией различных апоптотических путей, было бы нецелесообразно, но концепция, превышающая каждая, одинакова: нормальное функционирование пути было нарушено таким образом, чтобы нарушить способность клетки подвергаться Нормальный апоптоз. Это приводит к ячейке, которая проживает свою «дату использования» и способна воспроизвести и передавать любую ошибочную машину в его потомство, увеличивая вероятность того, что клетка станет раковой или больной.
Недавно описанный пример этой концепции в действии можно увидеть при разработке рака легких под названием NCI-H460 . [ 84 ] X -связанный ингибитор белка апоптоза ( XIAP ) сверхэкспрессируется в клетках клеточной линии H460 . XIAP связываются с обработанной формой каспазы-9 и подавляют активность апоптотического активатора цитохрома C , поэтому сверхэкспрессия приводит к уменьшению количества проапоптотических агонистов. Как следствие, баланс антиапоптотических и проапоптотических эффекторов расстроен в пользу первых, и поврежденные клетки продолжают воспроизводиться, несмотря на то, что они направлены на смерть. Дефекты регуляции апоптоза в раковых клетках часто встречаются на уровне контроля транскрипционных факторов. В качестве конкретного примера дефекты в молекулах, которые контролируют фактор транскрипции NF-κB при раке, изменяют режим регуляции транскрипции и реакцию на апоптотические сигналы, чтобы ограничить зависимость от ткани, к которой принадлежит клетка. Эта степень независимости от внешних сигналов выживаемости может обеспечить метастазирование рака. [ 85 ]
Дисрегуляция p53
[ редактировать ]Белок-супрессор опухоли P53 накапливается, когда ДНК повреждена из-за цепочки биохимических факторов. Часть этого пути включает альфа- интерферон и бета-интерферон, которые вызывают транскрипцию гена p53 , что приводит к увеличению уровня белка p53 и повышению апоптоза раковых клеток. [ 86 ] P53 предотвращает воспроизведение ячейки, останавливая клеточный цикл при G1 или интерфазу, чтобы дать ячейку для восстановления; Тем не менее, это вызовет апоптоз, если повреждение обширно, а усилия по ремонту ухудшаются. [ 87 ] Любое нарушение регуляции генов p53 или интерферонов приведет к нарушению апоптоза и возможного образования опухолей.
Торможение
[ редактировать ]Ингибирование апоптоза может привести к ряду рака, воспалительных заболеваний и вирусных инфекций. Первоначально считалось, что связанное накопление клеток было обусловлено увеличением клеточной пролиферации, но теперь известно, что это также связано с уменьшением гибели клеток. Наиболее распространенным из этих заболеваний является рак, болезнь чрезмерной клеточной пролиферации, которая часто характеризуется сверхэкспрессией членов семейства IAP . В результате злокачественные клетки испытывают аномальный ответ на индукцию апоптоза: цикл-регулирующие гены (такие как p53, ras или c-myc) мутированы или инактивируются в больных клетках, и в дальнейших генах (такие как Bcl-2) также модифицируются их экспрессия в опухолях. Некоторые апоптотические факторы жизненно важны во время митохондриального дыхания, например, цитохром C. [ 88 ] Патологическая инактивация апоптоза в раковых клетках коррелирует с частыми дыхательными метаболическими изменениями в сторону гликолиза (наблюдение, известное как «Варбургская гипотеза». [ 89 ]
Вся ячейка
[ редактировать ]Апоптоз в Хела [ B ] Клетки ингибируются белками, продуцируемыми клеткой; Эти ингибирующие белки нацелены на белки ретинобластомы. [ 90 ] Эти опухолевые белки регулируют клеточный цикл, но становятся неактивными, когда связаны с ингибирующим белком. [ 90 ] HPV E6 и E7 являются ингибирующими белками, экспрессируемыми папилломой человека, причем HPV ответственен за образование опухоли шейки матки, из которой получены клетки HeLa. [ 91 ] HPV E6 вызывает p53, который регулирует клеточный цикл, становится неактивным. [ 92 ] HPV E7 связывается с белками, подавляющими опухоль ретинобластомы и ограничивает его способность контролировать деление клеток. [ 92 ] Эти два ингибирующих белка частично ответственны за бессмертие клеток HeLa, ингибируя апоптоз. [ 93 ]
Лечение
[ редактировать ]Основной метод лечения потенциальной смерти от заболеваний, связанных с сигналами, включает в себя либо увеличение, либо уменьшение восприимчивости апоптоза в больных клетках, в зависимости от того, вызвано ли заболевание либо ингибированием, либо избыточным апоптозом. Например, лечение направлено на восстановление апоптоза для лечения заболеваний с дефицитной гибелью клеток и увеличения апоптотического порога для лечения заболеваний, связанных с чрезмерной гибелью клеток. Чтобы стимулировать апоптоз, можно увеличить количество лигандов рецепторов смерти (таких как TNF или TRAIL), противодействовать антиапоптотическому пути BCL-2 или ввести миметику SMAC, чтобы ингибировать ингибитор (IAP). [ 49 ] Добавление таких агентов, как герцептин, Iressa или Gleevec, работает, чтобы остановить циклирование клеток и вызывает активацию апоптоза, блокируя рост и передачу сигналов выживания вверх по течению. Наконец, добавление комплексов p53- MDM2 вытесняет p53 и активирует путь p53, что приводит к остановке клеточного цикла и апоптозу. Многие различные методы могут быть использованы либо для стимуляции, либо для ингибирования апоптоза в различных местах вдоль сигнального пути смерти. [ 94 ]
Апоптоз представляет собой многоэтапную многоэтапную программу клеточной смерти, которая присутствует в каждой клетке тела. При раке соотношение различий в клетках апоптоза изменяется. Лечение рака химиотерапией и облучением убивает клетки -мишени, главным образом, индуцируя апоптоз.
Гиперактивный апоптоз
[ редактировать ]С другой стороны, потеря контроля гибели клеток (приводящих к избыточному апоптозу) может привести к нейродегенеративным заболеваниям, гематологическим заболеваниям и повреждению тканей. Нейроны, которые полагаются на митохондриальное дыхание, подвергаются апоптозу при нейродегенеративных заболеваниях, таких как болезнь Альцгеймера [ 95 ] и Паркинсон. [ 96 ] (наблюдение, известное как «Гипотеза обратной Варбург» [ 88 ] [ 97 ] ) Более того, существует обратная эпидемиологическая сопутствующая патология между нейродегенеративными заболеваниями и раком. [ 98 ] Прогрессирование ВИЧ напрямую связано с избыточным, нерегулируемым апоптозом. У здорового человека количество лимфоцитов CD4+ содержит баланс с клетками, генерируемыми костным мозгом; Однако у ВИЧ-позитивных пациентов этот баланс теряется из-за неспособности костного мозга регенерировать клетки CD4+. В случае ВИЧ лимфоциты CD4+ умирают с ускоренной скоростью за счет неконтролируемого апоптоза при стимулировании. На молекулярном уровне гиперактивный апоптоз может быть вызван дефектами в сигнальных путях, которые регулируют белки семейства BCL-2. Повышенная экспрессия апоптотических белков, таких как BIM, или их снижение протеолиза, приводит к гибели клеток и может вызвать ряд патологий, в зависимости от клеток, где происходит чрезмерная активность BIM. Раковые клетки могут избежать апоптоза с помощью механизмов, которые подавляют экспрессию BIM или повышенным протеолизом BIM. [ Цитация необходима ]
Лечение
[ редактировать ]Лечение, направленные на то, чтобы ингибировать работы для блокирования конкретных каспаз. Наконец, протеинкиназа AKT способствует выживанию клеток через два пути. AKT фосфорилирует и ингибирует плохой (член семейства BCL-2), заставляя плохой взаимодействие с каркасом 14-3-3 , что приводит к диссоциации BCL и, следовательно, выживанию клеток. AKT также активирует IKKα, что приводит к активации NF-κB и выживанию клеток. Активный NF-κB индуцирует экспрессию антиапоптотических генов, таких как BCL-2, что приводит к ингибированию апоптоза. Было обнаружено, что NF-κB играет как антиапоптотическую роль, так и проапоптотическую роль в зависимости от используемых стимулов и типа клеток. [ 99 ]
Прогрессирование ВИЧ
[ редактировать ]Прогрессирование инфекции вируса иммунодефицита человека в СПИДа обусловлено, главным образом, истощением лимфоцитов CD4+ T-Helper таким образом, чтобы костный мозг организма для пополнения клеток, что приводит к скомпрометированной иммунной системе. Одним из механизмов, с помощью которых клетки T-Helper истощаются, является апоптоз, который является результатом серии биохимических путей: [ 100 ]
- Ферменты ВИЧ деактивируют антиапоптотические BCL-2 . Это напрямую не вызывает гибели клеток, но использует клетку для апоптоза, если будет получен соответствующий сигнал. Параллельно эти ферменты активируют проапоптотическую прокаспазу-8 , которая непосредственно активирует митохондриальные события апоптоза.
- ВИЧ может повысить уровень клеточных белков, которые приправляют Fas-опосредованный апоптоз.
- Белки ВИЧ уменьшают количество гликопротеинового маркера CD4 , присутствующего на клеточной мембране.
- Высвобожденные вирусные частицы и белки, присутствующие во внеклеточной жидкости, способны индуцировать апоптоз в ближайших к клеткам.
- ВИЧ снижает выработку молекул, участвующих в маркировке клетки для апоптоза, что дает вирусу время для воспроизведения и продолжения выпуска апоптотических агентов и вирионов в окружающую ткань.
- Инфицированная ячейка CD4+ может также получать сигнал смерти от цитотоксической Т -клетки.
Клетки также могут умереть как прямые последствия вирусных инфекций. Экспрессия ВИЧ-1 индуцирует остановку G2/M в трубчатых клетках и апоптоз. [ 101 ] Перемещение от ВИЧ к СПИДу не является непосредственным или даже обязательно быстрым; Цитотоксическая активность ВИЧ в отношении лимфоцитов CD4+ классифицируется как СПИД, когда данные CD4+ пациента снижаются ниже 200. [ 102 ]
Исследователи из Университета Кумамото в Японии разработали новый метод искоренения ВИЧ в клетках вирусного резервуара, названные «Заблокированные и апоптоз». Используя синтезированный составной гептаноилфосфатидил L-инозитол пентакфофат (или L-гиппо), чтобы сильно связываться с белком ВИЧ PR55GAG, они были способны подавлять вирусные почкования. Подавив вирусное почкуение, исследователи смогли поймать вирус ВИЧ в клетке и позволить клетке подвергаться апоптозу (природная гибель клеток). Доцент профессор Микако Фудзита заявил, что этот подход еще не доступен для пациентов с ВИЧ, потому что исследовательская группа должна провести дальнейшие исследования по объединению лекарственной терапии, которая в настоящее время существует с этим подходом «блокировки и апоптоза», чтобы привести к полному выздоровлению от ВИЧ Полем [ 103 ]
Вирусная инфекция
[ редактировать ]Вирусная индукция апоптоза происходит, когда одна или несколько клеток живого организма инфицированы вирусом , что приводит к гибели клеток. Клеточная гибель у организмов необходима для нормального развития клеток и созревания клеточного цикла. [ 104 ] Это также важно для поддержания регулярных функций и активности клеток.
Вирусы могут вызывать апоптоз инфицированных клеток через ряд механизмов, включая:
- Связывание рецептора
- Активация протеинкиназы R (PKR)
- Взаимодействие с p53
- Экспрессия вирусных белков, связанных с белками MHC на поверхности инфицированной клетки, позволяя распознавать клетками иммунной системы (такими как природные убийцы и цитотоксические Т -клетки ), которые затем индуцируют инфицированную клетку для подверженности апоптозу. [ 105 ]
вирус чумы (CDV) вызывает апоптоз в центральной нервной системе и лимфоидной ткани инфицированных собак in vivo и in vitro. Известно, что [ 106 ] Апоптоз, вызванный CDV, обычно индуцируется через внешний путь , который активирует каспазы , которые разрушают клеточную функцию и в конечном итоге приводят к гибели клеток. [ 90 ] В нормальных клетках CDV сначала активирует каспазу-8, которая работает как белок инициатора, за которым следует белка-каспаза-3. [ 90 ] Однако апоптоз, индуцированный CDV в клетках HeLa, не включает в себя инициаторную белковую каспазу-8. Апоптоз клеток HeLa, вызванный CDV, следует за другим механизмом, чем в клеточных линиях Vero. [ 90 ] Это изменение в каскаде каспазы предполагает, что CDV индуцирует апоптоз через внутренний путь , исключая необходимость в каспазе-8 инициатора. Вместо этого белок исполнителя активируется внутренними стимулами, вызванными вирусной инфекцией, а не каскадом каспазы. [ 90 ]
Вирус Oropouche (Orov) встречается в семействе Bunyaviridae . Исследование апоптоза, вызванное Bunyaviridae, было начато в 1996 году, когда было отмечено, что апоптоз был вызван вирусом La Crosse в почечные клетки детских хомяков и в мозг младших мышей. [ 107 ]
Оров - это заболевание, которое передается между людьми кусочкой Midge ( Culicoides paraensis ). [ 108 ] Это называется зоонозным арбовирусом и вызывает лихорадочную болезнь, характеризующуюся появлением внезапной лихорадки, известной как лихорадку Oropouche. [ 109 ]
Вирус Oropouche также вызывает разрушение в культивируемых клетках - клетках, которые культивируются в различных и специфических условиях. Пример этого можно увидеть в клетках HeLa , в результате чего клетки начинают дегенерировать вскоре после их инфицирования. [ 107 ]
При использовании гелевого электрофореза можно наблюдать, что OROV вызывает фрагментацию ДНК в клетках HELA. Его можно интерпретировать путем подсчета, измерения и анализа клеток популяции клеток Sub/G1. [ 107 ] Когда клетки HeLa инфицированы OROV, цитохром C высвобождается из мембраны митохондрий в цитозоль клеток. Этот тип взаимодействия показывает, что апоптоз активируется через внутренний путь. [ 104 ]
Для того чтобы апоптоз возникал в OROV, необходима вирусная непосредственная интернализация, а также репликация клеток. Апоптоз в некоторых вирусах активируется внеклеточными стимулами. Тем не менее, исследования показали, что инфекция OROV вызывает активацию апоптоза с помощью внутриклеточных стимулов и включает митохондрии. [ 107 ]
Многие вирусы кодируют белки, которые могут ингибировать апоптоз. [ 110 ] Несколько вирусов кодируют вирусные гомологи Bcl-2. Эти гомологи могут ингибировать проапоптотические белки, такие как BAX и BAK, которые необходимы для активации апоптоза. Примеры вирусных белков BCL-2 включают белок вируса Epstein-Barr BHRF1 и белок аденовируса E1B 19K. [ 111 ] Некоторые вирусы экспрессируют ингибиторы каспазы, которые ингибируют активность каспазы, и примером является белок CRMA вирусов коровьей оспы. В то время как количество вирусов может блокировать эффекты TNF и Fas. Например, белок M-T2 вирусов миксомы может связывать TNF, предотвращая его связывание рецептора TNF и индуцировать ответ. [ 112 ] Кроме того, многие вирусы экспрессируют ингибиторы р53, которые могут связывать р53 и ингибировать его транскрипционную трансактивационную активность. Как следствие, p53 не может индуцировать апоптоз, поскольку он не может индуцировать экспрессию проапоптотических белков. Белок аденовируса E1B-55K и вирус HBX вируса гепатита В являются примерами вирусных белков, которые могут выполнять такую функцию. [ 113 ]
Вирусы могут оставаться нетронутыми от апоптоза, в частности, на последних стадиях инфекции. Они могут быть экспортированы в апоптотических телах , которые отжимают от поверхности умирающей клетки, и тот факт, что они охвачены фагоцитами, предотвращает инициацию ответа хозяина. Это способствует распространению вируса. [ 112 ] Прионы могут вызывать апоптоз в нейронах .
Растения
[ редактировать ]Запрограммированная гибель клеток у растений имеет ряд молекулярных сходств с апоптозом животных, но она также имеет различия, известными, являются наличие клеточной стенки и отсутствие иммунной системы , которая удаляет куски мертвой клетки. Вместо иммунного ответа умирающая клетка синтезирует вещества, чтобы разрушить себя и помещает их в вакуоль , которая разрывается по мере умирания клеток. Кроме того, растения не содержат фагоцитарные клетки, которые необходимы для разрыва и удаления апоптотических тел. [ 114 ] имени напоминает ли весь этот процесс апоптоз животных достаточно внимательно, чтобы гарантировать использование апоптоза (в отличие от более общей запрограммированной гибели клеток ). Неясно, [ 115 ] [ 116 ]
Каспаза-независимый апоптоз
[ редактировать ]Характеристика каспаз позволила развивать ингибиторы каспазы, которые можно использовать для определения того, включает ли клеточный процесс активные каспазы. Используя эти ингибиторы, было обнаружено, что клетки могут умирать при отображении морфологии, аналогичной апоптозу без активации каспазы. [ 117 ] Более поздние исследования связали это явление с высвобождением AIF ( фактор, вызывающий апоптоз ) из митохондрий и его транслокацию в ядро, опосредованное его NLS ( сигнал ядерной локализации ). Внутри митохондрий AIF привязан к внутренней мембране. Чтобы высвобождать, белок расщепляется кальцием-зависимой протеазой кальпаина .
Смотрите также
[ редактировать ]- Аноикис
- APAF-1
- APO2.7
- Апоптотическая фрагментация ДНК
- Атроментин индуцирует апоптоз в лейкоза клетках человека U937 . [ 118 ]
- Автолиз
- Аутофагия
- Цисплатин
- Цитотоксичность
- Энтоз
- Ферроптоз
- Гомеостаз
- Иммунология
- Некробиоз
- Некроз
- Некротаксис
- Не будет
- Митотическая катастрофа
- P53
- Параптоз
- Псевдоапоптоз
- PI3K/AKT/MTOR Путь
Пояснительные сноски
[ редактировать ]- ^ Обратите внимание, что средний взрослый человек имеет более 13 триллиона клеток ( 1,3 × 10 13 ), [ 3 ] из которых не более 70 миллиардов ( 7,0 × 10 10 ) умереть в день. То есть около 5 из каждых 1000 клеток (0,5%) умирают каждый день из -за апоптоза.
- ^ Клетки HeLa - это линия иммортализованной раковой клеточной клеточной линии, которая часто используется в исследованиях. Клеточная линия была установлена путем удаления клеток непосредственно из Генриетты , не хватает рака.
Цитаты
[ редактировать ]- ^ Грин Д. (2011). Средства до конца: апоптоз и другие механизмы гибели клеток . Cold Spring Harbour, NY: Laboratory Press Cold Spring Harbour. ISBN 978-0-87969-888-1 Полем Архивировано из оригинала 2020-07-26 . Получено 2020-05-25 .
- ^ Jump up to: а беременный Böhm I, Schild H (2003). «Апоптоз: сложный сценарий для тихой гибели клеток». Мол визуализации биол . 5 (1): 2–14. doi : 10.1016/s1536-1632 (03) 00024-6 . PMID 14499155 .
- ^ Альбертс , с. 2
- ^ Карам JA (2009). Апоптоз в канцерогенезе и химиотерапии . Нидерланды: Спрингер. ISBN 978-1-4020-9597-9 .
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2008). «Глава 18 Апоптоз: запрограммированная гибель клеток устраняет нежелательные клетки». Молекулярная биология клетки (учебник) (5 -е изд.). Гарлендская наука . п. 1115. ISBN 978-0-8153-4105-5 .
- ^ Raychaudhuri S (август 2010 г.). «Минимальная модель сигнальной сети выясняет стохастическую вариабельность ячейки к клеткам при апоптозе» . Plos один . 5 (8): E11930. Arxiv : 1009.2294 . Bibcode : 2010ploso ... 511930R . doi : 10.1371/journal.pone.0011930 . PMC 2920308 . PMID 20711445 .
- ^ Elmore S (июнь 2007 г.). «Апоптоз: обзор запрограммированной гибели клеток» . Токсикологическая патология . 35 (4): 495–516. doi : 10.1080/01926230701320337 . PMC 2117903 . PMID 17562483 .
- ^ Керр JF (октябрь 1965 г.). «Гистохимическое исследование гипертрофии и ишемического повреждения печени крысы с особой ссылкой на изменения в лизосомах». Журнал патологии и бактериологии . 90 (2): 419–435. doi : 10.1002/path.1700900210 . PMID 5849603 .
- ^ Агентство по науке, технологиям и исследованиям. «Профессор Эндрю Х. Уайлли - Абстрактная лекция» . Архивировано из оригинала 2007-11-13 . Получено 2007-03-30 .
- ^ Jump up to: а беременный Kerr JF, Wyllie AH, Currie AR (август 1972 г.). «Апоптоз: основной биологический феномен с широкими значениями в кинетике ткани» . Британский журнал рака . 26 (4): 239–257. doi : 10.1038/bjc.1972.33 . PMC 2008650 . PMID 4561027 .
- ^ О'Рурк М.Г., Эллем К.А. (2000). «Джон Керр и апоптоз». Медицинский журнал Австралии . 173 (11–12): 616–617. doi : 10.5694/j.1326-5377.2000.tb139362.x . PMID 11379508 . S2CID 38265127 .
- ^ Vaux DL, Cory S, Adams JM (сентябрь 1988 г.). «Ген BCL-2 способствует выживанию гемопоэтических клеток и сотрудничает с C-Myc для увековечивания Pre-B-клетки». Природа . 335 (6189): 440–2. Bibcode : 1988natur.335..440V . doi : 10.1038/335440A0 . PMID 3262202 . S2CID 23593952 .
- ^ Альбертс , с. 1021.
- ^ Jump up to: а беременный «Американское вход в словарь наследия: апоптоз» . ahdictionary.com . Houghton Mifflin Harcourt Publishing Company. 2020. Архивировано из оригинала 26 июля 2021 года . Получено 26 июля 2021 года .
- ^ Апоптоз интересов (1999). «Об апоптозе» . Архивировано из оригинала 28 декабря 2006 года . Получено 2006-12-15 .
- ^ «Определение апоптоза» . www.webster.com . Архивировано из оригинала 2007-07-03 . Получено 2007-08-11 .
- ^ Альбертс , с. 1029.
- ^ Альбертс , с. 1023.
- ^ Альбертс , с. 1032.
- ^ Альбертс , с. 1024.
- ^ Нирмала, Дж. Грейс; Лопус, Ману (2020). «Механизмы гибели клеток у эукариот». Клеточная биология и токсикология . 36 (2): 145–164. doi : 10.1007/s10565-019-09496-2 . ISSN 1573-6822 . PMID 31820165 . S2CID 208869679 .
- ^ Jump up to: а беременный в дюймовый и фон глин Котран Р.С., Кумар С. (1998). Роббинс патологическая основа болезни . Филадельфия: WB Saunders Company. ISBN 978-0-7216-7335-6 .
- ^ Hardy S, El-Assaad W, Przybytkowski E, Joly E, Prentki M, Langelier Y (август 2003 г.). «Апоптоз, вызванный насыщенными жирными кислотами в клетках рака молочной железы MDA-MB-231. Роль кардиолипина» . Журнал биологической химии . 278 (34): 31861–31870. doi : 10.1074/jbc.m300190200 . PMID 12805375 .
- ^ Mattson MP, Chan SL (декабрь 2003 г.). «Кальций оркестрарует апоптоз» . Природная клеточная биология . 5 (12): 1041–1043. doi : 10.1038/ncb1203-1041 . PMID 14647298 . S2CID 38427579 . Архивировано из оригинала 2019-11-21 . Получено 2018-05-18 .
- ^ Uğuz AC, Naziroğlu M, Espino J, Bejarano I, González D, Rodríguez AB, Pariente JA (декабрь 2009 г.). «Селен модулирует апоптоз клеток, вызванный окислительным стрессом в клетках миелоидного HL-60 человека посредством регуляции высвобождения кальция и активности каспазы-3 и -9». Журнал мембранной биологии . 232 (1–3): 15–23. doi : 10.1007/s00232-009-9212-2 . PMID 19898892 . S2CID 22215706 .
- ^ Chiarugi A, Moskowitz MA (июль 2002 г.). «Клеточная биология. PARP-1-виновник апоптотической клеточной гибели?». Наука . 297 (5579): 200–201. doi : 10.1126/science.1074592 . PMID 12114611 . S2CID 82828773 .
- ^ Goldstein JC, Waterhouse NJ, Juin P, Evan GI, Green DR (март 2000 г.). «Координатное высвобождение цитохрома С во время апоптоза является быстрым, полным и кинетически инвариантным». Природная клеточная биология . 2 (3): 156–162. doi : 10.1038/35004029 . PMID 10707086 . S2CID 2283955 .
- ^ Lee JK, Lu S, Madhukar A (октябрь 2010 г.). «Динамика в реальном времени CA2+, каспазы-3/7 и морфологические изменения апоптоза ганглиозных клеток сетчатки при повышенном давлении» . Plos один . 5 (10): E13437. BIBCODE : 2010PLOSO ... 513437L . doi : 10.1371/journal.pone.0013437 . PMC 2956638 . PMID 20976135 .
- ^ Bejarano I, Espino J, González-Flores D, Casado JG, Redondo PC, Rosado JA, et al. (Сентябрь 2009 г.). «Роль кальциевых сигналов в апоптозе, вызванном перекисью водорода в клетках миелоидного HL-60 человека» . Международный журнал биомедицинской науки . 5 (3): 246–256. doi : 10.59566/ijbs.2009.5246 . PMC 3614781 . PMID 23675144 .
- ^ Баррига С., Баррига С. Полем сигнальной трансдукции Ток 5 (2): 181–1 doi : 10.2174/ 157436621079112122
- ^ Брюн Б (август 2003 г.). "Оксид азота: нет апоптоза или включения его?" Полем Гибель клеток и дифференциация . 10 (8): 864–869. doi : 10.1038/sj.cdd.4401261 . PMID 12867993 .
- ^ Брюн Б., фон Кнетен А., Сандау К.Б. (октябрь 1999 г.). «Оксид азота (нет): эффектор апоптоза» . Гибель клеток и дифференциация . 6 (10): 969–975. doi : 10.1038/sj.cdd.4400582 . PMID 10556974 .
- ^ Uren RT, Iyer S, Kluck RM (август 2017 г.). "Формирование пор Dimeric Bak и Bax: необычная пор?" Полем Философские транзакции Королевского общества Лондона. Серия B, биологические науки . 372 (1726): 20160218. DOI : 10.1098/rstb.2016.0218 . PMC 5483520 . PMID 28630157 .
- ^ Fesik SW, Shi Y (ноябрь 2001 г.). «Структурная биология. Контроль каспаз». Наука . 294 (5546): 1477–1478. doi : 10.1126/science.1062236 . PMID 11711663 . S2CID 11392850 .
- ^ Jump up to: а беременный Wajant H (май 2002). «Путь сигнализации FAS: больше, чем парадигма». Наука . 296 (5573): 1635–1636. Bibcode : 2002sci ... 296.1635W . doi : 10.1126/science.1071553 . PMID 12040174 . S2CID 29449108 .
- ^ Chen G, Goeddel DV (май 2002 г.). «Передача сигналов TNF-R1: красивый путь». Наука . 296 (5573): 1634–1635. Bibcode : 2002sci ... 296.1634c . doi : 10.1126/science.1071924 . PMID 12040173 . S2CID 25321662 .
- ^ Goeddel, DV (2007). «Карта соединения для пути фактора некроза опухоли» . Science's Stke . 2007 (382): TW132. doi : 10.1126/stke.3822007tw132 . S2CID 85404086 . Архивировано из оригинала на 2009-07-10 . Получено 2004-01-01 .
- ^ Chen W, Li N, Chen T, Han Y, Li C, Wang Y, et al. (Декабрь 2005 г.). «Лизосома-ассоциированный белок, индуцирующий апоптоз, содержащий гомологию Pleckstrin (PH) и Fyve (LAPF), представляющий новое семейство pH и доменных белков Fyve, индуцирует независимый апоптоз лизосомно-митохондриального пути» . Журнал биологической химии . 280 (49): 40985–40995. doi : 10.1074/jbc.m502190200 . PMID 16188880 . (Втянут, см doi : 10.1016/j.jbc.2021.100764 )
- ^ Gerl R, Vaux DL (февраль 2005 г.). «Апоптоз в развитии и лечении рака» . Канцерогенез . 26 (2): 263–270. doi : 10.1093/carcin/bgh283 . PMID 15375012 .
- ^ Масум А.А., Йокои К., Хисамацу Ю., Найто К., Шашни Б., Аоки С (сентябрь 2018 г.). «Дизайн и синтез люминесцентного гибрида комплекса иридия (IPH), который обнаруживает раковые клетки и вызывает их апоптоз». Биоорганическая и лекарственная химия . 26 (17): 4804–4816. doi : 10.1016/j.bmc.2018.08.016 . PMID 30177492 . S2CID 52149418 .
- ^ Wajant H (2007). «Карта соединения для сигнального пути FAS» . Science's Stke . 2007 (380): TR1. doi : 10.1126/stke.3802007tr1 . S2CID 84909531 . Архивировано из оригинала на 2009-05-03 . Получено 2004-01-01 .
- ^ Мерфи К.М., Ранганатан В., Фарнсворт М.Л., Кавалларис М. , Лок РБ (январь 2000 г.). «BCL-2 ингибирует транслокацию BAX из цитозоля в митохондрии во время апоптоза опухолевых клеток человека» человека » . Гибель клеток и дифференциация . 7 (1): 102–111. doi : 10.1038/sj.cdd.44400597 . PMID 10713725 .
- ^ Westphal D, Kluck RM, Dewson G (февраль 2014 г.). «Строительные блоки апоптотической поры: как активируются Bax и Bak и олигомеризируются во время апоптоза» . Гибель клеток и дифференциация . 21 (2): 196–205. doi : 10.1038/cdd.2013.139 . PMC 3890949 . PMID 24162660 .
- ^ Susin SA, Lorenzo HK, Zamzami N, Marzo I, Snow Be, Brothers GM, et al. (Февраль 1999 г.). «Молекулярная характеристика фактора, вызывающего апоптоз митохондриального апоптоза». Природа . 397 (6718): 441–446. Bibcode : 1999natur.397..441s . doi : 10.1038/17135 . PMID 9989411 . S2CID 204991081 .
- ^ Jewhurst K, Levin M, McLaughlin KA (2014). «Оптогенетический контроль апоптоза в целевых тканях эмбрионов Xenopus laevis» . Журнал гибели клеток . 7 : 25–31. doi : 10.4137/jcd.s18368 . PMC 4213186 . PMID 25374461 .
- ^ Вентури С. (2011). «Эволюционная значимость йода». Текущая химическая биология . 5 (3): 155–62. doi : 10.2174/187231311796765012 .
- ^ Вентури, Себастьяно (2014). «Йод, PUFA и йодолипиды в отношении здоровья и болезней: эволюционная перспектива». Человеческая эволюция . 29 (1–3): 185–205. ISSN 0393-9375 .
- ^ Тамура К., Такаяма С., Она Т., Маварибучи С., Такамацу Н., Ито М (июнь 2015 г.). «Апоптоз и различие миобластов, полученных из хвоста Xenopus с помощью гормона щитовидной железы » Журнал молекулярной эндокринологии 54 (3): 185–1 Doi : 10.1530/jme- 14-0 25791374PMID
- ^ Jump up to: а беременный Ян Р., Чаудхри Г.Е. (июнь 2019 г.). «Понимание апоптоза и апоптотических путей нацелен на терапию рака» . Усовершенствованный фармацевтический бюллетень . 9 (2): 205–218. doi : 10.15171/apb.2019.024 . PMC 6664112 . PMID 31380246 .
- ^ Кейл Дж., Остерлунд Э.Дж., Эндрюс Д.В. (январь 2018 г.). «Белки семейства BCL-2: изменение партнеров в танцах к смерти» . Гибель клеток и дифференциация . 25 (1): 65–80. doi : 10.1038/cdd.2017.186 . PMC 5729540 . PMID 29149100 .
- ^ Разаги А., Хейманн К., Шеффер П.М., Гибсон С.Б. (февраль 2018 г.). «Негативные регуляторы путей гибели клеток при раке: перспектива биомаркеров и целевых методов лечения». Апоптоз . 23 (2): 93–112. doi : 10.1007/s10495-018-1440-4 . PMID 29322476 . S2CID 3424489 .
- ^ Томас MP, Liu X, Whangbo J, McCrossan G, Sanborn KB, Basar E, et al. (Май 2015). «Апоптоз запускает специфический, быстрый и глобальный распад мРНК с 3 'уридилированными промежуточными продуктами, разлагаемыми DIS3L2» . Сотовые отчеты . 11 (7): 1079–1089. doi : 10.1016/j.celrep.2015.04.026 . PMC 4862650 . PMID 25959823 .
- ^ Böhm I (май 2003). «Разрушение цитоскелета после индукции апоптоза с аутоантителами». Аутоиммунитет . 36 (3): 183–189. doi : 10.1080/0891693031000105617 . PMID 12911286 . S2CID 37887253 .
- ^ Supin SA, Dagugas E, Ravagnan L, Shomejima K, Zamzami N, Loeffler M, et al. (Август 2000). «Два распущенных пути, ведущие к ядерному апоптозу » Журнал экспериментальной медицины 192 (4): 571–5 Doi : 10.1084/jem.192.4.571 . PMC 219322 PMID 10952727
- ^ Kihlmark M, Imreh G, Hallberg E (октябрь 2001 г.). «Последовательная деградация белков из ядерной оболочки во время апоптоза». Журнал сотовой науки . 114 (Pt 20): 3643–3653. doi : 10.1242/jcs.114.20.3643 . PMID 11707516 .
- ^ Нагата S (апрель 2000 г.). «Апоптотическая фрагментация ДНК». Экспериментальные исследования клеток . 256 (1): 12–18. doi : 10.1006/excr.2000.4834 . PMID 10739646 .
- ^ Gong J, Traganos F, Darzynkiewicz Z (май 1994). «Селективная процедура экстракции ДНК из апоптотических клеток, применимая к гелевому электрофорезам и проточной цитометрии». Аналитическая биохимия . 218 (2): 314–319. doi : 10.1006/abio.1994.1184 . PMID 8074286 .
- ^ Iwata M, Myerson D, Torok-Storb B, Zager RA (декабрь 1994 г.). «Оценка почечной трубчатой ДНК -лестницы в ответ на депривацию кислорода и окислительное повреждение» . Журнал Американского общества нефрологии . 5 (6): 1307–1313. doi : 10.1681/asn.v561307 . PMID 7893995 .
- ^ Смит А., Паркс М.А., Аттик-Смит Г.К., Тикейра Р., Пун Ик (2017). "Cel Soymbly с Apaptoise" . Лекарство 4 (1). doi : 10.15347/2017.008 .
- ^ Jump up to: а беременный Tixeira R, Caruso S, Paone S, Baxter AA, Atkin-Smith GK, Hulett MD, Poon IK (март 2017 г.). «Определение морфологических особенностей и продуктов разборки клеток во время апоптоза». Апоптоз . 22 (3): 475–477. doi : 10.1007/s10495-017-1345-7 . PMID 28102458 . S2CID 34648758 .
- ^ Coleman ML, Sahai EA, Yeo M, Bosch M, Dewar A, Olson MF (апрель 2001 г.). «Мембранная блеббинг во время апоптоза является результатом каспаз-опосредованной активации породы I». Природная клеточная биология . 3 (4): 339–345. doi : 10.1038/35070009 . PMID 11283606 . S2CID 2537726 .
- ^ Себбах М., Ренвойз С., Хамелин Дж., Ричэ Н., Бертольо Дж., Бреард Дж. (Апрель 2001 г.). «Опосредованное каспазой-3 расщепление породы I индуцирует фосфорилирование MLC и апоптотическую мембрану». Природная клеточная биология . 3 (4): 346–352. doi : 10.1038/35070019 . PMID 11283607 . S2CID 36187702 .
- ^ Moss DK, Betin VM, Malesinski SD, Lane JD (июнь 2006 г.). «Новая роль микротрубочек в апоптотической динамике хроматина и клеточной фрагментации» . Журнал сотовой науки . 119 (Pt 11): 2362–2374. doi : 10.1242/jcs.02959 . PMC 1592606 . PMID 16723742 .
- ^ Jump up to: а беременный Poon IK, Chiu YH, Armstrong AJ, Kinchen JM, Juncadella IJ, Bayliss DA, Ravichandran KS (март 2014 г.). «Неожиданная связь между антибиотиком, паннексиновыми каналами и апоптозом» . Природа . 507 (7492): 329–334. Bibcode : 2014natur.507..329p . doi : 10.1038/nature13147 . PMC 4078991 . PMID 24646995 .
- ^ Atkin-Smith GK, Tixeira R, Paone S, Mathivanan S, Collins C, Liem M, et al. (Июнь 2015 г.). «Новый механизм генерации внеклеточных везикул во время апоптоза через структуру мембраны шариков» . Природная связь . 6 : 7439. Bibcode : 2015natco ... 6.7439a . doi : 10.1038/ncomms8439 . PMC 4490561 . PMID 26074490 .
- ^ Vandivier RW, Henson PM, Douglas IS (июнь 2006 г.). «Захоронение мертвых: влияние неудачного удаления апоптотических клеток (эфроцитоз) на хроническое воспалительное заболевание легких». Грудь . 129 (6): 1673–1682. doi : 10.1378/грудь.129.6.1673 . PMID 16778289 .
- ^ Li Mo, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA (ноябрь 2003 г.). «Фосфатидилсериновый рецептор необходим для клиренса апоптотических клеток». Наука . 302 (5650): 1560–1563. Bibcode : 2003sci ... 302.1560o . doi : 10.1126/science.1087621 . PMID 14645847 . S2CID 36252352 .
- ^ Wang X, Wu YC, Fadok VA, Lee MC, Gengyo-Ano K, Cheng LC, et al. (Ноябрь 2003). «Клеточное труп, опосредованное рецептором фосфатидилсерина C. elegans через CED-5 и CED-12» . Наука . 302 (5650): 1563–1566. Bibcode : 2003sci ... 302.1563W . doi : 10.1126/science.1087641 . PMID 14645848 . S2CID 25672278 . Архивировано из оригинала 2021-04-14 . Получено 2017-02-26 .
- ^ Savill J, Gregory C, Haslett C (ноябрь 2003 г.). «Клеточная биология. Ешь меня или умереть». Наука . 302 (5650): 1516–1517. doi : 10.1126/science.1092533 . HDL : 1842/448 . PMID 14645835 . S2CID 13402617 .
- ^ Krysko DV, Vandenabeele P (2009-01-14). Krysko DV, Vandenabeele P (Eds.). Фагоцитоз умирающих клеток: от молекулярных механизмов до заболеваний человека . Спрингер. doi : 10.1007/978-1-4020-9293-0 . ISBN 978-1-4020-9292-3 Полем Архивировано из оригинала 2022-04-30 . Получено 2017-08-28 .
- ^ Halicka HD, Bedner E, Darzynkiewicz Z (ноябрь 2000 г.). «Сегрегация РНК и отдельная упаковка ДНК и РНК в апоптотических телах во время апоптоза». Экспериментальные исследования клеток . 260 (2): 248–256. doi : 10.1006/excr.2000.5027 . PMID 11035919 .
- ^ Wang C, Youle RJ (2009-12-01). «Роль митохондрий в апоптозе» . Ежегодный обзор генетики . 43 (1): 95–118. doi : 10.1146/annurev-genet-102108-134850 . PMC 4762029 . PMID 19659442 .
- ^ Марино М.В., Данн А., Грааль Д., Инглезе М., Ногучи Ю., Ричардс Э. и др. (Июль 1997). «Характеристика мышей с дефицитом фактора некроза опухоли» . Труды Национальной академии наук Соединенных Штатов Америки . 94 (15): 8093–8098. Bibcode : 1997pnas ... 94.8093m . doi : 10.1073/pnas.94.15.8093 . PMC 21562 . PMID 9223320 .
- ^ Bratton SB, Salvesen GS (октябрь 2010 г.). «Регуляция апоптосомы APAF-1-Caspase-9» . Журнал сотовой науки . 123 (Pt 19): 3209–3214. doi : 10.1242/jcs.073643 . PMC 2939798 . PMID 20844150 .
- ^ Mailhos C, Howard Mk, Latchman DS (апрель 1994 г.). «Общий путь опосредует ретиноевую кислоту и PMA-зависимую запрограммированную гибель клеток (апоптоз) нейрональных клеток». Исследование мозга . 644 (1): 7–12. doi : 10.1016/0006-8993 (94) 90339-5 . PMID 8032951 . S2CID 22542598 .
- ^ Mailhos C, Howard Mk, Latchman DS (апрель 1994 г.). «Общий путь опосредует ретиноевую кислоту и PMA-зависимую запрограммированную гибель клеток (апоптоз) нейрональных клеток». Исследование мозга . 644 (1): 7–12. doi : 10.1016/0006-8993 (94) 90339-5 . PMID 8032951 . S2CID 22542598 .
- ^ Lozano GM, Bejarano I, Espino J, González D, Ortiz A, García JF, Rodríguez AB, Pariente JA (2009). «Площадь градиента плотности является наиболее подходящим методом для улучшения оплодотворения и уменьшения фрагментации ДНК положительной сперматозоиды бесплодных мужчин» . Анатолийский журнал акушерства и гинекологии . 3 (1): 1–7. Архивировано из оригинала 2022-04-30 . Получено 2016-03-08 .
- ^ Darzynkiewicz Z, Juan G, Li X, Gorczyca W, Murakami T, Traganos F (январь 1997 г.). «Цитометрия в некробиологии клеток: анализ апоптоза и случайной гибели клеток (некроз)». Цитометрия . 27 (1): 1–20. doi : 10.1002/(SICI) 1097-0320 (19970101) 27: 1 <1 :: AID-Cyto2> 3.0.co; 2-L . PMID 9000580 .
- ^ Криско Д.В., Ванден Берге Т., Партоенс Е., Д'Эрде К, Ванденабиле П. (2008). «Глава 16 Методы отличия апоптотического от некротических клеток и измерения их клиренса». Запрограммированная гибель клеток, общие принципы изучения гибели клеток, часть A. Методы в фермере. Тол. 442. С. 307–41. doi : 10.1016/s0076-6879 (08) 01416-x . ISBN 9780123743121 Полем PMID 18662577 .
- ^ Криско Д.В., Ванден Бергл Т., Д. С., Ванденабеле П (март 2008 г.). «Суптоз и некроз: обнаружение, дискриминация и поэгонацитоз». Методы 44 (3): 205–221. doi : 10,1016/j.ymeth.2007 001 . PMID 18314051 .
- ^ Ванден Берге Т., Гроуджанс С., Гуссенс В., Донделингер Ю., Криско Д.В., Такахаши Н., Ванденабиле П (июнь 2013 г.). «Определение апоптотической и некротической гибели клеток in vitro и in vivo» . Методы 61 (2): 117–129. doi : 10.1016/j.ymeth.2013.02.011 . PMID 23473780 . Архивировано из оригинала 2019-11-05 . Получено 2019-11-05 .
- ^ Wlodkowic D, Telford W, Skommer J, Darzynkiewicz Z (2011). «Апоптоз и за его пределами: цитометрия в исследованиях запрограммированной гибели клеток». Последние достижения в области цитометрии, часть B - достижения в области применений . Методы в клеточной биологии. Тол. 103. С. 55–98. doi : 10.1016/b978-0-12-385493-3.00004-8 . ISBN 9780123854933 Полем PMC 3263828 . PMID 21722800 .
- ^ Томпсон CB (март 1995 г.). «Апоптоз в патогенезе и лечении заболевания». Наука . 267 (5203): 1456–1462. Bibcode : 1995sci ... 267.1456t . doi : 10.1126/science.7878464 . PMID 7878464 . S2CID 12991980 .
- ^ Ян Л., Машима Т., Сато С., Мочизуки М., Сакамото Х., Ямори Т. и др. (Февраль 2003 г.). «Преобладающее подавление апоптосомы ингибитором белка апоптоза в немелкоклеточных клетках рака легких H460: терапевтическое действие нового полиаргинового конъюгированного SMAC-пептида» . РАНКА . 63 (4): 831–837. PMID 12591734 . Архивировано с оригинала 2012-12-20 . Получено 2008-09-04 .
- ^ Vlahopoulos SA (август 2017 г.). «Аберрантный контроль NF-κB при раке позволяет транскрипционной и фенотипической пластичности, ограничивает зависимость от ткани хозяина: молекулярная мода» . Биология рака и медицина . 14 (3): 254–270. doi : 10.20892/j.issn.2095-3941.2017.0029 . PMC 5570602 . PMID 28884042 .
- ^ Такаока А., Хаякава С., Янай Х, Стойбер Д., Негиши Х., Кикучи Х. и др. (Июль 2003 г.). «Интеграция передачи сигналов интерферона-альфа/бета на ответы p53 при подавлении опухоли и противовирусной защите» . Природа . 424 (6948): 516–523. Bibcode : 2003natur.424..516t . doi : 10.1038/nature01850 . PMID 12872134 .
- ^ Бернштейн С., Бернштейн Х, Пейн С.М., Гаревал Х (июнь 2002 г.). «Репарация ДНК/проапоптотические двойные белки в пяти основных путях репарации ДНК: защита от неудачи от канцерогенеза». Мутационные исследования . 511 (2): 145–178. Bibcode : 2002mrrmr.511..145b . doi : 10.1016/s1383-5742 (02) 00009-1 . PMID 12052432 .
- ^ Jump up to: а беременный Kaczanowski S (май 2016 г.). «Апоптоз: его происхождение, история, поддержание и медицинские последствия для рака и старения» (PDF) . Физическая биология . 13 (3): 031001. BIBCODE : 2016 PHBIO..13C1001K . doi : 10.1088/1478-3975/13/3/031001 . PMID 27172135 . S2CID 5549982 . Архивировано из оригинала (PDF) 2019-04-28 . Получено 2019-12-26 .
- ^ Варбург О (февраль 1956 г.). «О происхождении раковых клеток». Наука . 123 (3191): 309–314. Bibcode : 1956sci ... 123..309W . doi : 10.1126/science.123.3191.309 . PMID 13298683 .
- ^ Jump up to: а беременный в дюймовый и фон Del Puerto HL, Martins AS, Milsted A, Souza-Fagundes EM, Braz GF, Hissa B, et al. (Июнь 2011 г.). «Вирус собак на смене индуцирует апоптоз в клеточных линиях, полученных в шейки матки» . Virology Journal . 8 (1): 334. DOI : 10.1186/1743-422X-8-334 . PMC 3141686 . PMID 21718481 .
- ^ LC, Chen GG, Vlantis AC, Chan AT, Van Hasselt CA (Mark 2008). Полем Журнал сотовой биохимии . 103 (4): 1125–1 doi : 10.1002/ jcb.2 PMID 176688439 . 1651475S2CID
- ^ Jump up to: а беременный Niu XY, Peng ZL, Duan WQ, Wang H, Wang P (2006). «Ингибирование экспрессии онкогена HPV 16 E6 с помощью РНК -интерференции in vitro и in vivo». Международный журнал гинекологического рака . 16 (2): 743–751. doi : 10.1111/j.1525-1438.2006.00384.x . PMID 16681755 .
- ^ Лю Й., МакКалип А., Герман Б (май 2000). «Человеческий папилломавирус типа 16 E6 и HPV-16 E6/E7 сенсибилизируют кератиноциты человека к апоптозу, индуцированные химиотерапевтическими агентами: роли активации p53 и каспазы». Журнал сотовой биохимии . 78 (2): 334–349. doi : 10.1002/(SICI) 1097-4644 (20000801) 78: 2 <334 :: AID-JCB15> 3.3.CO; 2-6 . PMID 10842327 .
- ^ Boehm I (июнь 2006 г.). «Апоптоз в физиологической и патологической коже: последствия для терапии». Современное молекулярное лекарство . 6 (4): 375–394. doi : 10.2174/156652406777435390 . PMID 16900661 .
- ^ Laferla FM, Tinkle BT, Bieberich CJ, Haudenschild CC, Jay G (январь 1995 г.). «Альцгеймер - бета -пептид, индуцирует нейродегенерацию и апоптотическую гибель клеток у трансгенных мышей». Природа генетика . 9 (1): 21–30. doi : 10.1038/ng0195-21 . PMID 7704018 . S2CID 20016461 .
- ^ Mochizuki H, Goto K, Mori H, Mizuno Y (май 1996). «Гистохимическое обнаружение апоптоза при болезни Паркинсона». Журнал неврологических наук . 137 (2): 120–123. doi : 10.1016/0022-510x (95) 00336-z . PMID 8782165 . S2CID 44329454 .
- ^ Demetrius LA, Magistretti PJ, Pellerin L (2014). «Болезнь Альцгеймера: амилоидная гипотеза и обратный эффект Варбурга» . Границы в физиологии . 5 : 522. DOI : 10.3389/fphys.2014.00522 . PMC 4294122 . PMID 25642192 .
- ^ Musicco M, Adorni F, Di Santo S, Prinelli F, Pettenati C, Caltagirone C, et al. (Июль 2013). «Обратное возникновение рака и болезни Альцгеймера: популяционное исследование». Неврология . 81 (4): 322–328. doi : 10.1212/wnl.0b013e31829c5ec1 . PMID 23843468 . S2CID 22792702 .
- ^ Фархана Л., Доусон М.И., Фонтана Дж.А. (июнь 2005 г.). «Индукция апоптоза новой молекулой, связанной с ретиноидом, требует активации ядерного фактора-каппаба». РАНКА . 65 (11): 4909–4917. doi : 10.1158/0008-5472.can-04-4124 . PMID 15930313 .
- ^ Alimonti JB, Ball TB, Fowke KR (июль 2003 г.). «Механизмы гибели клеток клеток CD4+ Т при инфекции и СПИДе вируса иммунодефицита человека» . Журнал общей вирусологии . 84 (Pt 7): 1649–1661. doi : 10.1099/vir.0.19110-0 . PMID 12810858 .
- ^ Вашишта Х., Хусейн М., Кумар Д., Ядав А., Арора С., Сингхал ПК (2008). «Экспрессия ВИЧ-1 индуцирует остановку G2/м трубной клетки и апоптоз». Почечная недостаточность . 30 (6): 655–664. doi : 10.1080/08860220802134672 . PMID 18661417 . S2CID 25787186 .
- ^ Здоровье Университета Индианы. «Критерии определения СПИДа | Райли» . IU Health. Архивировано из оригинала 2013-05-26 . Получено 2013-01-20 .
- ^ Tateishi H, Monde K, Anraku K, Koga R, Hayashi Y, Ciftci HI, et al. (Август 2017). «Подсказка к беспрецедентной стратегии для ликвидации ВИЧ:« Замок и апоптоз » » . Научные отчеты . 7 (1): 8957. Bibcode : 2017natsr ... 7.8957t . doi : 10.1038/s41598-017-09129-w . PMC 5567282 . PMID 28827668 .
- ^ Jump up to: а беременный Indran IR, Tufo G, Pervaiz S, Brenner C (июнь 2011 г.). «Недавние достижения в области апоптоза, митохондрий и лекарственной устойчивости в раковых клетках» . Biochimica et Biophysica Acta (BBA) - Биоэнергетика . 1807 (6): 735–745. doi : 10.1016/j.bbabio.2011.03.010 . PMID 21453675 .
- ^ Эверетт Х, Макфадден Дж (апрель 1999 г.). «Апоптоз: врожденный иммунный ответ на вирусную инфекцию». Тенденции в микробиологии . 7 (4): 160–165. doi : 10.1016/s0966-842x (99) 01487-0 . PMID 10217831 .
- ^ Ниши Т., Цукияма-Кохара К., Тогаши К., Кохрияма Н., Кай С (ноябрь 2004 г.). «Участие апоптоза в синцитиальную гибель клеток, вызванную вирусом чумма собак». Сравнительная иммунология, микробиология и инфекционные заболевания . 27 (6): 445–455. doi : 10.1016/j.cimid.2004.01.007 . PMID 15325517 .
- ^ Jump up to: а беременный в дюймовый Acringa Go, Gomes R, Proença-Móda JL, Silva AF, Carminati Po, Silva ML, et al. (Апрель 2010). «Апоптоз, вызванный вирусной инфекцией оропоуча в клетках HeLa, зависит от экспрессии вирусного белка » вируса Исследование 149 (1): 56–6 Doi : 10.1016/ j.virusres.2009.12.0 PMID 20080135
- ^ Azevedo RS, Nunes MR, Chiang Jo, Benbath G, Vasconcelos HB, Pinto AY, et al. (Июнь 2007 г.). «Возрождение лихорадки Орупух, северная Бразилия » Возникающие инфекционные заболевания 13 (6): 912–9 Doi : 10.3201/eid1306.061114 . PMC 2792853 PMID 175532
- ^ Сантос Р.И., Родриг А.Х., Сильва М.Л., Мортара Р.А., Джамур М.К., Ал. (Декабрь 2008 г.). сказала Хела Хела вируса Исследование 138 (1–2): 139–1 doi : 10.1016/j . PMC 71114418 . PMID 18840482 .
- ^ Теодоро JG, Branton PE (март 1997 г.). «Регуляция апоптоза продуктами вирусного гена » Журнал вирусологии 71 (3): 1739–1746. Doi : 10.1128/ jvi.71.3.1739-1746.1 191242PMC 9032302PMID
- ^ Полстер Б.М., Певснер Дж., Хардвик Дж. М. (март 2004 г.). «Вирусные гомологи BCL-2 и их роль в репликации вирусов и связанных с ними заболеваний». Biochimica et Biophysica Acta (BBA) - исследования молекулярных клеток . 1644 (2–3): 211–227. doi : 10.1016/j.bbamcr.2003.11.001 . PMID 14996505 .
- ^ Jump up to: а беременный Hay S, Kannourakis G (июль 2002 г.). «Время убить: вирусные манипуляции с программой гибели клеток». Журнал общей вирусологии . 83 (Pt 7): 1547–1564. Citeseerx 10.1.1.322.6923 . doi : 10.1099/0022-1317-83-7-1547 . PMID 12075073 .
- ^ Wang XW, Gibson MK, Vermeulen W, Yeh H, Forrester K, Stürzbecher HW, et al. (Декабрь 1995). «Отмена р53-индуцированного апоптоза геном x вируса гепатита В». РАНКА . 55 (24): 6012–6016. PMID 8521383 .
- ^ Van Doorn WG, Beers EP, Dangl JL, Franklin-Tong VE, Gallois P, Hara-Nishimura I, et al. (Август 2011 г.). «Морфологическая классификация гибели клеток растений» . Гибель клеток и дифференциация . 18 (8): 1241–1246. doi : 10.1038/cdd.2011.36 . PMC 3172093 . PMID 21494263 .
- ^ Collazo C, Chacón O, Borrás O (2006). «Запрограммированная гибель клеток в растениях напоминает апоптоз животных» (PDF) . Biotechnología amplada . 23 : 1–10. Архивировано из оригинала (PDF) на 2009-03-03.
- ^ Dickman M, Williams B, Li Y, De Figueiredo P, Wolpert T (октябрь 2017 г.). «Переоценка апоптоза у растений». Природные растения . 3 (10): 773–779. doi : 10.1038/s41477-017-0020-x . PMID 28947814 . S2CID 3290201 .
- ^ Xiang J, Chao DT, Korsmeyer SJ (декабрь 1996 г.). «Индуцированная Bax гибель клеток может не потребовать интерлейкина 1 бета-конвертирующего фермента, подобных протеазам» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (25): 14559–14563. Bibcode : 1996pnas ... 9314559x . doi : 10.1073/pnas.93.25.14559 . PMC 26172 . PMID 8962091 .
- ^ Ким Дж. Х., Ли Ч. (сентябрь 2009 г.). «Атроментин-индуцированный апоптоз в клетках лейкоза человека U937». Журнал микробиологии и биотехнологии . 19 (9): 946–950. doi : 10.4014/jmb.0811.617 . PMID 19809251 . S2CID 11552839 .
Общая библиография
[ редактировать ]- Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2015). Молекулярная биология клетки (6 -е изд.). Гарлендская наука. п. 2. ISBN 978-0815344322 .
Внешние ссылки
[ редактировать ]- Апоптоз и каспаза 3 , карта протеолиза - анимация
- Апоптоз и каспаза 8 , карта протеолиза - анимация
- Апоптоз и каспаза 7 , карта протеолиза - анимация
- Словарь миникопов апоптоза - Список терминов и аббревиатуры апоптоза
- Апоптоз (запрограммированная гибель клеток)-Виртуальная библиотека биохимии, молекулярной биологии и биологии клеточной биологии 2021-04-25 на машине Wayback
- Портал исследований апоптоза
- Протоколы апоптоза апоптоза апоптоза, статьи, новости и недавние публикации.
- База данных белков, участвующих в апоптозе
- Апоптоз видео
- Видео с апоптозом (Wehi на YouTube)
- Механизмы апоптоза архивировали 2018-03-09 на страницах биологии Biology в Wayback Kimball. Простое объяснение механизмов апоптоза, вызванных внутренними сигналами (BCL-2), вдоль пути каспазы-9, каспазы-3 и каспазы-7; и по внешним сигналам (FAS и TNF), вдоль пути каспазы 8. Доступ 25 марта 2007 года.
- Wikipathways- путь апоптоза архивировал 2008-09-16 на машине Wayback
- «Найти кнопку самоуничтожения рака» . CR Журнал (весна 2007). Статья об апоптозе и раке.
- Лекция Сяодонга Ванга: Введение в апоптоз Архивировал 2013-10-29 на машине Wayback
- Короткий клип Роберта Хорвица: обнаружение запрограммированной гибели клеток
- База данных BCL-2 Архивировал 2013-10-23 на машине Wayback
- База Смерти: база данных белков, участвующих в гибели клеток, куратованная экспертами
- Европейская организация смерти клеток
- Сигнальный путь апоптоза, созданный Cusabio

