Окрашивание

Окрашивание — это метод, используемый для повышения контрастности образцов, как правило, на микроскопическом уровне. Красители и красители часто используются в гистологии (микроскопическое исследование биологических тканей ), в цитологии (микроскопическое исследование клеток ), а также в таких медицинских областях, как , гематология и цитопатология , которые сосредоточены на изучении и диагностике заболеваний гистопатология на микроскопическом уровне. . Окрашивание можно использовать для определения биологических тканей (выделение, например, мышечных волокон или соединительной ткани ), популяций клеток (классификация различных клеток крови ) или органелл внутри отдельных клеток.
В биохимии это предполагает добавление к субстрату красителя, специфичного для определенного класса ( ДНК , белки , липиды , углеводы ), для определения или количественного определения присутствия определенного соединения. Окрашивание и флуоресцентная маркировка могут служить аналогичным целям. Биологическое окрашивание также используется для маркировки клеток при проточной цитометрии и для маркировки белков или нуклеиновых кислот при гель-электрофорезе . Световые микроскопы используются для просмотра окрашенных образцов при большом увеличении, обычно с использованием светлого поля или эпифлуоресцентного освещения.
Окрашивание не ограничивается только биологическими материалами, поскольку его можно использовать и для изучения структуры других материалов; например, ламеллярные структуры полукристаллических полимеров или доменные структуры блок-сополимеров .
In vivo против In vitro
[ редактировать ]in vivo Окрашивание (также называемое витальным окрашиванием или прижизненным окрашиванием) — это процесс окрашивания живых тканей. Заставляя определенные клетки или структуры приобретать контрастные цвета, можно легко увидеть и изучить их форму ( морфологию ) или положение внутри клетки или ткани. Обычная цель — выявить цитологические детали, которые в противном случае могли бы быть неочевидными; однако окрашивание также может показать, где внутри клеток или тканей происходят определенные химические вещества или конкретные химические реакции.
Окрашивание in vitro включает окрашивание клеток или структур, которые были удалены из их биологического контекста. Некоторые пятна часто комбинируются, чтобы раскрыть больше деталей и особенностей, чем одно пятно. В сочетании со специальными протоколами фиксации и подготовки образцов ученые и врачи могут использовать эти стандартные методы в качестве последовательных и воспроизводимых диагностических инструментов. Контракраситель — это краситель, который делает клетки или структуры более видимыми, хотя основной краситель не полностью виден.
- Кристаллический фиолетовый окрашивает как грамположительные, так и грамотрицательные микроорганизмы. Обработка спиртом удаляет кристаллофиолетовую окраску только у грамотрицательных организмов. Сафранин в качестве контрастного красителя используется для окраски грамотрицательных микроорганизмов, обесцвеченных алкоголем.
В то время как ex vivo, многие клетки продолжают жить и метаболизироваться, пока они не «зафиксируются». На этом свойстве основаны некоторые методы окрашивания. Пятна, исключенные живыми клетками, но поглощенные уже мертвыми клетками, называются витальными пятнами (например, трипановый синий или йодид пропидия для эукариотических клеток). Те, которые проникают в живые клетки и окрашивают их, называются суправитальными красителями (например, новый метиленовый синий и бриллиантовый крезиловый синий для окрашивания ретикулоцитов ). Однако эти пятна в конечном итоге токсичны для организма, некоторые в большей степени, чем другие. Частично из-за их токсического взаимодействия внутри живой клетки, когда надвитальные красители проникают в живую клетку, они могут вызывать характерный рисунок окрашивания, отличный от окрашивания уже фиксированной клетки (например, «ретикулоцитарный» вид по сравнению с диффузной «полихромазией»). Для достижения желаемого эффекта красители используются в очень разбавленных растворах от 1 : 5 000 до 1 : 500 000 (Howey, 2000). Обратите внимание, что многие красители можно использовать как для живых, так и для фиксированных клеток.
Подготовка
[ редактировать ]Подготовительные шаги зависят от типа запланированного анализа. Могут потребоваться некоторые или все из следующих процедур.
Мокрые препараты используются для наблюдения за живыми организмами и могут быть изготовлены с использованием воды и определенных красителей. Жидкость добавляется на предметное стекло перед добавлением микроорганизма, а на образец в воде и красителе накладывается покровное стекло, чтобы удержать его в поле зрения . [1]
Фиксация , которая сама по себе может состоять из нескольких этапов, направлена на максимальное сохранение формы вовлеченных клеток или тканей. Иногда термофиксация используется для уничтожения, склеивания и изменения образца, чтобы он принимал пятна. Большинство химических фиксаторов (химических веществ, вызывающих фиксацию) создают химические связи между белками и другими веществами внутри образца, увеличивая их жесткость. Обычные фиксаторы включают формальдегид , этанол , метанол и/или пикриновую кислоту . Кусочки ткани можно залить парафином, чтобы повысить их механическую прочность и стабильность, а также облегчить их разрезание на тонкие ломтики. [2]
Протравы — это химические агенты, способные создавать красители для окрашивания материалов, которые в противном случае не могли бы быть окрашены.
Протравы делятся на две категории:
а) Основная протрава: Реагируйте с кислотными красителями, например, квасцами, сульфатом железа, хлоридом цетилпиридиния и т. д.
б) Кислотная протрава: Вступает в реакцию с основными красителями, например, пикриновой кислотой, дубильной кислотой и т. д.
[2] Прямое окрашивание: осуществляется без протравы.
Непрямое окрашивание: Окрашивание с помощью протравы.
| Сэр Нет. | Название метода непрямого окрашивания | Название нанесенной протравы |
|---|---|---|
| 1.) | Окраска по Граму | йод по Граму |
| 2.) | Окрашивание клеточной стенки а.) Метод Рингера б.) Метод Дьяра | 10% дубильной кислоты 0,34% цена за клик |
| 3.) | Окрашивание жгутиков а.) Метод Лейфсона б.) Метод Леффлера | Дубильная кислота в пятне Лейфсона Протрава Леффлера (20% дубильной кислоты) |
| 4.) | Окрашивание спирохетами а.) Метод Фонтаны б.) Метод Беккера | Протрава Фонтана(5%Дубильная кислота) Протрава Фонтана(5%Дубильная кислота) |
Пермеабилизация включает обработку клеток (обычно) мягким поверхностно-активным веществом . Эта обработка растворяет клеточные мембраны и позволяет более крупным молекулам красителя проникнуть внутрь клетки.
Монтаж обычно включает в себя прикрепление образцов к предметному стеклу микроскопа для наблюдения и анализа. В некоторых случаях клетки можно выращивать прямо на предметном стекле. Для образцов рыхлых клеток (например, мазков крови или мазков Папаниколау ) образец можно наносить непосредственно на предметное стекло. Для более крупных кусков ткани делают тонкие срезы (срезы) с помощью микротома ; эти фрагменты затем можно смонтировать и проверить.
Стандартизация
[ редактировать ]Большинство красителей, обычно используемых в микроскопии, доступны в виде красителей, сертифицированных BSC . Это означает, что образцы партии производителя были протестированы независимым органом, Комиссией по биологическому окрашиванию ( BSC ), и признаны соответствующими или превосходящими определенные стандарты чистоты, содержания красителей и эффективности методов окрашивания, что обеспечивает более точное проведение экспериментов и более надежную работу. результаты. Эти стандарты опубликованы в журнале комиссии «Биотехника и гистохимия» . [3] Многие красители различаются по составу от одного поставщика к другому. Использование красителей, сертифицированных BSC, исключает источник неожиданных результатов. [4]
Некоторые продавцы продают пятна, «сертифицированные» ими самими, а не Комиссией по биологическим пятнам. Такие продукты могут подходить или не подходить для диагностических и других применений. [5]
Негативное окрашивание
[ редактировать ]
Простой метод окрашивания бактерий, который обычно дает положительный результат, даже если методы положительного окрашивания неэффективны, — это использование отрицательного окрашивания . Этого можно добиться, нанеся образец на предметное стекло и затем нанеся нигрозин (черный синтетический краситель) или тушь (водная суспензия частиц углерода). После высыхания микроорганизмы можно рассматривать в светлопольной микроскопии как более светлые включения, хорошо контрастирующие с окружающей их темной средой. [6] Отрицательное окрашивание позволяет окрасить фон, а не организмы, поскольку клеточная стенка микроорганизмов обычно имеет отрицательный заряд, который отталкивает отрицательно заряженное пятно. Красители, используемые при негативном окрашивании, являются кислотными. [1] Примечание: негативное окрашивание — это мягкий метод, который не может уничтожить микроорганизмы и поэтому непригоден для изучения патогенов.
Положительное окрашивание
[ редактировать ]В отличие от негативного окрашивания, при позитивном окрашивании используются основные красители для окрашивания образца на ярком фоне. Хотя хромофор используется как для отрицательного, так и для положительного окрашивания, тип хромофора, используемый в этом методе, представляет собой положительно заряженный ион, а не отрицательный. Отрицательно заряженная клеточная стенка многих микроорганизмов притягивает положительно заряженный хромофор, который заставляет образец поглощать краситель, придавая ему цвет используемого красителя. Положительное окрашивание в микробиологии используется чаще, чем отрицательное. Ниже перечислены различные типы позитивного окрашивания. [1]
Простое и дифференциальное
[ редактировать ]Простое окрашивание — это метод, при котором на предметном стекле одновременно используется только один тип пятна. Поскольку используется только одно пятно, образцы (для положительных пятен) или фон (для отрицательных пятен) будут одного цвета. Поэтому простые пятна обычно используются для просмотра только одного организма на предметном стекле. Дифференциальное окрашивание использует несколько пятен на предметное стекло. В зависимости от используемых красителей организмы с разными свойствами будут иметь разные цвета, что позволяет классифицировать несколько образцов. Дифференциальное окрашивание также можно использовать для окраски различных органелл внутри одного организма, что можно увидеть при окрашивании эндоспор . [1]
Типы
[ редактировать ]| Сэр Нет. | Техника окрашивания | Подготовка | Приложение | Результат |
|---|---|---|---|---|
| 1. | Простой (Монохромный) | Нанесите пятно одним красителем. например, метиленовый синий, сафранин °≤× ←→ и т. д. | Используется для выделения микробов и иллюстрации клеточных формы и расположение | Организмы окрашиваются в цвет нанесенной морилки. |
| 2. | Негатив (Облегчение) | Мазок смешали с нигрозином и намазали. в тонкую пленку | Изучите морфологию клеток | Организм окрашен, фон черный. |
| 3 | Грамм | Первичное окрашивание: кристаллический фиолетовый наносится на пленку, затем обрабатывается йодом (протрава), спиртом (обесцвечиватель) и окрашивается сафранином. | Характеризует бактерии одной из двух групп: грамположительных или грамотрицательных. | Грамположительный цвет имеет фиолетовый цвет. Грамотрицательный имеет розовый цвет. |
| 4 | Кислотоустойчивый (метод Циля-Нильсена) | Пленка, окрашенная горячим обесцвеченным ZNCF (кислотно-спиртовым) и встречная окраска метиленовым синим. | Отделение необесцвеченных кислотоустойчивых бактерий от окрашенных некислотоустойчивых бактерий. | Кислотоустойчивые бактерии:Красные. Некислотостойкий: Синий |
| 5 | Эндоспора (метод Дорнора) | Первичное окрашивание малахитовым зеленым нагревом, фиксированное для проникновения в споры; вегетативные клетки докрашивают сафранином. | Обнаруживает наличие эндоспор у шести родов бактерий. | Эндоспоры: зеленые Вегетативные клетки: красные |
| 6 | Капсула А: Метод Хисса (Позитивная техника) Б: Техника Маневальса (Негатив) | Мазок, окрашенный красителем Хисса после обработки медным купоросом Наносится бактериальная суспензия вместе с Конго красным и наносится краситель Маневаля. | Капсулы можно наблюдать как прозрачные зоны, окружающие клетки капсулированных бактерий, и их используют для демонстрации наличия капсул. | Капсула: светло-фиолетового/бледно-лилового цвета. Бактерии: Фиолетовая капсула, бактериальная клетка, выделяется на темном фоне. |
| 7 | Клеточная стенка (метод Дайара) | Мазок обрабатывают CPC, который диссоциирует с образованием положительно заряженных ионов цетилпиридиния и отрицательно заряженных ионов хлорида. Положительно заряженные ионы адсорбируются на отрицательно заряженной клеточной стенке. | Окрашивает клеточную стенку бактерии | Клеточная стенка: красная. Цитоплазма: синяя. |
| 8 | Жгутики (метод Лейфсона) | Протрава утолщает жгутики перед окрашиванием и увеличивает микроскопическую видимость при окрашивании красителем Лейфсона. | Демонстрирует наличие жгутиков | Жгутики: красные. Вегетативные клетки: синие. |
| 9 | Ядерный материал (метод Фельгена) | Мазок обрабатывают гидролизом для высвобождения пуринов из ДНК, пурины вызывают переход от фуранозы к альдегиду. Альдегидные группы могут вступать в реакцию с реагентом Шиффа с образованием аддитивных соединений. | Продемонстрировать наличие ДНК в клетке. Но для обнаружения ДНК РНК должна быть избирательно разрушена кислотным гидролизом, не затрагивая ДНК. | Ядерный материал – розовато-фиолетовый, Цитоплазма – бесцветная |
| 10 | Метахроматические гранулы (метод Альбертса) | Мазок сначала обрабатывают хлороформом для удаления жиров. Нанесите мазок красителем Альбертса, содержащим катионные красители, такие как толуидиновый синий и малахитовый зеленый. Толуидиновый синий преимущественно окрашивает гранулы, тогда как малахитовый зеленый окрашивает цитоплазму. | Гранулы демонстрируют типичный монохроматизм, это используется для демонстрации гранул. | Гранулы: синевато-черные. Цитоплазма: зеленая. |
| 11 | Внутриклеточные липиды (метод Бердона) | Липиды окрашивают жирорастворимыми красителями, например суданом черным. При применении суданских красителей black-B переходят в липиды и удерживаются там, в то время как цитоплазма окрашивается сафранином. | Для обнаружения присутствия липидов в клеточной стенке, клеточной мембране или жировых глобулах (ПГБ в цитоплазме) | Липидные гранулы: темно-синие, Цитоплазма: светло-розовая. |
| 12 | Полисахариды (метод Хотча) | Полисахарид окисляется периодатом с образованием полиальдегида, который реагирует с реагентами Шиффа до красного цвета, а цитоплазма окрашивается малахитовым зеленым. | Обнаруживает накопление полисахаридных гранул в клетках | Полисахарид: Красный Цитоплазма: Зеленый |
Техники
[ редактировать ]Грамм
[ редактировать ]Окрашивание по Граму используется для определения статуса по Граму и классификации бактерий в широком смысле на основе состава их клеточной стенки . При окрашивании по Граму используется кристаллический фиолетовый для окрашивания клеточных стенок, йод (в качестве протравы) и контрастное окрашивание фуксином или сафранином для (маркировки всех бактерий). Статус по Граму помогает разделить образцы бактерий на две группы, обычно представляющие их основную филогению. Эта характеристика в сочетании с другими методами делает его полезным инструментом в лабораториях клинической микробиологии, где он может иметь важное значение для раннего выбора подходящих антибиотиков . [8]
На большинстве препаратов, окрашенных по Граму, грамотрицательные организмы кажутся красными или розовыми из-за контрастного окрашивания. Из-за более высокого содержания липидов после обработки спиртом пористость клеточной стенки увеличивается, следовательно, комплекс CVI (кристаллический фиолетовый – йод) может проходить сквозь нее. Таким образом, первичное пятно не сохраняется. Кроме того, в отличие от большинства грамположительных бактерий, грамотрицательные бактерии имеют лишь несколько слоев пептидогликана и вторичную клеточную мембрану, состоящую преимущественно из липополисахарида.
Эндоспора
[ редактировать ]Окрашивание эндоспор используется для выявления наличия или отсутствия эндоспор , которые затрудняют уничтожение бактерий. Бактериальные споры трудно окрасить, поскольку они непроницаемы для водных красящих реагентов. Окрашивание эндоспор особенно полезно для идентификации бактериальных патогенов , образующих эндоспоры , таких как Clostridium difficile . До разработки более эффективных методов такое окрашивание проводили методом Вирца с термофиксацией и контрастным окрашиванием. Благодаря использованию малахитового зеленого и разбавленного карболфуксина фиксация бактерий в осмиевой кислоте стала отличным способом избежать смешивания красителей. Однако недавно пересмотренные методы окрашивания значительно сократили время, необходимое для создания этих пятен. Этот пересмотр включал замену карболфуксина водным сафранином в сочетании с недавно разведенной 5% формулой малахитового зеленого. Этот новый улучшенный состав пятен выполнялся так же, как и раньше, с использованием термофиксации, промывания и промокания для последующего исследования. При исследовании все бактерии, образующие эндоспоры, окрашиваются в зеленый цвет, а все остальные клетки становятся красными. [9]
Зиль-Нильсен
[ редактировать ]Окраска по Цилю-Нильсену представляет собой кислотоустойчивую краску, используемую для окрашивания видов Mycobacterium Tuberculosis , которые не окрашиваются стандартными лабораторными процедурами окрашивания, такими как окрашивание по Граму.
Это окрашивание осуществляется с использованием как красного карболфуксина , который окрашивает бактерии, так и встречного окрашивания, такого как метиленовый синий .
Гематоксилин и эозин (H&E)
[ редактировать ]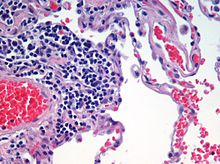
Окрашивание гематоксилином и эозином часто используется в гистологии для исследования тонких срезов тканей. [10] Гематоксилин окрашивает ядра клеток в синий цвет, а эозин окрашивает цитоплазму, соединительную ткань и другие внеклеточные вещества в розовый или красный цвет. [10] Эозин сильно поглощается эритроцитами , окрашивая их в ярко-красный цвет. В умело приготовленном препарате ГЭ эритроциты становятся почти оранжевыми, а коллаген и цитоплазма (особенно мышечная) приобретают разные оттенки розового.
Мазок Папаниколау
[ редактировать ]Окрашивание по Папаниколау , или окрашивание PAP, было разработано для замены тонкоигольной аспирационной цитологии (FNAC) в надежде сократить время и стоимость окрашивания без ущерба для качества. Это окрашивание является часто используемым методом исследования образцов клеток из различных типов тканей в различных органах. Окрашивание PAP претерпело несколько модификаций, чтобы стать «подходящей альтернативой» FNAC. Этот переход произошел из-за того, что ученые по достоинству оценили влажные фиксированные мазки, сохраняющие структуру ядер, в отличие от непрозрачного вида высушенных на воздухе мазков Романовского. Это привело к созданию гибридного красителя, фиксируемого влажным способом и высушенного на воздухе, известного как сверхбыстрое окрашивание Папаниколау. Эта модификация включает использование назального физиологического раствора для регидратации клеток и повышения прозрачности клеток и сочетается с использованием спиртового формалина для улучшения цвета ядер. Окрашивание Папаниколау теперь используется вместо цитологического окрашивания во всех типах органов из-за повышения морфологического качества, сокращения времени окрашивания и снижения стоимости. Его часто используют для окрашивания. Образцы мазков Папаниколау . [11] Он использует комбинацию гематоксилина , оранжевого G , эозина Y , светло-зеленого SF желтоватого цвета и иногда бисмарка коричневого Y. [10] [11] [12]
НЕТ
[ редактировать ]
[13] Периодическая кислота-Шиффа — это специальный гистологический краситель, используемый для маркировки углеводов ( гликоген , гликопротеин , протеогликаны ). PAS обычно используется на тканях печени, где образуются отложения гликогена, что делается для того, чтобы различить различные типы заболеваний, связанных с накоплением гликогена. PAS важен, поскольку с его помощью можно обнаружить гранулы гликогена, обнаруженные в опухолях яичников и поджелудочной железы эндокринной системы, а также в мочевом пузыре и почках почечной системы. Базальные мембраны также могут обнаруживаться при окрашивании PAS и могут иметь важное значение при диагностике заболеваний почек. Из-за большого количества углеводов в клеточной стенке гиф и дрожжевых форм грибов окраска Периодической кислотой-Шиффа может помочь обнаружить эти виды в образцах тканей человеческого тела.
Массон
[ редактировать ]Трихром Массона (как следует из названия) представляет собой протокол трехцветного окрашивания. Рецепт развился из оригинальной техники Массона для различных конкретных применений, но все они хорошо подходят для различения клеток из окружающей соединительной ткани . Большинство рецептов дают красный цвет кератина и мышечных волокон, синее или зеленое окрашивание коллагена и костей , светло-красное или розовое окрашивание цитоплазмы и ядра черных клеток .
Романовский
[ редактировать ]Окраска Романовского считается эффектом полихромного окрашивания и основана на сочетании эозина плюс (химически восстановленного эозина ) и деметилированного метиленового синего (содержащего продукты его окисления азур А и лазурь Б ). Это окрашивание дает разные цвета для всех клеточных структур («эффект Романовского-Гимзы») и поэтому использовалось для окрашивания полиморфов нейтрофилов и ядер клеток. Общие варианты включают окраску Райта , окраску Дженнера , окраску Мэй-Грюнвальда, окраску Лейшмана и окраску Гимзы .
Все они используются для исследования крови или костного мозга образцов . Они предпочтительнее H&E для проверки клеток крови, поскольку можно легко различить разные типы лейкоцитов (лейкоцитов). Все они также подходят для исследования крови на предмет выявления передающихся через кровь паразитов, таких как малярия . [14]
Серебро
[ редактировать ]
Окрашивание серебром — это использование серебра для окрашивания гистологических срезов . Этот вид окрашивания важен для демонстрации белков (например, коллагена III типа ) и ДНК . Он используется для отображения веществ внутри и снаружи клеток . Окрашивание серебром также используется в гель-электрофорезе в градиенте температуры .
Клетки аргентафина восстанавливают раствор серебра до металлического серебра после формалином фиксации . Этот метод был открыт итальянцем Камилло Гольджи , используя реакцию между нитратом серебра и дихроматом калия , таким образом осаждая хромат серебра в некоторых клетках (см. метод Гольджи ). Ригирофильные клетки восстанавливают раствор серебра до металлического серебра после воздействия пятна, содержащего восстановитель . Примером этого может быть гидрохинон или формалин.
Судан
[ редактировать ]При окрашивании суданом используются судановые красители для окрашивания суданофильных веществ, часто включая липиды . Судан III , Судан IV , Oil Red O , четырехокись осмия и Sudan Black B. Часто используются Окрашивание суданом часто используют для определения уровня жира в кале при диагностике стеатореи .
Вирц-Конклин
[ редактировать ]Окраска Вирца-Конклина представляет собой специальный метод, разработанный для окрашивания настоящих эндоспор с использованием красителя малахитового зеленого в качестве основного красителя и сафранина в качестве контрастного красителя. После окрашивания они не обесцвечиваются. Добавление тепла во время процесса окрашивания является огромным фактором, способствующим этому. [15] Тепло помогает открыть мембрану споры, чтобы краситель мог проникнуть внутрь. Основная цель этого окрашивания — показать прорастание бактериальных спор. Если процесс прорастания идет, то за счет малахитового зеленого спора приобретет зеленый цвет, а от сафранина окружающая клетка станет красной. Это пятно также может помочь определить ориентацию спор внутри бактериальной клетки; будь то терминальный (на кончике), субтерминальный (внутри клетки) или центральный (полностью в середине клетки).
Коллаген-гибридизирующий пептид
[ редактировать ]Окрашивание коллагеновым гибридизирующим пептидом (CHP) позволяет легко и напрямую окрасить денатурированные коллагены любого типа (типа I, II, IV и т. д.), независимо от того, были ли они повреждены или разложены ферментативными, механическими, химическими или термическими средствами. Они работают путем повторного сворачивания в тройную спираль коллагена с имеющимися одиночными нитями в ткани. ГПК можно визуализировать с помощью простого флуоресцентного микроскопа .
Распространенные биологические пятна
[ редактировать ]Различные пятна реагируют или концентрируются в разных частях клетки или ткани, и эти свойства используются с пользой для выявления определенных частей или областей. Ниже перечислены некоторые из наиболее распространенных биологических пятен. Если не указано иное, все эти красители можно использовать с фиксированными клетками и тканями; отмечены витальные красители (пригодные для использования с живыми организмами).
Акридиновый оранжевый
[ редактировать ]Акридиновый оранжевый (АО) представляет собой селективный флуоресцентный катионный краситель нуклеиновых кислот, используемый для определения клеточного цикла. Он проницаем для клеток и взаимодействует с ДНК и РНК путем интеркаляции или электростатического притяжения. При связывании с ДНК он очень похож по спектру на флуоресцеин. Как и флуоресцеин, он также полезен в качестве неспецифического красителя для подсветки традиционно окрашенных клеток на поверхности твердого образца ткани (окрашивание с флуоресцентной подсветкой). [16] ).
Бисмарк коричневый
[ редактировать ][17] Коричневый Бисмарка (также коричневый Бисмарк Y или манчестерский коричневый) придает желтый цвет кислым муцинам и интенсивный коричневый цвет тучным клеткам. По умолчанию это пятно закрашивает любую другую структуру, окружающую его, и снижает качество контраста. Чтобы быть полезным, его необходимо сочетать с другими пятнами. Некоторые дополнительные красители, используемые вместе с коричневым Бисмарком, - это гематоксилин и толуидиновый синий, которые обеспечивают лучший контраст в гистологическом образце.
Кармин
[ редактировать ]
Кармин — ярко-красный краситель, используемый для окрашивания гликогена , а квасцы кармина — ядерное окрашивание. Карминные пятна требуют использования протравы, обычно алюминиевой .
Кумасси синий
[ редактировать ]Кумасси синий (также блестящий синий) неспецифически окрашивает белки в яркий синий цвет. Его часто используют в гель-электрофорезе.
Крезил фиолетовый
[ редактировать ]Крезиловый фиолетовый окрашивает в фиолетовый цвет кислые компоненты цитоплазмы нейронов, в частности тельца Ниссля . Часто используется в исследованиях мозга.
Кристаллический фиолетовый
[ редактировать ]Кристаллический фиолетовый в сочетании с подходящей протравой окрашивает стенки клеток в фиолетовый цвет. Кристаллический фиолетовый – краситель, используемый при окраске по Граму.
ДАПИ
[ редактировать ]DAPI представляет собой флуоресцентное ядерное пятно, возбуждаемое ультрафиолетовым светом и проявляющее сильную синюю флуоресценцию при связывании с ДНК . DAPI связывается с A=T-богатыми повторами хромосом. DAPI также не виден при обычной трансмиссионной микроскопии. Его можно использовать в живых или фиксированных клетках. Клетки, окрашенные DAPI, особенно подходят для подсчета клеток. [18]
Эозин
[ редактировать ]Эозин чаще всего используется в качестве контрастного красителя гематоксилину, придавая розовый или красный цвет цитоплазматическому материалу, клеточным мембранам и некоторым внеклеточным структурам. ярко-красный цвет Он также придает эритроцитам . Эозин также можно использовать в качестве контрастного красителя в некоторых вариантах окрашивания по Граму и во многих других протоколах. На самом деле существует два очень близкородственных соединения, обычно называемых эозином. Чаще всего используется эозин Y (также известный как эозин Y ws или эозин желтоватый); он имеет слегка желтоватый оттенок. Другое соединение эозина — это эозин B (эозин голубоватый или имперский красный); он имеет очень слабый голубоватый оттенок. Эти два красителя взаимозаменяемы, и использование того или другого в большей степени зависит от предпочтений и традиций.
Бромистый этидий
[ редактировать ]Бромид этидия интеркалирует и окрашивает ДНК, образуя флуоресцентное красно-оранжевое пятно. Хотя он не окрашивает здоровые клетки, его можно использовать для идентификации клеток, находящихся на финальной стадии апоптоза — такие клетки имеют гораздо более проницаемые мембраны . Следовательно, бромид этидия часто используется в качестве маркера апоптоза в популяциях клеток и для определения местоположения полос ДНК при гель-электрофорезе . Краситель также можно использовать в сочетании с акридиновым оранжевым (АО) для подсчета жизнеспособных клеток. Это комбинированное окрашивание EB/AO заставляет живые клетки флуоресцировать зеленым, в то время как апоптозные клетки сохраняют характерную красно-оранжевую флуоресценцию.
Кислота фуксин
[ редактировать ]Кислоту фуксина можно использовать для окрашивания коллагена, гладких мышц или митохондрий .Кислый фуксин используется в качестве ядерного и цитоплазматического красителя в трихромном методе Мэллори. Кислый фуксин окрашивает цитоплазму некоторых вариантов трихрома Массона. В пикрофуксине Ван Гисона кислый фуксин придает красный цвет коллагеновым волокнам. Кислота фуксин также является традиционным красителем митохондрий (метод Альтмана).
гематоксилин
[ редактировать ]Гематоксилин (гематоксилин в Северной Америке) представляет собой ядерное пятно. [10] Применяют с протравой, гематоксилин окрашивает ядра в сине-фиолетовый или коричневый цвет. [10] Его чаще всего используют вместе с эозином при окрашивании H&E (гематоксилином и эозином), одной из наиболее распространенных процедур в гистологии . [10]
Пятна Хехста
[ редактировать ]Hoechst представляет собой бис производное которое связывается с малой бороздкой ДНК -бензимидазола , . Красители Хёхста, которые часто используются во флуоресцентной микроскопии для окрашивания ДНК, кажутся желтыми при растворении в водных растворах и излучают синий свет при УФ-возбуждении. Существует два основных типа Hoechst : Hoechst 33258 и Hoechst 33342 . Эти два соединения функционально схожи, но имеют небольшую разницу в структуре. Hoechst 33258 содержит концевую гидроксильную группу и поэтому более растворим в водных растворах, однако эта характеристика снижает его способность проникать через плазматическую мембрану . Hoechst 33342 содержит этиловую замену в концевой гидроксильной группе (т.е. этилэфирную группу), что делает его более гидрофобным и облегчает прохождение через плазматическую мембрану.
Йод
[ редактировать ]Йод используется в химии как индикатор крахмала . При смешивании крахмала с йодом в растворе появляется интенсивный темно-синий цвет, представляющий собой комплекс крахмала с йодом. Крахмал — это вещество, обычное для большинства растительных клеток, поэтому слабый раствор йода окрашивает крахмал, присутствующий в клетках. Йод является одним из компонентов метода окрашивания, известного как окрашивание по Граму , используемого в микробиологии . Используемый в качестве протравы при окрашивании по Граму йод усиливает проникновение красителя через поры клеточной стенки/мембраны.
Раствор Люголя или йод Люголя (ИКИ) представляет собой коричневый раствор, который становится черным в присутствии крахмала и может использоваться в качестве красителя для клеток, делая ядра клеток более видимыми.
Раствор Люголя, используемый с обычным уксусом (уксусной кислотой), используется для выявления предраковых и раковых изменений в тканях шейки матки и влагалища во время контрольных исследований «мазка Папаниколау» при подготовке к биопсии. Уксусная кислота заставляет аномальные клетки бледнеть до белого цвета, в то время как нормальные ткани окрашиваются в коричневый цвет красного дерева из-за йода. [19]
Малахитовый зеленый
[ редактировать ]Малахитовый зеленый (также известный как бриллиантовый зеленый B или зеленый виктория B) можно использовать в качестве сине-зеленого контрастного красителя сафранину в технике окрашивания бактерий по Хименесу. Его также можно использовать для непосредственного окрашивания спор .
Метиловый зеленый
[ редактировать ]Метиловый зеленый обычно используется в светлопольных и флуоресцентных микроскопах. [20] окрасить хроматин клеток, чтобы их было легче просматривать.
Метиленовый синий
[ редактировать ]Метиленовый синий используется для окрашивания клеток животных, например клеток щек человека, чтобы сделать их ядра более заметными. Также используется для окрашивания мазков крови в цитологии.
Нейтральный красный
[ редактировать ]Нейтральный красный (или толуиленовый красный) окрашивает вещество Ниссля в красный цвет. Обычно его используют в качестве контрастного красителя в сочетании с другими красителями.
Нил синий
[ редактировать ]Нильский синий (или нильский синий А) окрашивает ядра в синий цвет. Его можно использовать с живыми клетками.
Нильский красный
[ редактировать ]Нильский красный (также известный как нильский синий оксазон) образуется при кипячении нильского синего с серной кислотой . В результате получается смесь нильского красного и нильского синего. Нильский красный — липофильное пятно; он будет накапливаться в липидных глобулах внутри клеток, окрашивая их в красный цвет. Нильский красный можно использовать с живыми клетками. Он сильно флуоресцирует при распределении на липиды, но практически не флуоресцирует в водном растворе.
Четырехокись осмия (официальное название: тетраоксид осмия)
[ редактировать ]Тетраоксид осмия используется в оптической микроскопии для окрашивания липидов . Он растворяется в жирах и восстанавливается органическими веществами до элементарного осмия, легко видимого черного вещества.
Пропидия йодид
[ редактировать ]Йодид пропидия представляет собой флуоресцентный интеркалирующий агент, который можно использовать для окрашивания клеток. Йодид пропидия используется в качестве красителя ДНК в проточной цитометрии для оценки жизнеспособности клеток или содержания ДНК при анализе клеточного цикла или в микроскопии для визуализации ядра и других ДНК-содержащих органелл. Пропидия йодид не может проникать через мембрану живых клеток, что делает его полезным для дифференциации некротических, апоптотических и здоровых клеток. ПИ также связывается с РНК, что требует обработки нуклеазами, чтобы различать окрашивание РНК и ДНК.
Родамин
[ редактировать ]Родамин представляет собой белок-специфическое флуоресцентное пятно, обычно используемое во флуоресцентной микроскопии.
Сафранин
[ редактировать ]Сафранин (или сафранин О) — катионный краситель красного цвета. Он связывается с ядрами (ДНК) и другими тканевыми полианионами , включая гликозаминогликаны в хрящах и тучных клетках, а также с компонентами лигнина и пластид в тканях растений. [21] Сафранин не следует путать с шафраном, дорогим природным красителем, который используется в некоторых методах для придания коллагену желтого цвета, чтобы контрастировать с синим и красным цветом, придаваемым другими красителями ядрам и цитоплазме тканей животных (в том числе человека).
Широко используется неправильное написание «сафранин». Окончание -ine подходит для сафранина O, поскольку этот краситель является амином. [4] [22] [23]
Стойкость тканей
[ редактировать ]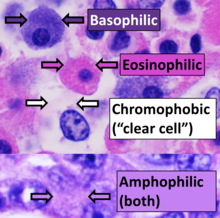
Ткани, впитывающие пятна, называются хроматическими . Хромосомы были названы так из-за их способности поглощать фиолетовое пятно.
Положительное сродство к определенному пятну может обозначаться суффиксом -philic . Например, ткани, окрашивающиеся лазурным пятном, можно назвать азурофильными . Это также можно использовать для более общих свойств окрашивания, таких как ацидофильные для тканей, которые окрашиваются кислыми красителями (особенно эозином ), базофильные при окрашивании основными красителями и амфофильные. [24] при окрашивании как кислотными, так и основными красителями. Напротив, хромофобные ткани плохо впитывают цветные красители.
Электронная микроскопия
[ редактировать ]для усиления контраста можно использовать красители Как и в световой микроскопии, в просвечивающей электронной микроскопии . Обычно используются электронно-плотные соединения тяжелых металлов.
Фосфорновольфрамовая кислота
[ редактировать ][25] Фосфорновольфрамовая кислота является распространенным негативным пятном для вирусов , нервов , полисахаридов и других материалов биологических тканей. В основном он используется в форме с pH 0,5-2%, что делает его нейтральным, и в сочетании с водой образует водный раствор. Фосфорновольфрамовая кислота наполнена электронно-плотным веществом, которое окрашивает фон вокруг образца в темный цвет, а сам образец — в светлый. Этот процесс не является обычным позитивным методом окрашивания, когда образец темный, а фон остается светлым.
Четырехокись осмия
[ редактировать ]Четырехокись осмия используется в оптической микроскопии для окрашивания липидов . Он растворяется в жирах и восстанавливается органическими веществами до элементарного осмия, легко видимого черного вещества. Поскольку это тяжелый металл, поглощающий электроны, это, пожалуй, наиболее распространенный краситель, используемый для морфологии в биологической электронной микроскопии. Его также используют для окрашивания различных полимеров с целью изучения их морфологии методом ПЭМ. ОсО
4 очень летуч и чрезвычайно токсичен. Это сильный окислитель, так как осмий имеет степень окисления +8. Он агрессивно окисляет многие материалы, оставляя после себя отложения нелетучего осмия в более низкой степени окисления.
Четырехокись рутения
[ редактировать ]Четырехокись рутения столь же летуч и даже более агрессивен, чем тетраоксид осмия, и способен окрашивать даже материалы, устойчивые к окрашиванию осмием, например полиэтилен.
Другие химические вещества, используемые при окрашивании электронной микроскопии, включают: молибдат аммония , йодид кадмия , карбогидразид , хлорид железа , гексамин , трихлорид индия , нитрат лантана(III) , ацетат свинца , цитрат свинца , нитрат свинца(II ), , периодная кислота , фосфорномолибденовая кислота , феррицианид калия , ферроцианид калия рутений красный , серебро нитрат , протеинат серебра , хлораурат натрия , нитрат таллия , тиосемикарбазид , уранилацетат , уранилнитрат и сульфат ванадила .
См. также
[ редактировать ]- Комиссия по биологическим пятнам : сторонний контроль качества и сертификация пятен.
- Цитология : исследование клеток
- Гистология : исследование тканей
- Иммуногистохимия : использование антисывороток для маркировки специфических антигенов.
- Трис(баттофенантролиндисульфонат) рутения(II) — белковый краситель.
- Витальное пятно : пятна, которые не убивают клетки.
- СТРАНИЦА : разделение белковых молекул
- Бариевая клизма - разновидность прижизненного окрашивания, создающая контраст в рентгеновской части светового спектра.
- Диафонизация
Ссылки
[ редактировать ]- ^ Jump up to: а б с д Паркер Н. (2012). Микробиология . ОпенСтакс.
- ^ Jump up to: а б Поммервиль Дж. К. (2017). Основы микробиологии . Том. И. Джонс и Бартлетт Обучение. стр. 248, 249. ISBN. 978-1-284-10095-2 .
- ^ Пенни Д.П., Пауэрс Дж.М., Фрэнк М., Уиллис С., Чурукян С. (2002). «Анализ и тестирование биологических пятен - процедуры Комиссии по биологическим пятнам». Биотехника и гистохимия . 77 (5–6): 237–75. дои : 10.1080/714028210 . ПМИД 12564600 .
- ^ Jump up to: а б Хоробин Р., Кирнан Дж., ред. (2002). Биологические пятна Конна: Справочник красителей, красителей и флуорохромов для использования в биологии и медицине . Тейлор и Фрэнсис. ISBN 978-1-85996-099-8 .
- ^ «Список поставщиков — Комиссия по биологическим пятнам» . biostaincommission.org . Проверено 25 марта 2018 г.
- ^ Кларк Дж. (1981). Процедуры окрашивания (4-е изд.). Балтимор: Уильямс и Уилкинс. п. 412. ИСБН 978-0-683-01707-6 .
- ^ Элементарная микробиология Том I.
- ^ Стоун, Ребекка Б.; Стил, Джон CH (1 июля 2009 г.). «Влияние результатов окраски по Граму культур крови на выбор противомикробных агентов» . Американский журнал клинической патологии . 132 (1): 5–6. дои : 10.1309/AJCP9RUV0YGLBVHA . ISSN 0002-9173 . ПМИД 19864226 .
- ^ Шеффер А.Б., Фултон, доктор медицины (февраль 1933 г.). «Упрощенный метод окрашивания эндоспор». Наука . 77 (1990): 194. Бибкод : 1933Sci....77..194S . дои : 10.1126/science.77.1990.194 . ПМИД 17741261 .
- ^ Jump up to: а б с д и ж Бэнкрофт Дж., Стивенс А., ред. (1982). Теория и практика гистологических методов (2-е изд.). Лонгман Групп Лимитед.
- ^ Jump up to: а б Джилл Г.В. (2013). «Пятно Папаниколау». Цитопрепарат . Основы цитопатологии. Том. 12. стр. 143–189. дои : 10.1007/978-1-4614-4933-1_10 . ISBN 978-1-4614-4932-4 . ISSN 1574-9053 .
- ^ Тхакур М., Гуттиконда В.Р. (2017). «Модифицированная методика сверхбыстрого окрашивания по Папаниколау: сравнительное исследование» . Журнал цитологии . 34 (3): 149–153. дои : 10.4103/JOC.JOC_23_16 . ПМК 5492752 . ПМИД 28701828 .
- ^ «Периодная кислота-Шиффа (PAS): диагностические приложения - LabCE.com, Лабораторное непрерывное образование» . labce.com . Проверено 16 апреля 2020 г.
- ^ Безруков А.В. (02.01.2017). «Окрашивание Романовского, эффект Романовского и мысли по вопросу о научном приоритете». Биотехника и гистохимия . 92 (1): 29–35. дои : 10.1080/10520295.2016.1250285 . ПМИД 28098484 . S2CID 37401579 .
- ^ Кори Л. (март 1986 г.). «Лабораторная диагностика инфекций, вызванных вирусом простого герпеса. Принципы разработки экспресс-диагностических тестов». Диагностическая микробиология и инфекционные болезни . 4 (3 доп.): 111С–119С. дои : 10.1016/s0732-8893(86)80049-9 . ПМИД 3009082 .
- ^ Уэллс Дж (1988). «Методика окрашивания поверхностных клеток выщипанных волосяных фолликулов и других твердых тканей». Технология окраски . 63 (3).
- ^ Томов Н., Димитров Н. (2017). «Модифицированное окрашивание Бисмарка-коричневого для демонстрации тучных клеток мягких тканей» (PDF) . Тракийский научный журнал . 15 (3): 195–197. дои : 10.15547/tjs.2017.03.001 .
- ^ Левенфус I (2011). Эффективный метод подсчета клеток, окрашенных DAPI, с использованием Фиджи . Мюнхен: Грин. ISBN 978-3-640-86284-9 .
- ^ Селлорс Дж.В., Шанкаранараянан Р. (ред.). «Глава 4: Введение в кольпоскопию: показания к кольпоскопии, инструменты, принципы и документирование результатов». Кольпоскопия и лечение интраэпителиальной неоплазии шейки матки: пособие для начинающих . Всемирная организация здравоохранения. Архивировано из оригинала 31 января 2019 года.
- ^ Прието Д., Апарисио Г., Моранде П.Е., Золесси Ф.Р. (сентябрь 2014 г.). «Быстрый, недорогой и высокоэффективный метод флуоресцентного мечения ДНК с использованием метилового зеленого». Гистохимия и клеточная биология . 142 (3): 335–45. дои : 10.1007/s00418-014-1215-0 . hdl : 11336/35891 . ПМИД 24671497 . S2CID 11094194 .
- ^ Берлинский ГП, Микше Дж. П. (1976). Ботаническая микротехника и цитохимия . Издательство Университета штата Айова.
- ^ Бейкер-младший (1958). Принципы биологической микротехники . стр. 329 и далее. Лондон: Метуэн.
- ^ Кирнан Дж.А. (2001). «Классификация и наименование красителей, красителей и флуорохромов». Биотехника и гистохимия . 76 (5–6): 261–78. дои : 10.1080/bih.76.5-6.261.278 . ПМИД 11871748 . S2CID 32479873 .
- ^ thefreedictionary.com > амфофильный Цитируется: Большой ветеринарный словарь Сондерса , 3-е изд. 2007 Эльзевир, Инк.
- ^ «Негативное окрашивание | Центральный научно-исследовательский центр микроскопии» . cmrf.research.uiowa.edu . Проверено 16 апреля 2020 г.
Дальнейшее чтение
[ редактировать ]- Бэнкрофт Дж. Д., Гэмбл М., ред. (2002). Теория и практика гистологических методов (5-е изд.). Лондон: Черчилль-Ливингстон. ISBN 978-0-443-06435-7 .
- Кирнан Дж.А. (2015). Гистологические и гистохимические методы. Теория и практика . Банбери, Великобритания: Scion. ISBN 978-1-907904-32-5 .
- Преснелл Дж. К., член парламента Шрайбмана (1997). Техники тканей животных Хьюмасона (5-е изд.). Балтимор: Издательство Университета Джонса Хопкинса. ISBN 9780801854019 .
- Рузин С.Е. (1999). Микротехника и микроскопия растений . Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-508956-1 .
Внешние ссылки
[ редактировать ]- Комиссия по биологическому окрашиванию — независимая некоммерческая компания, которая с начала 1920-х годов проводит испытания красителей и выдает Сертификаты одобрения на партии красителей, соответствующие международно признанным стандартам.
- Справочник по красителям и техникам окрашивания.
- Жизненное окрашивание простейших и связанные с ним методы временного крепления ~ Хоуи, 2000 г.
- Говоря о фиксации: часть 1 и часть 2 – М. Халит Умар
- Микрофотографии гистологических пятен
- Часто задаваемые вопросы по упражнениям по окрашиванию на домашней странице Шридхара Рао ПН.