Новобиоцин
 | |
 | |
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Международные названия лекарств |
| Маршруты администрация | внутривенный |
| Код ATCvet | |
| Фармакокинетические данные | |
| Биодоступность | незначительная пероральная биодоступность |
| Метаболизм | выводится в неизмененном виде |
| Период полувыведения | 6 часов |
| Экскреция | почечный |
| Идентификаторы | |
| Номер CAS | |
| ПабХим CID | |
| Лекарственный Банк | |
| ХимическийПаук | |
| НЕКОТОРЫЙ | |
| КЕГГ | |
| ХЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| Информационная карта ECHA | 100.005.589 |
| Химические и физические данные | |
| Формула | С 31 Н 36 Н 2 О 11 |
| Молярная масса | 612.632 g·mol −1 |
| 3D model ( JSmol ) | |
| Температура плавления | От 152 до 156 °C (от 306 до 313 °F) (разл.) |
| (проверять) | |
Новобиоцин , также известный как альбамицин , представляет собой аминокумариновый антибиотик, вырабатываемый актиномицетом Streptomyces niveus , который недавно был идентифицирован как субъективный синоним S. spheroides. [1] представитель класса Actinomycetia . Другие аминокумариновые антибиотики включают клоробиоцин и кумермицин А1. [2] Новобиоцин впервые был описан в середине 1950-х годов (тогда он назывался стрептонивицином ). [3] [4]
Клиническое использование
[ редактировать ]Он активен в отношении Staphylococcus epidermidis и может использоваться для дифференциации его от других коагулазонегативных Staphylococcus saprophyticus , устойчивых к новобиоцину, в культуре. [ нужна ссылка ]
Новобиоцин был лицензирован для клинического применения под торговым названием Альбамицин ( Апджон ) в 1960-х годах. Его эффективность была продемонстрирована в доклинические и клинические испытания. [5] [6] Пероральная форма препарата была снята с продажи из-за недостаточной эффективности. [7] Комбинированный продукт новобиоцина и тетрациклина, продаваемый Upjohn под такими торговыми марками, как Panalba и Albamycin-T, был, в частности, предметом пристального внимания FDA, прежде чем он был окончательно снят с рынка. [8] [9] Новобиоцин — эффективный антистафилококковый агент, используемый при лечении MRSA . [10]
Механизм действия
[ редактировать ]молекулярные основы действия новобиоцина и других родственных препаратов, клоробиоцина и кумермицина А1 . Изучены [2] [11] [12] [13] [14] Аминокумарины являются очень мощными ингибиторами бактериальной ДНК-гиразы и воздействуют на субъединицу GyrB фермента, участвующего в передаче энергии. Новобиоцин, как и другие аминокумариновые антибиотики, действуют как конкурентные ингибиторы АТФазной реакции, катализируемой GyrB. Эффективность новобиоцина значительно выше, чем у фторхинолонов , которые также воздействуют на ДНК-гиразу , но на другой участок фермента. Субъединица GyrA участвует в активности разрыва ДНК и лигирования. [ нужна ссылка ]
Было показано, что новобиоцин слабо ингибирует С-конец эукариотического белка Hsp90 (высокий микромолярный IC50). Модификация каркаса новобиоцина привела к созданию более селективных ингибиторов Hsp90. [15] Также было показано, что новобиоцин связывает и активирует переносчик грамотрицательных липополисахаридов LptBFGC. [16] [17]
АТФ-связывающий карман тета-полимеразы блокируется новобиоцином, что приводит к потере активности АТФазы. Это приводит к потере опосредованного микрогомологией соединения концов как пути для клеток с дефицитом гомологичной рекомбинации, чтобы обойти агенты, повреждающие ДНК. Действие новобиоцина синергично с ингибиторами PARP в отношении уменьшения размера опухоли на мышиной модели. [18]
Структура
[ редактировать ]Новобиоцин представляет собой аминокумарин. Новобиоцин можно разделить на три группы; производное бензойной кислоты, остаток кумарина и новобиоза сахара. [11] Рентгеновские кристаллографические исследования показали, что комплекс лекарство-рецептор новобиоцина и ДНК-гиразы показывает, что АТФ и новобиоцин имеют перекрывающиеся сайты связывания на молекуле гиразы. [19] Перекрытие сайтов связывания кумарина и АТФ согласуется с тем, что аминокумарины являются конкурентными ингибиторами активности АТФазы. [20]
Отношения структура-деятельность
[ редактировать ]В экспериментах по взаимосвязи структура-активность было обнаружено, что удаление карбамоильной группы , расположенной на новобиозном сахаре, приводит к резкому снижению ингибирующей активности новобиоцина. [20]
Биосинтез
[ редактировать ]Этот аминокумариновый антибиотик состоит из трех основных заместителей. Фрагмент 3-диметилаллил-4-гидроксибензойной кислоты, известный как кольцо А, получен из префената и диметилаллилпирофосфата . Аминокумариновый фрагмент, известный как кольцо B, является производным L -тирозина. Последним компонентом новобиоцина является производное сахара L -новиоза, известное как кольцо С, которое является производным глюкозо-1-фосфата. Кластер биосинтетических генов новобиоцина был идентифицирован Хайде и его коллегами в 1999 году (опубликовано в 2000 году) из Streptomyces spheroides NCIB 11891. [21] Они идентифицировали 23 предполагаемые открытые рамки считывания (ORF) и более 11 других ORF, которые могут играть роль в биосинтезе новобиоцина. [ нужна ссылка ]
Биосинтез кольца А (см. рис. 1 ) начинается с префената, который является производным пути биосинтеза шикимовой кислоты . Фермент NovF катализирует декарбоксилирование префената , одновременно восстанавливая никотинамидадениндинуклеотидфосфат (НАДФ). + ) для производства НАДФН . После этого NovQ катализирует электрофильное замещение фенильного кольца диметилаллилпирофосфатом (DMAPP), иначе известное как пренилирование. [22] DMAPP может происходить либо по пути мевалоновой кислоты, либо по пути биосинтеза дезоксиксилулозы. Затем молекула 3-диметилаллил-4-гидроксибензоата подвергается двум окислительным декарбоксилированиям NovR и молекулярным кислородом. [23] NovR представляет собой негемовую железооксигеназу с уникальным бифункциональным катализом. На первом этапе оба кислорода включаются из молекулярного кислорода, тогда как на втором этапе включается только один, как установлено исследованиями по мечению изотопов. На этом формирование кольца А завершается.

Биосинтез кольца Б (см. рис. 2 ) начинается с природной аминокислоты L -тирозина . Затем он аденилируется и тиоэтерифицируется на пептидильном белке-переносчике (PCP) NovH с помощью АТФ и самого NovH. [24] Затем NovI дополнительно модифицирует эту связанную с PCP молекулу, окисляя β-положение с использованием НАДФН и молекулярного кислорода. NovJ и NovK образуют гетеродимер J2K2, который является активной формой бензилоксигеназы. [25] Этот процесс использует НАДФ. + в качестве акцептора гидрида при окислении β-спирта. Этот кетон предпочтет существовать в растворе в виде енольного таутомера. Затем еще неидентифицированный белок катализирует селективное окисление бензола (как показано на рис. 2). При окислении этот промежуточный продукт спонтанно лактонизируется с образованием ароматического кольца B и теряет NovH в процессе.
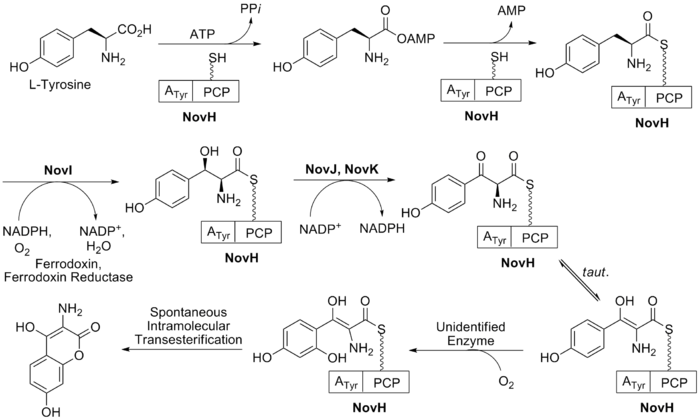
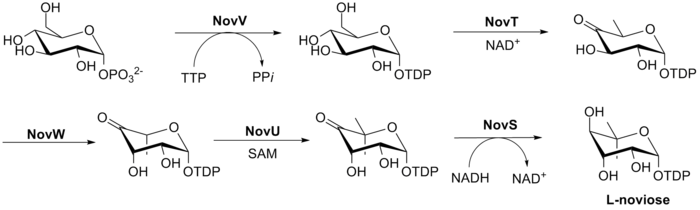
Биосинтез L -новиозы (кольцо С) показан на рис. 3 . Этот процесс начинается с глюкозо-1-фосфата, где NovV берет dTTP и заменяет фосфатную группу группой dTDP. Затем NovT окисляет 4-гидроксигруппу с помощью НАД. + . NovT также осуществляет дегидроксилирование 6-го положения сахара. Затем NovW эпимеризует 3-е положение сахара. [26] Метилирование положения 5 осуществляется NovU и S-аденозилметионином (SAM). Наконец, NovS снова восстанавливает положение 4, чтобы добиться эпимеризации этого положения из исходного глюкозо-1-фосфата с использованием НАДН .
Кольца A, B и C соединяются вместе и модифицируются, образуя готовую молекулу новобиоцина. Кольца A и B соединяются вместе ферментом NovL с использованием АТФ для дифосфорилирования карбоксилатной группы кольца A, так что карбонил может быть атакован аминогруппой в кольце B. Полученное соединение метилируется NovO и SAM перед гликозилированием. [27] NovM добавляет кольцо C ( L -новиозу) к гидроксильной группе, полученной из тирозина, с потерей dTDP. Другое метилирование осуществляется NovP и SAM в положении 4 L -новиозного сахара. [28] Это метилирование позволяет NovN карбамилировать 3-е положение сахара, как показано на рис. 4, завершая биосинтез новобиоцина.

Ссылки
[ редактировать ]- ^ Ланут Б., Ванканнейт М., Клинверк И., Ван Л., Ли В., Лю З., Свингс Дж. (май 2002 г.). «Поиск синонимов среди стрептомицетов с помощью SDS-PAGE цельноклеточных белков. Исправление видов Streptomyces aurantiacus, Streptomyces cacaoi subsp. cacaoi, Streptomyces caeruleus и Streptomyces violaceus». Международный журнал систематической и эволюционной микробиологии . 52 (Часть 3): 823–9. дои : 10.1099/00207713-52-3-823 . ПМИД 12054245 .
- ^ Jump up to: а б да Силва Эстакио А (2004). Биосинтез аминокумариновых антибиотиков у Streptomyces: создание структурных аналогов с помощью генной инженерии и понимание регуляции производства антибиотиков (кандидатская диссертация). Университет Тюбингена.
- ^ Хоксема Х., Джонсон Дж.Л., Хинман Дж.В. (декабрь 1955 г.). «Структурные исследования стрептонивицина, нового антибиотика». Журнал Американского химического общества . 77 (24): 6710–6711. дои : 10.1021/ja01629a129 .
- ^ Смит К.Г., Дитц А., Сокольски В.Т., Сэвидж Г.М. (февраль 1956 г.). «Стрептонивицин, новый антибиотик. I. Открытие и биологические исследования». Антибиотики и химиотерапия . 6 (2): 135–142. ПМИД 24543916 .
- ^ Раад И., Даруиш Р., Хашем Р., Сациловски М., Боди Г.П. (ноябрь 1995 г.). «Антибиотики и профилактика микробной колонизации катетеров» . Антимикробные средства и химиотерапия . 39 (11): 2397–400. дои : 10.1128/aac.39.11.2397 . ПМК 162954 . ПМИД 8585715 .
- ^ Раад II, Хашем Р.Ю., Аби-Саид Д., Ролстон К.В., Уимби Э., Бузаид А.С., Лега С. (январь 1998 г.). «Проспективное перекрестное рандомизированное исследование профилактики новобиоцином и рифампицином для профилактики внутрисосудистых катетерных инфекций у онкологических больных, получающих интерлейкин-2». Рак . 82 (2): 403–11. doi : 10.1002/(SICI)1097-0142(19980115)82:2<412::AID-CNCR22>3.0.CO;2-0 . ПМИД 9445199 . S2CID 10940970 .
- ^ «Заключение о том, что капсула АЛБАМИЦИНА (новобиоцина натрия), 250 миллиграммов, была снята с продажи по соображениям безопасности или эффективности» . Федеральный реестр . 19 января 2011 г.
- ^ Минц М. (август 1969 г.). «FDA и Панальба: конфликт коммерческих и терапевтических целей?». Наука . 165 (3896): 875–881. Бибкод : 1969Sci...165..875M . дои : 10.1126/science.165.3896.875 . ПМИД 5819616 .
- ^ Минц М. «Шак и джайв Апджона» . Мать Джонс . Мать Джонс и Фонд национального прогресса . Проверено 16 февраля 2022 г.
- ^ Уолш Т.Дж., Стэндифорд ХК, Реболи А.С., Джон Дж.Ф., Маллиган М.Э., Рибнер Б.С., Монтгомери Дж.З., Гетц М.Б., Мэйхолл К.Г., Римланд Д. (июнь 1993 г.). «Рандомизированное двойное слепое исследование рифампицина с новобиоцином или триметоприм-сульфаметоксазолом против колонизации метициллин-резистентного золотистого стафилококка: предотвращение устойчивости к противомикробным препаратам и влияние факторов хозяина на результат» . Антимикробные средства и химиотерапия . 37 (6): 1334–42. дои : 10.1128/aac.37.6.1334 . ЧВК 187962 . ПМИД 8328783 .
- ^ Jump up to: а б Максвелл А. (август 1993 г.). «Взаимодействие препаратов кумарина и ДНК-гиразы». Молекулярная микробиология . 9 (4): 681–6. дои : 10.1111/j.1365-2958.1993.tb01728.x . ПМИД 8231802 . S2CID 43159068 .
- ^ Максвелл А. (февраль 1999 г.). «ДНК-гираза как мишень для лекарств». Труды Биохимического общества . 27 (2): 48–53. дои : 10.1042/bst0270048 . ПМИД 10093705 .
- ^ Льюис Р.Дж., Цай Ф.Т., Вигли Д.Б. (август 1996 г.). «Молекулярные механизмы лекарственного ингибирования ДНК-гиразы». Биоэссе . 18 (8): 661–71. дои : 10.1002/bies.950180810 . ПМИД 8760340 . S2CID 9488669 .
- ^ Максвелл А., Лоусон Д.М. (2003). «АТФ-связывающий сайт топоизомераз типа II как мишень для антибактериальных препаратов». Актуальные темы медицинской химии . 3 (3): 283–303. дои : 10.2174/1568026033452500 . ПМИД 12570764 .
- ^ Ю XM, Шен Г., Некерс Л., Блейк Х., Хольцбайерляйн Дж., Кронк Б., Благг Б.С. (сентябрь 2005 г.). «Ингибиторы Hsp90, идентифицированные из библиотеки аналогов новобиоцина». Журнал Американского химического общества . 127 (37): 12778–9. дои : 10.1021/ja0535864 . ПМИД 16159253 .
- ^ Мандлер, доктор медицинских наук, Байдин В., Ли Дж., Пахил К.С., Оуэнс Т.В., Кане Д. (июнь 2018 г.). «Новобиоцин усиливает активность полимиксина, стимулируя транспорт липополисахаридов» . Журнал Американского химического общества . 140 (22): 6749–6753. дои : 10.1021/jacs.8b02283 . ПМК 5990483 . ПМИД 29746111 .
- ^ Мэй Дж.М., Оуэнс Т.В., Мандлер М.Д., Симпсон Б.В., Лазарус М.Б., Шерман Дж.Д., Дэвис Р.М., Окуда С., Массефски В., Руис Н., Кане Д. (декабрь 2017 г.). «Антибиотик новобиоцин связывает и активирует АТФазу, которая обеспечивает транспорт липополисахаридов» . Журнал Американского химического общества . 139 (48): 17221–17224. дои : 10.1021/jacs.7b07736 . ПМК 5735422 . ПМИД 29135241 .
- ^ Чжоу Дж., Гелот С., Пантелиду С., Ли А., Юсель Х., Дэвис Р.Э., Ферккиля А., Кочупураккал Б., Сайед А., Шапиро Г.И., Тайнер Дж.А., Благг Б.С., Чеккальди Р., Д'Андреа А.Д. (июнь 2021 г.). «Первый в своем классе ингибитор тета-полимеразы избирательно воздействует на опухоли с дефицитом гомологичной рекомбинации» . Природа Рак 2 (июнь 2021 г.): 598–610. дои : 10.1038/s43018-021-00203-x . ПМЦ 8224818 . ПМИД 34179826 . S2CID 235659640 .
- ^ Цай Ф.Т., Сингх О.М., Скаржински Т., Вонакотт А.Дж., Уэстон С., Такер А., Пауптит Р.А., Бриз А.Л., Пойзер Дж.П., О'Брайен Р., Ледбери Дж.Э., Вигли Д.Б. (май 1997 г.). «Кристаллическая структура с высоким разрешением фрагмента гиразы B массой 24 кДа из E. coli в комплексе с одним из самых мощных ингибиторов кумарина, клоробиоцином». Белки . 28 (1): 41–52. doi : 10.1002/(sici)1097-0134(199705)28:1<41::aid-prot4>3.3.co;2-b . ПМИД 9144789 .
- ^ Jump up to: а б Флэтман Р.Х., Эстакио А., Ли С.М., Хайде Л., Максвелл А. (апрель 2006 г.). «Связь структура-активность ингибиторов гиразы аминокумаринового типа и топоизомеразы IV, полученных комбинаторным биосинтезом» . Антимикробные средства и химиотерапия . 50 (4): 1136–42. doi : 10.1128/AAC.50.4.1136-1142.2006 . ПМЦ 1426943 . ПМИД 16569821 .
- ^ Стеффенски М., Мюленвег А., Ван З.С., Ли С.М., Хайде Л. (май 2000 г.). «Идентификация кластера генов биосинтеза новобиоцина Streptomyces spheroides NCIB 11891» . Антимикробные средства и химиотерапия . 44 (5): 1214–22. дои : 10.1128/AAC.44.5.1214-1222.2000 . ПМЦ 89847 . ПМИД 10770754 .
- ^ Пойер Ф., Вемакор Э., Каммерер Б., Чен Х., Уолш К.Т., Ли С.М., Хайде Л. (март 2003 г.). «CloQ, пренилтрансфераза, участвующая в биосинтезе клоробиоцина» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (5): 2316–21. Бибкод : 2003PNAS..100.2316P . дои : 10.1073/pnas.0337708100 . ПМЦ 151338 . ПМИД 12618544 .
- ^ Пойер Ф., Калих Р., Каммерер Б., Ли С.М., Хайде Л. (август 2003 г.). «CloR, бифункциональная негемовая железооксигеназа, участвующая в биосинтезе клоробиоцина» . Журнал биологической химии . 278 (33): 30661–8. дои : 10.1074/jbc.M303190200 . ПМИД 12777382 .
- ^ Чен Х, Уолш, Коннектикут (апрель 2001 г.). «Образование кумарина при биосинтезе новобиоцина: бета-гидроксилирование аминоацилового фермента тирозил-S-NovH цитохромом P450 NovI» . Химия и биология . 8 (4): 301–12. дои : 10.1016/S1074-5521(01)00009-6 . ПМИД 11325587 .
- ^ Пачолек М., Хиллсон, штат Нью-Джерси, Уолш, Коннектикут (сентябрь 2005 г.). «NovJ/NovK катализирует бензильное окисление фермента бета-гидрокситирозил-S-пантетеинила во время образования аминокумаринового кольца в биосинтезе новобиоцина». Биохимия . 44 (38): 12819–26. CiteSeerX 10.1.1.569.1481 . дои : 10.1021/bi051297m . ПМИД 16171397 .
- ^ Туи Т.Т., Ли ХК, Ким К.Г., Хайде Л., Сон Дж.К. (апрель 2005 г.). «Функциональные характеристики novWUS, участвующих в биосинтезе новобиоцинов из Streptomyces spheroides». Архив биохимии и биофизики . 436 (1): 161–7. дои : 10.1016/j.abb.2005.01.012 . ПМИД 15752721 .
- ^ Пахолек М., Тао Дж., Уолш Коннектикут (ноябрь 2005 г.). «CouO и NovO: C-метилтрансферазы для адаптации каркаса аминокумарина при биосинтезе антибиотиков кумермицина и новобиоцина». Биохимия . 44 (45): 14969–76. дои : 10.1021/bi051599o . ПМИД 16274243 .
- ^ Фрил Мейерс CL, Обертюр М, Сюй Х, Хайде Л, Кане Д, Уолш CT (январь 2004 г.). «Характеристика NovP и NovN: завершение биосинтеза новобиоцина путем последовательной адаптации новозильного кольца». Ангеванде Хеми . 43 (1): 67–70. дои : 10.1002/anie.200352626 . ПМИД 14694473 .